Эмболизация маточных артерий (ЭМА) в настоящее время является безопасной и эффективной альтернативой гистерэктомии для лечения симптомных миом матки [1, 2]. Основным недостатком ЭМА считается повышенная частота рецидивов клинических проявлений миом в отдаленном послеоперационном периоде по сравнению с гистерэктомией. По данным целого ряда исследований, высокий риск рецидива симптоматики после ЭМА связан с неполным некрозом миоматозных узлов после данной процедуры [3].
Цели и задачи данной работы были следующие:
- Провести ЭМА у пациенток с различными типами миоматозных узлов, по данным магнитно-резонансной томографии (МРТ) с динамическим контрастным усилением, применяя эмболизирующий материал различных размеров.
- Определить эффективность использования эмболизирующего материала различных размеров в зависимости от типа кровоснабжения миоматозных узлов по данным динамической контрастной МРТ.
- Разработать алгоритм выбора размера эмболизирующего материала для ЭМА у пациенток с миомой матки.
Материал и методы исследования
Проводилось проспективное исследование. Все пациентки подписали форму информированного согласия на участие. Было получено одобрение этического комитета. В работу были включены 63 пациентки, прошедшие ЭМА по поводу миомы матки в период с апреля 2011 г. по февраль 2013 г. Средний возраст больных составил 46±5,8 года.
Критерии включения в исследование: наличие симптомной миомы матки, наличие информированного согласия на органосберегающее лечение, пременопауза. Критерии исключения: любые полостные хирургические вмешательства на матке и ее придатках в анамнезе, наличие ЭМА в анамнезе, наличие по крайней мере одного миоматозного узла субсерозной или субмукозной локализации на ножке, наличие тяжелых сопутствующих заболеваний, аллергические реакции на контрастное вещество в анамнезе, подозрение на злокачественное образование матки и ее придатков.
Диагноз миомы матки устанавливался амбулаторно во время скринингового ультразвукового исследования. Все пациентки проходили стандартный комплекс обследования перед хирургическим вмешательством на матке, включающий мазок по Папаниколау и пайпель-биопсию эндометрия.
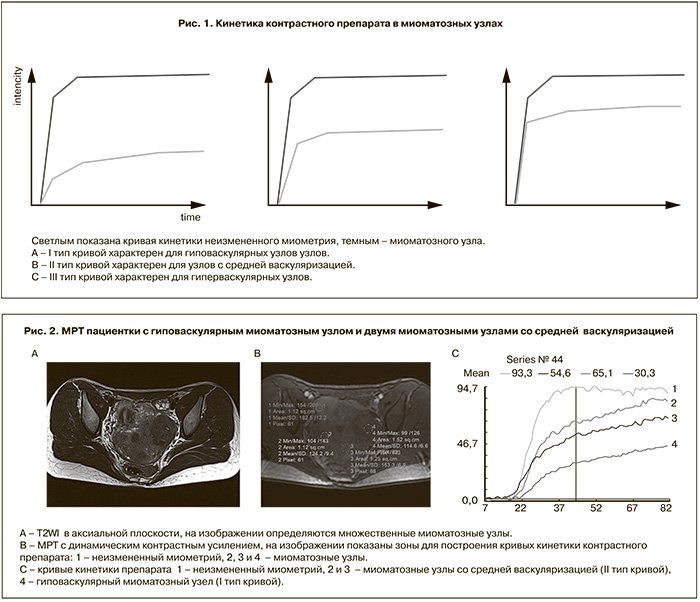
Всем пациенткам выполняли МРТ-исследование с болюсным контрастным усилением и последующей оценкой кинетики контрастного препарата в миоматозных узлах. МРТ выполняли на томографе с индукцией магнитного поля 3Т по протоколу, представленному в таблице. В качестве контрастного препарата использовали гадопентетат димеглюмина, введение препарата осуществляли с помощью автоматического инжектора со скоростью 4,5 мл/сек в локтевую вену одновременно с началом динамического сканирования, количество вводимого контрастного препарата рассчитывали из соотношения 0,2 мл (1 ммоль)/кг массы тела пациентки. В дальнейшем проводили подсчет количества миоматозных узлов и расчет их объема на T2WI полученных с помощью импульсной последовательности 3D-Space с использованием программного обеспечения рабочей станции SyngoVia. Построение кривых кинетики контрастного препарата выполняли по результатам динамического сканирования с использованием импульсной последовательности TWIST (время получения одной серии изображений 3 с, количество серий – 100) с использованием программного обеспечения MeanCurve рабочей станции SyngoVia. Исследования проводили двукратно: на первом этапе не ранее чем за 10 суток до операции, на втором этапе – через 24–48 ч после операции. На исследованиях после выполнения ЭМА дополнительно рассчитывали объем не кровоснабжаемой части узла, который определялся как зона отсутствия накопления препарата на отсроченных T1WI полученных с помощью последовательности 3D-Vibe; расчет производился с использованием программного обеспечения рабочей станции SyngoVia.
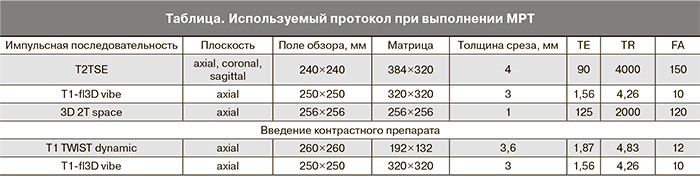
Все миоматозные узлы были классифицированы в зависимости от типа кривой кинетики контрастного препарата по отношению к неизмененному миометрию на три типа: I тип – «гиповаскулярный» узел, для которого было характерно замедленное начальное накопление контрастного препарата по сравнению с миометрием, II тип – узел со «средней васкуляризацией», который накапливал препарат несколько медленнее миометрия, и III тип – «гиперваскулярный» узел, для которого скорость начального накопления контрастного препарата была идентична миометрию (рис. 1, 2; рис. 3 см. на вклейке). Оценка типа узла проводилась двумя рентгенологами независимо друг от друга. В случае расхождения в оценке типа кривой исследование оценивалось третьим рентгенологом, и решение о типе узла принималось по большинству совпадений оценок.
Пациентки были рандомизированы в две группы в зависимости от размера используемого эмболизирующего материала – в 1-й группе (32 пациентки, 181 миоматозный узел) использовались калиброванные микросферы из поливинилалкоголя размером 500–700 мкм, во 2-й группе (31 пациентка, 149 миоматозных узлов) использовались аналогичные микросферы размером 700–900 мкм. Рандомизация проводилась после выполнения амбулаторного обследования на приеме гинеколога с помощью запечатанных конвертов с индивидуальными номерами. Общее количество выявленных миоматозных узлов составило 330 (от 1 до 16). Среднее количество миоматозных узлов на одну пациентку составило 5,2±2,9.
Во всех случаях выполнялась двусторонняя ЭМА правосторонним трансфеморальным доступом. У всех пациенток использовалась селективная катетеризация маточных артерий с помощью микрокатетеров для профилактики спазма маточных артерий и обеспечения свободного кровотока при введении эмболизирующего материала. Введение эмболизирующего материала проводилось до остановки кровотока в крупных ветвях маточной артерии и появления рефлюкса в ней. Повторная катетеризация и ангиография маточных артерий проводилась во всех случаях не менее чем через 5 минут после введения основной порции эмболизирующего материала. При необходимости выполнялась дополнительная эмболизация частицами того же размера (рис. 4 см. на вклейке).
Основным критерием непосредственной эффективности ЭМА являлся объем не кровоснабжающейся ткани (ОНТ) миоматозного узла и количество узлов с ОНТ более 95% по результатам контрольного МРТ-исследования [4, 5]. Дополнительно оценивалось количество потраченного эмболизирующего материала (мл) и тяжесть болевого синдрома за сутки до и в первые сутки после вмешательства (с помощью числовой шкалы) через 2, 6 и 12часов после окончания ЭМА, оценке подвергалось наибольшее значение [6].
Полученные результаты были обработаны с помощью программного пакета IBM SPSS Statistics 20 для подтверждения статистической достоверности.
Результаты исследования
У всех пациенток выполнены технически успешные двусторонние ЭМА. По данным предоперационного МРТ-исследования из 330 выявленных миоматозных узлов 188 (57%) были отнесены к I типу, 73 (22,1%) – ко II типу, 69 (20,9%) – к III типу. В 23 (6,9%) случаях оценки типов узлов двух независимых рентгенологов не совпали; в 11 (3,3%) случаях потребовалось мнение третьего специалиста для дифференцировки между I и II типами узлов; в 12 (3,6%) случаях между II и III типами узлов. В первой группе пациенток распределение миоматозных узлов по типам составило 107/33/41 соответственно, во второй группе – 81/40/28 соответственно (рис. 5).
Эффективность ЭМА оценивали сравнением объема узла, измеренного на Т2-3D-Space, с объемом не кровоснабжаемой части узла, измеренного на отсроченных 3D-Vibe томограммах после введения контрастного препарата. Примеры измерений представлены на рис. 6 (см. на вклейке).
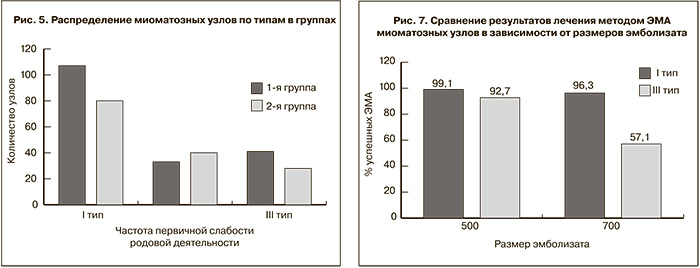
Непосредственная эффективность ЭМА по данным МРТ составила в 1-й группе пациенток 96,7% – 175 полностью обескровленных узлов из 181. Во 2-й группе больных непосредственная эффективность составила 88,6% (132 узла из 149). Эффективность эмболизации по типам перфузии миоматозных узлов (I, II и III типа) в 1-й группе больных составила 99,1% (106 из 107), 93,9% (31 из 33) и 92,7% (38 из 41) соответственно. Во 2-й группе пациенток эффективность составила 96,3% (78 из 81), 95% (38 из 40) и 57,1% (16 из 28) соответственно (рис. 7). Тяжесть болевого синдрома в 1-й группе составила в среднем 4,1±2,1 балла, а во второй – 3,1±3,0. Потребность в наркотических анальгетиках в первые сутки послеоперационного периода в 1-й группе составила 28,1% (9 из 32), во 2-й группе – 12,9% (4 из 31) Количество потраченного эмболизирующего материала в 1-й группе составило в среднем 7,8±1,9 мл, во 2-й – 5,4±2,8 мл.
Обсуждение
Количество успешных ЭМА в нашем исследовании в целом соответствует данным большинства как российских, так и зарубежных авторов [4–7]. Однако на сегодняшний день в общемировой и российской практике не существует работ, разделяющих миоматозные узлы на подтипы в зависимости от кровоснабжения и, соответственно, не проводился анализ эффективности эмболизата в зависимости от его размера. Большинство отечественных и зарубежных авторов, так же как и мы, для проведения ЭМА используют доступ через бедренную артерию и селективную катетеризацию маточных артерий. Подавляющее большинство авторов также используют эмболизаты размерами 500–900 мкм, при этом единого мнения о наиболее предпочтительном размере эмболизата на сегодняшний день не существует [6, 8]. Полученные нами данные свидетельствуют о том, что для различных типов миоматозных узлов следует использовать различный размер эмболизата для достижения максимальной эффективности процедуры. Так, для узлов I и II типа размер эмболизата не имеет принципиального значения, а полученные статистически достоверные различия в эффективности процедуры для узлов I и III типа (рис. 7) позволяют получить более эффективный результат лечения. Безусловно, методика оценки типа кровоснабжения узла методом МРТ с динамическим контрастным усилением субъективна и, возможно, потребует доработки. Однако, как показала наша работа, отсутствие ошибок дифференцировки между миоматозными узлами I и III типа у двух независимых специалистов делает ее практически применимой.
Выводы
- Сферический калиброванный эмболизирующий материал с размером сфер 700–900 мкм показал низкую эффективность в отношении миоматозных узлов III типа («гиперваскулярных) по сравнению с аналогичным материалом с размером сфер 500–700 мкм.
- Применение эмболов более крупного размера сопровождается менее выраженным болевым синдромом в первые сутки после вмешательства и меньшим количеством расходуемого эмболизирующего материала.
- Алгоритм выбора размера эмболизирующего материала следующий: у пациенток с выявленными предоперационно по данным МРТ миоматозными узлами III типа («гиперваскулярными») целесообразно использовать эмболизирующий материал с меньшим размером эмболизирующих частиц. У пациенток без миоматозных узлов III типа целесообразно использовать эмболизирующий материал с частицами большего размера.
- Для более достоверного определения статистической значимости полученных результатов необходимо увеличить количество участвующих в исследовании пациенток.



