Пренатальная диагностика является наиболее эффективным средством профилактики наследственной патологии плода. Основными методами неинвазивной пренатальной диагностики являются ультразвуковое исследование (УЗИ) и определение уровней сывороточных маркеров. В I триместре беременности (9–13 нед) таковыми являются свободная β-субъединица хорионического гонадотропина человека (свободная β-ХГЧ) и ассоциированный с беременностью белок плазмы крови (РАРР-А) [2]; во II триместре (16–20 нед) – молекула ХГЧ, альфа-фетопротеин (АФП), свободный эстриол (Е3) и 17-гидроксипрогестерон (17-ОП) [3].
В настоящее время разработана система неинвазивной пренатальной диагностики трисомии 18-й
и 21-й хромосом (синдром Эдвардса и синдром Дауна соответственно) у эмбриона в I триместре
беременности, основанная на предварительной компьютерной обработке данных о концентрации свободной β-ХГЧ, РАРР-А, величины носовой кости и воротниковой области эмбриона, его крестцово-теменного размера [4, 11]. В результате обработки этой информации рассчитывют риск наличия у эмбриона синдрома Дауна и синдрома Эдвардса. При значении риска выше 1:250 проводят инвазивную пренатальную диагностику.
Однако, согласно данным литературы, осложненное течение беременности, особенно наступившей в результате использования вспомогательных репродуктивных технологий, а также лекарственная терапия могут оказывать определенное влияние на концентрацию сывороточных маркеров [1, 7, 8]. В результате этого возникает проблема интерпретации риска наличия у эмбриона синдрома Дауна и синдрома Эдвардса.
В связи с вышеизложенным, целью настоящего исследования явилась оценка информативности
программы пренатальной диагностики синдромов Дауна и Эдвардса в I триместре у пациенток с осложненным течением беременности на фоне гормональной терапии.
Материал и методы исследования
Обследованы 505 беременных женщин в возрасте от 21 до 35 лет в сроке беременности 9–12 нед.
Все женщины получали гестагенные (прогестерон, прогенова, утрожестан, норколут, дюфастон)
и/или глюкокортикоидные прапараты (дексаметазон, метипред, преднизолон). Лекарственные
средства назначали как изолированно, так и в различных сочетаниях. Контрольную группу
составили 78 женщин с нормально протекающей беременностью. Этим женщинам гормональная терапия не проводилась. Исход беременности был установлен у всех обследованных женщин.
Всем женщинам проводили УЗИ и одновременно анализ образцов крови. Исследовали только
те показатели, которые были необходимы для проведения компьютерного анализа. При УЗИ получали данные о крестцово-теменном размере эмбриона и размере его воротниковой области. В сыворотке образцов крови определяли концентрацию свободной β-ХГЧ и РАРР-А на автоматическом иммунофлуоресцентном анализаторе Delfia Xpress фирмы Perkin Elmer, Финдляндия. Полученные результаты обрабатывали с помощью компьютерной программы Life Cycle этой же фирмы. В программу вносили некоторые анамнестические данные и вышеуказанные лабораторные показатели. Нормативными считали концентрации маркеров в диапазоне 0,5– 2,0 МоМ, размер воротникового пространства до 2 мм и степень риска – выше 1:250. У 40 женщин (37 основной группы и 3 контрольной) с высоким риском рождения ребенка с хромосомной патологией установлен кариотип эмбриона с использованием стандартной техники [10].
Результаты исследования и обсуждение
В контрольной группе, которая была представлена 78 женщинами с нормально протекающей беременностью, закончившейся рождением нормальных детей, отклонения концентраций сывороточных маркеров от нормативного диапазона были выявлены у 36 (46,1%) женщин.
Однако риск рождения ребенка с хромосомной патологией, рассчитанный с помощью компьютерной программы, был установлен только у 3 (3,8%) женщин. У всех этих женщин при УЗИ было отмечено увеличение размеров воротниковой области эмбриона свыше 2 мм. При исследовании кариотипа эмбрионов патологии не выявлено.
Из 505 обследованных женщин у 156 (31%) беременность протекала с угрозой прерывания в I триместре. Отмечались кровянистые выделения из половых путей и в ряде наблюдений, по данным эхографии, наличие гематом.
В таблице 1 представлены данные об особенностях отклонения от норматива таких показателей,
как размер воротниковой области эмбриона, концентрации свободной β-ХГЧ и РАРР-А в периферической крови беременных. Именно эти показатели являются основой для компьютерной оценки риска наличия у эмбриона синдрома Дауна. Согласно результатам компьютерной обработ-
ки данных, риск наличия у эмбриона синдрома Дауна, превышающий пороговые значения 1:250,
был обнаружен у 37 женщин, что составило 7,3%. Угроза прерывания беременности у них отмеча-
лась в 46,0% случаев.
Таблица 1. Отклонения анализируемых показателей в группе обследованных женщин (n=505).
Концентрация свободной β-субъединицы ХГЧ превышала 2 МоМ у 82 (16,2%) пациенток. Угроза
прерывания беременности при этом отмечалась в 35,0% случаев. Концентрация РАРР-А была
ниже 0,5 МоМ у 43 женщин. У 14 (33,0%) из них отмечалась угроза прерывания. В 33 (6,5%) случаях размеры воротниковой области эмбриона превышали 2 мм. В формировании группы риска удельный вес этого показателя составил 89,2%. У 14 (42,0%) пациенток этой группы также отмечалась угроза прерывания беременности. Одновременное увеличение размера воротниковой области и повышение концентрации свободной β-ХГЧ обнаружено в 5 случаях, у 3 (60,0%) из этих женщин была угроза прерывания беременности. Снижение концентрации РАРР-А ниже 0,5 МоМ в сочетании с размерами воротниковой области более 2 мм зафиксировано в 7 наблюдениях. В этой группе угроза прерывания беременности была только у одной женщины (табл. 1). Таким образом, 41,0% обследованных женщин
имели те или иные отклонения анализируемых показателей от норматива. Частота угрозы прерывания у них варьировалась от 14 до 60,0%.
Согласно данным компьютерного анализа, 37 пациенток, имеющих риск наличия у эмбриона синдрома Дауна, были выделены в группу риска. Им была рекомендована и проведена пренатальная диагностика кариотипа эмбриона – трансцервикальная биопсия хориона или трансабдоминальный хориоцентез с последующим цитогенетическим анализом полученного материала. Кроме того, были более детально проанализированы данные об уровнях сывороточных маркеров и размерах воротниковой области (табл. 2).
Таблица 2. Особенности анализируемых показателей у женщин группы риска.
Из 37 женщин у 32 (86,0%) размеры воротниковой области эмбриона превышали 2 мм, концентрация свободной β-субъединицы ХГЧ превышала 2 МоМ в 4 наблюдениях, а концентрация РАРР-А была ниже 0,5 МоМ у одной женщины. При этом в 7 наблюдениях увеличение размеров воротниковой области сочеталось с низким уровнем РАРР-А, а в 5 случаях – с увеличением концентрации свободной β-ХГЧ. Увеличение размеров воротниковой области в сочетании с нормативными уровнями сывороточных маркеров зарегистрировано в 20 (54,1%) случаях (табл. 2). Таким образом, при оценке риска синдрома Дауна у эмбриона, ведущим показателем является увеличения размера его воротниковой области.
Результаты цитогенетического исследования позволили выявить хромосомную патологию, соответствующую синдрому Дауна, у 1 эмбриона пациентки, относящейся к группе риска. У этого
эмбриона величина воротниковой области достигала 4,5 мм, а концентрация в крови беременной
свободной β-ХГЧ составила 9,5 МоМ. Риск составил 1:5. Беременность протекала без угрозы прерывания на фоне приема утрожестана и дексаметазона. В связи с наличием синдрома Дауна у эмбриона беременность была прервана. Остальные 504 женщины родили детей без хромосомных аномалий.
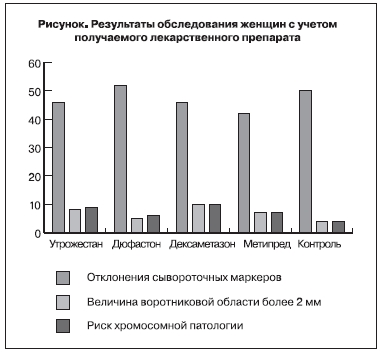
Помимо изучения основной группы в целом, проанализированы показатели с учетом приема гестагенов или глюкокортикоидов. На рисунке в графическом изображении представлены полученные результаты. Частота отклонения концентраций сывороточных маркеров от нормативного диапазона у женщин основной группы, принимавших метипред, составила 41,4%, принимавших дюфастон – 51,8%. В контрольной группе этот показатель составил 46,1%.
Таким образом, согласно результатам статистической обработки, достоверных различий не выявлено. Значимость различий категориальных данных оценивали с помощью χ2-теста с принятием уровня достоверности р<0,05 (статистическая программа Epi Info version 6). В то же время выявлено статистически значимое отличие частоты высокого риска хромосомной патологии в основной группе: от 5,9% (прием дюфастона) до 10,1% (прием дексаметазона) по сравнению с контрольной – 3,8%. Обращает на себя внимание тот факт, что частота высокого риска практически полностью совпадает
с частотой увеличения воротниковой области эмбриона. Поскольку число наблюдений с этим эхографическим признаком в контрольной группе было минимальным, то и частота высокого риска в этой группе была низкой.
По данным литературы, угроза прерывания беременности, гормональная терапия, стимуляция овуляции в программе экстракорпорального оплодотворения (ЭКО) оказывают влияние на концентрацию свободной β-ХГЧ и РАРР-А [7, 9]. Это может затруднять диагностику хромосомной патологии, в частности синдромов Дауна и Эдвардса, проводимых в этот период. Результаты настоящего исследования свидетельствуют о том, что различные отклонения от нормального содержания в крови β-ХГЧ и/или РАРР-А были у 41,4–51,8% женщин основной группы (принимавших гестагенные или глюкокортикоидные препараты с лечебной целью при угрозе прерывания беременности) и у 46,1% женщин контрольной (без гормональной терапии с нормальным течением беременности). Статистически значимых различий в этих показателях в обеих группах, а также в основной, с учетом характера принимаемого лекарственного препарата, не выявлено.
Несмотря на то что у большинства женщин были установлены отклонения концентраций сывороточных маркеров от норматива, высокий риск хромосомной патологии отмечен всего у 7,3% по сравнению с 3,8% в контроле. Высокий риск был только у тех женщин, у которых при эхографии диагностировано увеличение размеров воротниковой области эмбриона. Именно этот маркер являлся ведущим при оценке риска хромосомной патологии.
Хромосомная патология, соответствующая синдрому Дауна, была диагностирована в основной группе в одном наблюдении, т.е. в 0,2% (1 из 505). Эта частота полностью соответствует популяционному нормативу для женщин моложе 35 лет [2]. Частота ложноположительных результатов по синдрому Дауна составила 7,1% (36 эмбрионов женщин группы риска из 505 обследованных), что согласуется с данными литературы [4, 5, 6, 11].
Таким образом, применение гормональной терапии при осложненном течении беременности не влияет на показания к проведению инвазивной пренатальной диагностики, которая на сегодняшний день является основным методом выявления хромосомной патологии плода.
В литературе имеются сообщения о влиянии гормональной терапии на морфологию плода [7, 9]. В настоящей работе увеличение размеров воротниковой области плода у женщин группы риска в определенной степени подтверждают эту точку зрения, однако требуются дальнейшие исследования в этом направлении.



