Несмотря на длительную историю и колоссальное практическое значение изучения обмена фолатов, до сих пор в этом вопросе остается много неясностей. В то же время вовлеченность фолатного обмена в огромное количество ключевых биохимических процессов в организме обусловливает непреходящий интерес к этой теме. Фолаты участвуют в метаболизме аминокислот, влияя на синтез белков, обеспечивают синтез пуриновых и пиримидиновых оснований, что является ключевым для образования ДНК и РНК [1], предоставляют метильную группу для ряда метилтрансфераз, присутствующих во всех клетках. Метилтрансферазы метилируют широкий спектр разнообразных субстратов: гормоны, липиды и белки. Таким образом, нарушение фолатного статуса является системным и приводит к широкому спектру заболеваний.
Биохимия фолатов
Фолаты – производные фолиевой кислоты – являются донорами или акцепторами одноуглеродной группы, поэтому совокупность этих реакций в клетке обычно называют метаболизмом одноуглеродных фрагментов (one carbon metabolism) [2]. Основной задачей фолатного обмена является генерация и передача одноуглеродных остатков, которые необходимы для метилирования и репарации ДНК, синтеза нуклеотидных оснований, белков, фосфолипидов, нейротрансмиттеров [3].
Важно отметить, что сама фолиевая кислота отличается от природных фолатов, поскольку находится в окисленном состоянии и содержит только один глутаматный остаток [2]. Поэтому фолиевая кислота должна пройти серию окислительных реакций и реакций метилирования, катализируемых различными фолат-зависимыми ферментами, для включения в циркулирующий пул биодоступных фолатов. Несмотря на это, биологическая доступность синтетической фолиевой кислоты выше, чем фолатов, встречающихся в натуральных продуктах питания. В кровяном русле более 80% фолатов содержатся в эритроцитах, остальная часть – в сыворотке крови. Депонирование и метаболизм фолиевой кислоты осуществляется в печени.
Проблема дефицита фолатов
Млекопитающие неспособны синтезировать фолаты и находятся в жесткой зависимости от поступления соответствующих соединений извне. Часть фолатов поступает в организм с пищей (зеленые овощи, бобовые, мука грубого помола), некоторое количество витамина синтезируется микрофлорой кишечника. Соответственно, недостаточное поступление с пищей, повышенная потребность или нарушение всасывания фолатов в кишечнике могут привести к дефициту этих соединений. По оценкам экспертов, распространенность фолатного дефицита достигает 96% в отдельных группах [4]. При тепловой обработке разрушается до 90% фолиевой кислоты, содержащейся в сырой пище, а бесконтрольное использование антибактериальных препаратов приводит к нарушению состава микрофлоры кишечника и снижению ее способности синтезировать фолиевую кислоту.
Нарушение всасывания фолатов в кишечнике наблюдается при синдроме мальабсорбции, энтерите, при приеме алкоголя, антацидов, сульфаниламидов, противоэпилептических средств. Несмотря на то что основным природным источником фолатов являются продукты растительного происхождения, вегетарианская диета без приема дополнительных витаминных препаратов часто сопровождается дефицитом витамина B12, что также затрудняет усвоение фолатов [5]. Прием различных фармакологических препаратов (аспирина, нитрофуранов, оральных контрацептивов, кортикостероидных гормонов) снижает концентрацию фолатов в крови.
Фолатный дефицит является фактром риска развития острого лимфолейкоза у взрослых [6]. Существуют эпидемиологические доказательства, что достаточное содержание фолатов в диете уменьшает риск развития определенных опухолей [7]. Показана связь мигрени с фолатным дефицитом, при этом прием фолиевой кислоты в сочетании с витаминами В6 и В12 снижает частоту приступов мигрени у детей более чем на 50% [8].
Во время беременности потребность в фолатах резко увеличивается. В случае дефицита фолатов во время беременности повышается риск различных пороков развития плода: пороки нервной трубки (spina Bifida, анэнцефалия и др.), расщепленное нёбо («волчья пасть»), пороки сердечно-сосудистой системы [9, 10].
Также характерно тяжелое течение беременности (преэклампсия, повторяющийся ранний выкидыш, задержка развития плода) [11]. Показано, что следствием фолатного дефицита может быть нерасхождение хромосом в мейозе [12], что, в частности, приводит к синдрому Дауна [13]. При этом, поскольку закладка пула фоликулов в яичнике происходит на стадии эмбриогенеза в утробе матери, недостаток фолатов в материнском организме будет приводить к ошибкам мейоза в примордиальных фоликулах плода, что, в свою очередь, проявится повышением риска синдрома Дауна у внуков [14].
Таким образом, профилактика фолатного дефицита крайне важна не только для сохранения здоровья населения, но и в первую очередь для предотвращения рождения детей с врожденными пороками развития и поддержания репродуктивного здоровья следующего поколения.
Восполнение дефицита фолатов
Исходя из вышесказанного, на сегодня практически нет разногласий в том, что оптимальным методом профилактики фолатного дефицита является дополнительный прием фолатов. Оптимальной дозой для небеременных является 400 мкг фолиевой кислоты в сутки, 800 мкг в преконцепционном периоде и при беременности [15]. При этом показан дозозависимый эффект по предотвращению пороков развития [15, 16]. Исходя из этого, для пациенток с отягощенным акушерским анамнезом рекомендуется более высокая доза – 4000 мкг/сутки, особенно если во время предыдущих беременностей наблюдались пороки развития плода [17].
Сочетание фолатов с приемом других витаминов в большей степени обеспечивало защиту, чем прием только фолатов или витаминов [16]. Так, в крупном Венгерском рандомизированном плацебо-контролируемом исследовании под руководством проф. А. Цейзеля было доказано, что применение витаминно-минерального комплекса (elevit pronatal) в периконцепционном периоде снижает риск дефектов нервной трубки плода на 92% и значительно снижает риск развития других врожденных пороков развития: сердечно-сосудистой системы, мочевыводящих путей, конечностей, врожденного стеноза привратника [16, 18]. Кроме того, были получены и дополнительные благоприятные результаты: нормализация менструальной функции у небеременных женщин, достоверное увеличение числа зачатий, а также уменьшение жалоб на тошноту и рвоту во время беременности [18].
Тем не менее, исследования показывают, что передозировка фолатов может также привести к негативным последствиям [19]. Так, чрезмерно высокие уровни фолатов в плазме беременных могут быть ассоциированы с риском развития ожирения, инсулинрезистентности и некоторых опухолей у детей [20, 21], у пожилых пациентов возрастает риск когнитивных нарушений [22].
В ряде стран, таких как США, Канада, Чили действуют государственные программы по обогащению фолатами (фортификации) продуктов питания [23].
Этот метод продемонстрировал свою эффективность для снижения частоты дефектов нервной трубки и других нарушений [24, 25]. Считается, что медицинские и экономические выгоды от фортификации намного перевешивают негативный эффект [26]. Тем не менее, проблемой, связанной с подобной тактикой, является слабая возможность индивидуального контроля получаемой дозы фолатов, которая, кроме всего прочего, зависит и от пищевых предпочтений конкретного человека [27].
Также для восполнения дефицита фолатов доступен широкий спектр лекарственных препаратов, витаминно-минеральных комплексов и биологически активных добавок. Сочетание мультивитаминов с фолатами, получаемыми из других источников, может привести к превышению дозы самих фолатов. Именно в этом заключается одно из основных опасений, связанное с фортификацией продуктов.
Огромное разнообразие доступных препаратов и отсутствие знаний об особенностях их применения зачастую ставит практикующего врача в тупик и может приводить к неадекватным рекомендациям. При этом, несмотря на отсутствие государственной программы фортификации продуктов в России, риск неадекватного назначения фолатов в нашей стране достаточно высок.
Прежде всего, необходимо определить цели применения фолат-содержащих препаратов в клинической практике:
- Лечение определенных клинических состояний (Фолиеводефицитная анемия – код по МКБ-10 D52, Недостаточность витамина Bс – код E53.8.0*). Доля таких больных в популяции относительно невелика, и их курируют соответствующие специалисты.
- Профилактика витаминдефицитных состояний. Как уже было сказано, в той или иной степени это актуально для любого современного человека, однако используемые дозы фолатов в этой ситуации, как правило, достаточно умеренные.
- Профилактика рождения детей с врожденными пороками развития. Целевая аудитория – все женщины детородного возраста, при этом именно эта группа наиболее нуждается в профилактике фолатного дефицита вследствие повышенной потребности в фолатах при беременности. Таким образом, стандартные дозы, используемые вне беременности, оказываются недостаточными для профилактики пороков развития плода, а увеличение дозы повышает риск потенциальных побочных эффектов, в том числе и для плода. Соответственно, именно в этой группе применение фолат-содержащих препаратов требует особого внимания и индивидуального подхода.
Если не рассматривать фолат-содержащие комбинированные оральные контрацептивы, которые, как не парадоксально, предназначены в первую очередь для предотвращения пороков развития плода путем преконцепционного насыщения организма матери фолатами, то все остальные препараты относятся к группе витаминов и биологически активных добавок. Это, с одной стороны, снижает контроль над их назначением и дозировкой со стороны врачей, с другой – создает у пациентов ошибочное представление об их «необязательности». При этом многие препараты являются поливитаминными комплексами, содержащими несколько компонентов в количествах, перекрывающих суточную потребность организма. Это, безусловно, удобно для пациента, но делает опасным увеличение дозы при комбинировании разных препаратов между собой, так как легко превысить допустимые дозы по отдельным составляющим.
Еще один фактор, который необходимо учитывать при коррекции фолатного статуса – это биохимическая форма фолатов. Традиционно в большинстве препаратов и при фортификации продуктов используют фолиевую кислоту. В качестве альтернативы предлагается использование кальциевой соли L-5-метилтетрагидрофолиевой кислоты – L-метилфолат (5-MeTHF). Управление по контролю за продуктами и лекарствами США напоминает, что метилфолат и фолиевая кислота не являются эквивалентными веществами, и обязывает производителей указывать, какой фолат содержится в препарате. Учитывая, что основные данные о клинической эффективности и безопасности фолатов были получены при исследовании фолиевой кислоты, высказываются сомнения в обоснованности использования метилфолата вместо фолиевой кислоты [28].
Имеются отдельные публикации, косвенно свидетельствующие о более выраженном влиянии приема 5-MeTHF на фолатный статус по сравнению с фолиевой кислотой [29], однако имеются и противоположные данные [30]. Прямых доказательств более высокой эффективности 5-MeTHF по предотвращению пороков развития плода или других заболеваний не получено [16]. Основным аргументом в пользу использования 5-MeTHF традиционно считается то, что включение его в процессы биосинтеза не требует участия фермента 5, 10-метилентетрагидрофолат редуктазы (MTHFR) [31]. Кажущимся следствием этого факта является более высокая эффективность 5-MeTHF при достаточно широко распространенных в популяции дефектах гена MTHFR. Соответственно, для понимания особенностей биологических эффектов 5-MeTHF и фолиевой кислоты необходимо изучать фармакогенетику этих препаратов. Чтобы разобраться в особенностях применения того или иного соединения, необходимо понимание особенностей функционирования ферментов, участвующих в превращении фолатов в организме и полиморфизма генов, их кодирующих. При этом нельзя рассматривать превращения одного-единственного вещества без учета сопряжения соответствующих биохимических циклов.
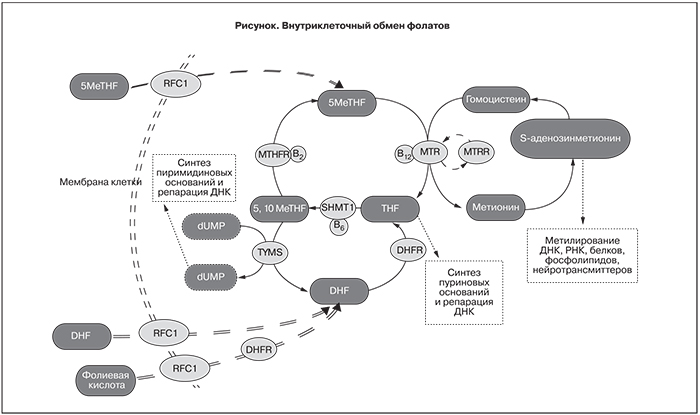
Помимо MTHFR значимыми для функционирования цикла фолата и цикла S-аденозинметионина (SAM) являются гены MTR и MTRR (рисунок). Нарушения в этой подсистеме приводят к накоплению гомоцистеина, как при нарушении функции MTHFR. И в этом случае преимущества введения 5-MeTHF по сравнению с тетрагидрофолатом не очевидны, тем более что введя избыток 5-MeTHF, мы получаем избыток тетрагидрофолата, превращение которого в 5,10-MeTHF с участием серингидроксилметил трансферазы (SHMT1) является сопрягающим звеном между циклом фолата и циклом тимидилата. Соответственно, можно ожидать нарушения равновесия между циклом фолата и циклом тимидилата при нарушении функции MTHFR. Следовательно, нельзя однозначно утверждать, что введение избытка 5-MeTHF полностью нормализует метаболизм фолатов.
Но прежде чем фолиевая кислота или 5-MeTHF попадут в клетку, они должны быть поглощены из кишечника, где также наблюдаются определенные различия между данными соединениями.
Всасывание фолатов из кишечника
Все фолаты, получаемые с пищей, например, фолиевая кислота, тетрагидрофолат, 10-формилтетрагидрофолат и 5-метилтетрагидрофолат, абсорбируются в кишечнике посредством транспортера фолатов (PCFT), кодируемого геном SLC46A1. При этом скорость абсорбции разных фолатов практически одинакова [32]. Эпителиальные клетки кишечника (энтероциты) превращают все поглощенные фолаты в 5-MeTHF – основную плазменную форму фолатов. [33].
При этом способность перерабатывать немодифицированную фолиевую кислоту в энтероцитах ограничена и при приеме свыше 200 мкг/сутки в портальной вене определяется неизмененная фолиевая кислота [34], которая при попадании в печень также превращается в дигидрофолат при участи дигидрофолатредуктазы (DHFR) гепатоцитов. Общая скорость биотрансформации фолиевой кислоты лимитируется активностью дигидрофолатредуктазы энтероцитов [33], так как активность DHFR в печени низкая и подвержена значительным колебаниям под влиянием различных факторов [35]. В то же время показано, что интактная фолиевая кислота сильнее активирует DHFR гепатоцитов, чем 5-MeTHF [36]. Таким образом, 5-MeTHF является «универсальной фолатной валютой в организме», и ферментные системы настроены на максимально быстрый перевод других фолатов в 5-MeTHF. Как следствие, после введения 5-MeTHF или фолиевой кислоты уже через 10 часов нет различий концентрации биодоступных фолатов в плазме [37].
Фолатный цикл
Обмен фолатов – метаболические сети, функционирующие в цитоплазме, митохондриях и ядрах клеток млекопитающих и человека. Обмен фолатов включает в себя три взаимно сопряженных друг с другом цикла (рисунок):
- цикл превращения уридинмонофосфата в тимидилат (Цикл тимидилата);
- цикл 10-формилпроизводных тетрагидрофолата (Цикл фолата)
- цикл регенерации метионина, сопряженный с циклом S-аденозилметионина (Цикл SAM).
Cобственно фолиевая кислота не включена в эти реакции, так как во всех циклах участвуют только ее восстановленные производные, поэтому обязательной стадией, предшествующей всем циклам, является восстановление фолиевой кислоты до дигидрофолата (DHF) под действием дигидрофолатредуктазы.
Общей реакцией для всех трех циклов является образование 5,10-метилентетрагидрофолата из тетрагидрофолата при участии серингидроксиметилтрансферазы. Это звено является общим для двух сопряженных циклов: цикла фолата и цикла тимидилата, которые через свои промежуточные продукты снова метаболизируют 5,10-метилентетрагидрофолат до тетрагидрофолата.
Синтез de novo тимидилата из уридилата происходит как в митохондриях, так и в ядре [3, 38]. Тимидилат является специфическим компонентом ДНК, и цикл тимидилата играет важную роль в процессах деления клеток и в значительной мере определяет пролиферативную активность тканей.
Реметилирование гомоцистеина с последующей конверсией метионина до S-аденозинметионина (SAM) происходит исключительно в цитоплазме [39].
Именно SAM является основным донором метильной группы, используемой в большом количестве биохимических реакций. Цикл SAM сопряжен с циклом фолата через метионинсинтетазу. Вследствие этого нарушение функции метионинсинтетазы или метионинсинтетазаредуктазы, восстанавливающей активность метионинсинтетазы, приводит к остановке цикла SAM и накоплению промежуточного продукта – гомоцистеина. К такому же эффекту приводит и нарушение цикла фолата. Наиболее хорошо изученной причиной нарушения цикла фолата является снижение активности 5,10-метилентетрагидрофолатредуктазы. При этом хотя MTHFR – ключевой фермент цикла фолата, нарушение ее активности приводит к накоплению гомоцистеина, образующегося в цикле SAM.
Дефекты генов ферментов фолатного цикла
Известно, что не только влияние внешних факторов, но и генетические причины могут приводить к нарушению обмена фолатов в организме [40, 41].
В популяции встречаются аллельные варианты генов ферментов фолатного цикла, характеризующиеся измененной ферментной активностью или субстратной специфичностью. Это явление называется генным полиморфизмом. Причиной этого являются мутации, произошедшие в данном гене множество поколений назад и предаваемые из поколения в поколение. Носительство такого измененного варианта гена может быть выявлено современными молекулярно-генетическими методами. Знание генома пациента позволяет получить информацию об особенностях функционирования его ферментных систем и предсказать реакцию на ряд фармакологических препаратов. Этот метод получил название фармакогенетического.
5,10-метилентетрагидрофолат-редуктаза (MTHFR)
MTHFR является ключевым ферментом фолатного цикла, восстанавливающим 5,10-метилентетрагидрофолат до 5-метилтетрагидрофолата и являющимся, таким образом, катализатором единственной внутри клетки реакции образования 5-метилтетрагидрофолата. Именно дефекты гена MTHFR первыми привлекли внимание исследователей как фактор, нарушающий фолатный цикл. Замена в 677-й позиции гена (677 С>T, rs1801133), приводящая к замене аланина на валин (Ala222Val) в области связывания фермента с кофактором, нарушает структуру этой области и вызывает снижение активности MTHFR на 65% при гомозиготном носительстве. Вторая хорошо известная замена 1298 A>C (Glu429Ala, rs1801131) локализуется в регуляторном домене фермента, что сопровождается небольшим снижением активности (на 40% у гомозигот). Также достаточно давно известно, что дополнительное включение в рацион фолиевой кислоты или продуктов, богатых фолатами (фрукты, овощи), позволяет преодолеть функциональную недостаточность фермента [42]. При этом носители дефектных аллелей хуже усваивают фолаты из пищи [43], у них нарушается процесс образования активной формы фолатов (5-MeTHF), и стандартные рекомендации по приему фолиевой кислоты не могут обеспечить оптимальный фолатный статус, особенно при беременности. Именно эти данные стали основанием для поиска альтернативных источников фолатов, усвоение которых не связано с MTHFR. В то же время в недавних исследованиях высказывается мнение, что наличие дефектов гена MTHFR не требует специального лечения, включая назначение фолиевой кислоты, витаминов В6 или В12 [44].
Метионинсинтетаза (MTR) и метионинсинтетазы редуктаза (MTRR)
Ферментом, непосредственно осуществляющим метилирование гомоцистеина (обратное превращение гомоцистеина в метионин), является витамин В12-зависимая метионинсинтетаза (MTR). Полиморфизм 2756 A>G (Asp919Gly, rs1805087) ассоциирован со снижением гомоцистеина в плазме в ответ на повышение фолатов в пище [43]. Для поддержания активности метионинсинтетазы необходимо восстановительное метилирование с помощью метионинсинтетазы редуктазы (MTRR). Полиморфизм MTRR: 66 A>G (Ile22Met, rs1801394) изменяет функциональную активность фермента и ассоциирован с гипергомоцистеинемией [45].
Траспортер фолатов (SLC19A1, RFC1)
Траснпортер фолатов обеспечивает активный перенос 5-MeTHF и фолиевой кислоты из плазмы в цитозоль. Полиморфизм 80 A>G (His27Arg, rs1051266) приводит к изменению сродства фолатов и переносчика [46]. Показана связь данного полиморфизма с пороками сердца у плода [47]
Метилентетрагидрофолат дегидрогеназа (MTHFD1)
Замена 1958 G>A (Arg653Gln, rs2236225) не влияет на уровень гомоцистеина или концентрацию фолатов в плазме или эритроцитах [48], однако повышает риск рождения ребенка с пороками нервной трубки [49].
Серингидроксиметилтрансфераза (SHMT1)
SHMT1 участвует в образовании 5,10-MeTHF, обеспечивая метильной группой два конкурирующих фермента: MTHFR и тимидилатсинтетазу. Полиморфизм 1420 C>T (rs1979277), приводящий к замене лейцина на фенилаланин (Leu474(435)Phe), ассоциирован с изменением содержания фолатов в плазме и эритроцитах [50]. В более позднем исследовании [51] показана связь данного полиморфизма с развитием синдрома Дауна, хотя различий в фолатном статусе выявлено не было.
Дигидрофолатредуктаза (DHFR)
Показано влияние делеции 19 нуклеотидных оснований в гене DHFR (19bpdel, rs70991108) на эффективность усвоения фолиевой кислоты. У пациентов, гомозиготных по указанной делеции, при приеме менее 250 мг/сутки фолиевой кислоты наблюдалось статистически значимое снижение содержание фолатов в эритроцитах, тогда как прием более 500 мг/сутки сопровождался накоплением в плазме интактной фолиевой кислоты [52]. Именно с накоплением неметаболизировнной фолиевой кислоты Orjuela и соавт. связывают повышение риска ретинобластомы у детей при наличии данной делеции у матери [21]. При этом влияния полиморфизма гена MTHFR у матери на риск возникновения ретинобластомы у ребенка в этом же исследовании установлено не было.
Исходя из роли дигидрофолатредуктазы в «подготовке» фолиевой кислоты для включения в метаболические реакции становится понятным отсутствие взаимодействия метилфолата и ингибиторов дигидрофолат редуктазы [53]. Логично ожидать и различий во влиянии данной делеции на фармакогенетику метилфолата и фолиевой кислоты, однако подобных исследований в доступной литературе найти не удалось.
Заключение
Таким образом, на сегодня нет сомнений в необходимости дополнительного приема фолатов для профилактики фолатного дефицита, особенно при подготовке и на протяжении беременности. В то же время в силу различных причин индивидуальная потребность в фолатах может колебаться в довольно широких пределах. При этом, поскольку нельзя полностью исключить риск негативного влияния передозировки фолатов, требуется персонализированный подход к выбору дозы.
Основной причиной индивидуальных различий в потребности в фолатах является полиморфизм генов ферментов фолатного цикла, что делает фармакогенетический подход оправданным при назначении фолатов. Вместе с тем необходимы дальнейшие исследования для уточнения списка ключевых генов и учета ген-генных взаимодействий.
Использование альтернативных источников фолатов по сравнению с традиционно используемой фолиевой кислотой не продемонстрировало однозначных преимуществ, но может быть потенциально перспективным направлением дальнейшего научного поиска. В то же время существуют клинически подтвержденные данные о высоком защитном потенциале в отношении профилактики врожденных пороков развития мультивитаминных препаратов, содержащих 800 мкг фолиевой кислоты.
Требуются дальнейшие исследования фармакогенетики метилфолата для разработки индивидуальных рекомендаций по его применению и дозировке с учетом не только полиморфизма гена метилентетрагидрофолат редуктазы, но и других ферментов фолатного цикла.



