Во многих странах мира частота бесплодия превышает критический уровень и является демографической проблемой, что, в свою очередь, стимулирует развитие методов вспомогательных репродуктивных технологий (ВРТ) для ее преодоления. В развитых странах не менее 1% родов являются результатом программ ЭКО [1]. Однако, несмотря на совершенствование протоколов ЭКО, технических и лабораторных методов, применяемых при проведении этих программ, частота наступления беременности остается в пределах 21,0–45,8% (данные за 2009 г.) [2].
Несомненно, что качество эмбриона является основой успешной имплантации, однако наличие зрелого эндометрия также необходимо в период «окна имплантации» для совершения молекулярно-перекрестных взаимодействий между эмбрионом и эндометрием. Факторы и механизмы, приводящие к нарушению имплантации в циклах ЭКО, на сегодняшний день не до конца изучены, но именно они определяют успех ЭКО [3]. Иммунологическая теория имплантации впервые была объявлена T. egmann [4], и с тех пор роль цитокинов, факторов роста, молекул адгезии в формировании иммунной толерантности во время имплантации и на протяжении беременности активно обсуждаются в области репродуктивной иммунологии. Успешная имплантация и нормально прогрессирующая беременность во многом зависят от участия ряда цитокинов и факторов роста в процессе взаимодействия эмбриона и эндометрия. Иммуногистохимические методы позволили выявить экспрессию ряда биологически активных молекул в течение менструального цикла, и в частности, в период окна имплантации, и многие из них были предложены в качестве маркеров имплантации [5–11].
Вместе с тем поиск новых неинвазивных методов оценки имплантационной способности эндометрия является весьма актуальной задачей. Секрет эндометрия представляет среду, с которой взаимодействует эмбрион при его попадании в полость матки. Цервикальная слизь (ЦС) состоит из секрета желез эндометрия и эндоцервикса. На сегодняшний день существует небольшое количество работ, в которых авторы проводили оценку содержания цитокинов и факторов роста в ЦС во время предполагаемого окна имплантации в естественных циклах [12, 13]. В циклах ЭКО эндометрий подвергается надфизиологическим гормональным воздействиям, что, несомненно, влияет на его рецептивность [14]. В связи с чем оценка маркеров рецептивности эндометрия и определение оптимального времени получения исследуемого материала в циклах ЭКО является одной из нерешенных задач, решение которой приведет к повышению результативности циклов ЭКО. Одними из наиболее значимых факторов, участвующих в процессе имплантации, являются факторы роста, такие как гранулоцитарно-макрофагальный колониестимулирующий фактор роста (GM-CSF), трансформирующий фактор роста-β1 (TGF-β1), сосудистый эндотелиальный фактор роста (VEGF), которые относятся к семейству секретируемых сигнальных белков, способных индуцировать пролиферацию и дифференцировку клеток.
Цель исследования: установить оптимальное время оценки факторов роста на протяжении цикла ЭКО и определить их связь с частотой наступления беременности в циклах ЭКО.
Материал и методы исследования
Обследованы 97 женщин в возрасте от 21 до 35 лет, которым было выполнено ЭКО и перенос эмбрионов (ПЭ) в полость матки на базе НИИ АГ им. Д.О. Отта СЗО РАМН с октября 2012 г. по июль 2013 г. Уровень ФСГ в крови, определенный на 3–5-й день менструального цикла у всех обследованных женщин не превышал 11 МЕ/л, при ультразвуковом исследовании определялось от 7 до 12 антральных фолликулов в максимальном эхографическом срезе яичников. Всем женщинам проводился стандартный протокол ЭКО или ЭКО с интрацитоплазматической инъекцией сперматозоидов (ИКСИ) с применением антагонистов гонадотропин-рилизинг гормона. Для поддержки лютеиновой фазы цикла применялся микронизированный прогестерон (крайнон, Serono; утрожестан, BESINSHEALTHCARE). Проводили перенос только морфологически качественных эмбрионов на четвертые или пятые сутки культивирования, оставшиеся эмбрионы были криоконсервированы методом витрификации. Беременность диагностировалась путем определения хорионического гонадотропина человека в крови на 14-й день после переноса эмбрионов в полость матки и подтверждалась ультразвуковым исследованием на 21-й день. В зависимости от исхода лечения ретроспективно были сформированы 2 группы. В I группу вошли 50 (51,55%) женщин с эхографически подтвержденной беременностью, II группа состояла из 47 (48,45%) женщин, у которых беременность не наступила.
Забор ЦС с использованием флоковых тампонов фирмы «Copan» (Италия) проводился дважды: в день трансвагинальной пункции (ТВП) фолликулов и в день ПЭ. Полученные образцы с примесью крови были исключены из исследования. Концентрацию VEGF, GM-CSF и TGF-β1 в цервикальной слизи проводили методом мультиплексного анализа с использованием стандартизованных коммерческих наборов «Flexset» (BD Bioscience). Полученные результаты обрабатывали с помощью компьютерной программы «CBA Array» (BD Bioscience). Для нормирования содержания исследуемых факторов в полученном материале, количество белка в анализируемой жидкости определяли фотометрически («NanoDrop 1000 Spectrophotometer»). Учитывая разные объемы полученной ЦС, содержание фактора роста в образце вычислялось с применением следующей формулы:

Статистическая обработка данных выполнена с использованием стандартного пакета Microsoft Excel и пакета прикладных программ Statistica for Windows версия 6.0, StatSoft Inc (США). Для оценки межгрупповых различий значений признаков применяли t-критерий Стьюдента и ранговый U-критерий Манна–Уитни. Статистически значимыми считались отличия при р<0,05 (95% уровень значимости). Для выявления значимых прогностических показателей, определяющих исход цикла ЭКО, была проведен пошаговый дискриминантный анализ, в состав переменных которого были включены значения GM-CSF, VEGF и TGF-β1 в ЦС.
Результаты исследования
Данные анамнеза достоверно не отличались у женщин обеих клинических групп (р>0,05). Возраст пациенток варьировал от 21 до 35 лет и в среднем составил 30,35±0,34 года. Средний индекс массы тела составил 23,65±3,53 кг/м2. Продолжительность бесплодия варьировала от 1 до 17 лет и в среднем составила 5,93±0,37 года. Впервые лечение бесплодия с применением методов ВРТ проводилось у 49 (50,51%), повторно у 48 49,48%) женщин. Были установлены следующие факторы бесплодия: трубно-перитонеальный у 47 (48,45%) женщин, мужской у 29 (29,90%) женщин, у 43 (44,33%) женщин бесплодие было вызвано наружным генитальным эндометриозом I–II степени. Сочетание факторов бесплодия имело место у большинства – 59 женщин (60,82%). В связи с наличием мужского фактора бесплодия у 28 (56%) пациенток первой группы и у 22 (44%) второй оплодотворение было проведено методом ИКСИ. Средняя доза рекомбинантных гонадотропинов, количество полученных ооцитов и перенесенных эмбрионов не отличались в исследуемых клинических группах. Осуществлялся перенос только морфологически качественных эмбрионов. Частота имплантации составила 38,2% (68 из 178 эмбрионов). Частота наступления беременности составила 51,55% (50 женщин). У 6 женщин (12%) наступила беременность двойней. У 6 женщин (12%) была выявлена неразвивающаяся беременность на ранних сроках и лишь у одной (2%) беременность закончилась поздним самопроизвольным абортом на 22-й неделе. Беременность прогрессирует на данный момент у 19 женщин (38%) и соответствует третьему триместру. У 7 14%) женщин были преждевременные роды и у 17 (34%) – срочные.
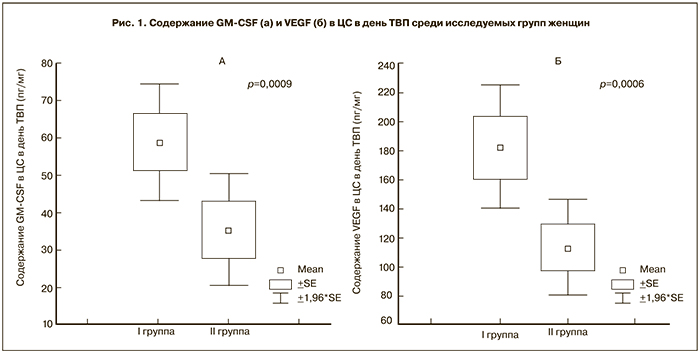
Содержание в ЦС GM-CSF (р=0,0003), VEGF (р=0,012) и TGF-β1 (р=0,039) в день ТВП значительно превосходило соответствующие показатели, полученные в день ПЭ.
Было отмечено значительное увеличение содержания GM-CSF и VEGF (р<0,01) в ЦС в день ТВП (рис. 1а, б) и в день ПЭ (рис. 2а, б) у женщин с наступившей беременностью по сравнению с группой женщин, у которых беременность не наступила. При этом в день ТВП содержание GM-CSF в ЦС у женщин I группы варьировало от 2,09 до 303,65 пг/мл и в среднем составило 58,99±7,76 пг/мг. У женщин II группы его значение определялось в интервале от 2,74 до 76,89 пг/мг и в среднем составило 19,38±2,46 пг/мг. Содержание VEGF в ЦС, полученной в день ТВП, у женщин I группы было в пределах от 21,29 до 821,22 пг/мл (в среднем 182,33±21,66 пг/мг), у женщин II группы варьировало в интервале от 12,23 до 601,97 пг/мг (в среднем 112,36±16,82 пг/мг). В день ПЭ содержание GM-CSF в ЦС у женщин I группы варьировало от 2,97 до 134,09 пг/мл и в среднем составляло 31,49±3,66 пг/мг. У женщин II группы этот показатель изменялся в интервале от 2,74 до 76,89 пг/мг и в среднем составлял 19,39±2,46 пг/мг. Содержание VEGF в ЦС, полученной в день ПЭ у женщин I группы, в среднем составило 131,50±17,92 пг/мг (29,75 – 429,73 пг/мл), у женщин II группы варьировало в интервале от 12,56 до 293,29 пг/мг (в среднем 79,71±7,05 пг/мг).
Отмечена тенденция к увеличению содержания TGF-β1 в ЦС как в день ТВП, так и в день ПЭ у женщин с наступившей беременностью в результате ЭКО, однако полученные отличия не были статистически достоверными (р>0,05).
Была отмечена умеренная положительная корреляция между содержанием GM-CSF (r=0,27, р<0,05), VEGF (r=0,31, р<0,05) в ЦС и наступлением беременности в день ПЭ. Корреляционная зависимость между содержанием GM-CSF (r=0,22, р<0,05), VEGF (r=0,25, р<0,05), VEGF в ЦС и наступлением беременности в день ТВП была менее выражена. У 95% женщин беременность наступила при следующих интервалах значений определяемых факторов роста в ЦС в день ТВП: GM-CSF – от 43,39 до 74,58 пг/мг и VEGF от 138,79 до 225,88 пг/мг. В день ПЭ 95% эффективность соответствовала следующим интервалам значений: GM-CSF – от 24,14 до 38,84 пг/мг и VEGF – от 102,23 до 160,77 пг/мг.
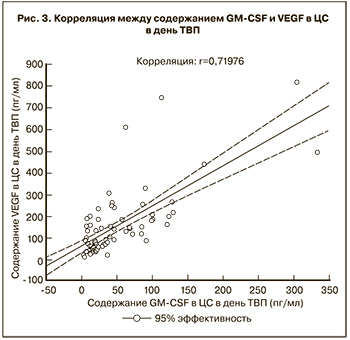
Была выявлена умеренная положительная корреляционная связь между содержанием GM-CSF, VEGF и TGF-β1 в ЦС в день ТВП (r=0,50, р<0,05; r=0,38, р<0,05), а также между содержанием GM-CSF, VEGF и TGF-β1 в ЦС в день ПЭ (r=0,47, р<0,05; r=0,36, р<0,05 соответственно). Более выраженная сопряженность была отмечена в отношении содержания VEGF и GM-CSF в ЦС в день ТВП (r=0,72, р<0,05) (рис. 3).
Дискриминантный анализ, в который были включены все исследуемые факторы роста в ЦС в день ТВП и в день ПЭ, выявил, что содержание VEGF и GM-CSF в ЦС, полученные в день ПЭ, имеют наибольшее предиктивное значение в отношении наступления беременности в цикле ЭКО (69%).
Обсуждение
Считается, что дисбаланс выработки различных иммунологических факторов, в том числе цитокинов, факторов роста, хемокинов, а также их рецепторов приводит к нарушению репродуктивного процесса на любых его стадиях – фолликулогенез, овуляция, имплантация, а также на протяжении всей беременности [15, 16]. В этой связи поиск иммунологических маркеров рецептивности эндометрия и методов их определения в циклах ЭКО является актуальной задачей. Применение неинвазивных методов оценки рецептивности эндометрия в циклах ЭКО является перспективным направлением развития ВРТ, так как позволяет избежать травматизации ткани эндометрия и не создает ограничений для ПЭ [17].
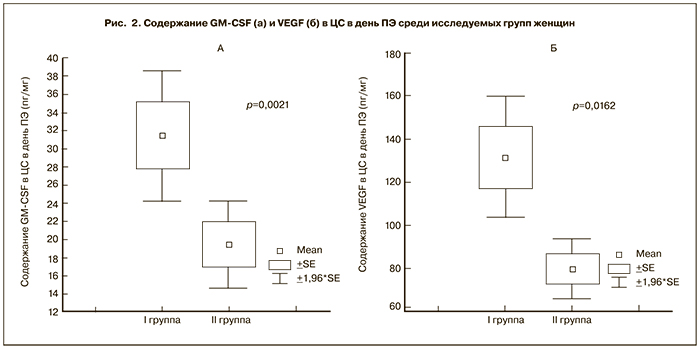
Предприняты попытки получения секрета эндометрия в день ПЭ и доказано, что данная процедура не нарушает процесс имплантации [12, 18]. ЦС представляет секрет эндометрия и слизистой цервикального канала. Неоднократно было отмечено присутствие ряда цитокинов в ЦС [12, 13]. Так в работе C.M. Boomsma и соавт. (2009) доказано, что разные цитокины, присутствующие в смывах из полости матки в день ПЭ у женщин, участвующих в программах ЭКО, находятся также в ЦС, но в менее выраженных концентрациях [12]. Учитывая, что получение ЦС в цикле ЭКО является неинвазивной процедурой и может отражать иммунологический потенциал клеток эндометрия, определение значимости ряда факторов роста на ключевых этапах протокола ЭКО (в день ТВП и в день ПЭ) стало основной целью нашей работы.
Для более точной оценки рецептивности эндометрия мы проводили исследование содержания ряда факторов роста в ЦС у женщин с максимально унифицированными исходными условиями: все пациентки были раннего репродуктивного возраста, всем проводилось лечение бесплодия с применением одинаковых протоколов стимуляции суперовуляции, качество полученных ооцитов и перенесенных эмбрионов не отличалось, обработка полученного материала и его оценка проводились стандартным методом с использованием одной компьютерной системы подсчета данных.
Адекватная васкуляризация эндометрия необходима для совершения процесса имплантации. В этом процессе ключевая роль отводится VEGF. Считается, что именно он является основным ангиогенным фактором, регулирующим рост новых кровеносных сосудов в эндометрии человека [19–21]. Не менее важная роль принадлежит TGF-β1, который участвует в регуляции толерантности иммунной системы матери к имплантируемому эмбриону путем смещения Th1-иммунной реакции в сторону Th2, что обеспечивает иммунологически благоприятные условия для реализации процесса имплантации и прогрессирования беременности [22, 23]. Также одним из основных факторов роста стимулирующих пролиферацию и дифференцировку клеток является GM-CSF, который синтезируется клетками эндометрия, и уже с момента первого деления эмбрион экспрессирует рецепторы к этому фактору на своей поверхности [24, 25].
 Доказано, что выработка многих цитокинов и факторов роста стимулируется стероидными гормонами и в большей степени хорионическим гонадотропином [26–28]. В нашей работе было выявлено, что содержание GM-CSF, VEGF и TGF-β1 в ЦС преобладало в день ТВП над их содержанием в день ПЭ (в 2 раза, 1,4 раза и 1,4 раза соответственно), что объясняется максимальными концентрациями половых стероидных гормонов в день ТВП. Содержание GM-CSF и VEGF в ЦС у женщин с наступившей беременностью в результате ЭКО было выше в день ТВП в 3,5 раза и в 1,6 раза соответственно, и в день ПЭ – в 1,6 раза и в 1,7 раза соответственно, по сравнению с женщинами, у которых беременность не наступила. Полученные результаты отражают прогностическую ценность указанных параметров и согласуются с ранее полученными выводами других авторов, которые выявили снижение уровня этих факторов у женщин с привычным невынашиванием [29, 30], идиопатическим бесплодием [31] и неудачными попытками ЭКО [32] в различном биологическом материале.
Доказано, что выработка многих цитокинов и факторов роста стимулируется стероидными гормонами и в большей степени хорионическим гонадотропином [26–28]. В нашей работе было выявлено, что содержание GM-CSF, VEGF и TGF-β1 в ЦС преобладало в день ТВП над их содержанием в день ПЭ (в 2 раза, 1,4 раза и 1,4 раза соответственно), что объясняется максимальными концентрациями половых стероидных гормонов в день ТВП. Содержание GM-CSF и VEGF в ЦС у женщин с наступившей беременностью в результате ЭКО было выше в день ТВП в 3,5 раза и в 1,6 раза соответственно, и в день ПЭ – в 1,6 раза и в 1,7 раза соответственно, по сравнению с женщинами, у которых беременность не наступила. Полученные результаты отражают прогностическую ценность указанных параметров и согласуются с ранее полученными выводами других авторов, которые выявили снижение уровня этих факторов у женщин с привычным невынашиванием [29, 30], идиопатическим бесплодием [31] и неудачными попытками ЭКО [32] в различном биологическом материале.
Исходя из результатов проведенного нами исследования, у женщин с наступившей после ЭКО беременностью отмечалась тенденция к увеличению содержания TGF-β1 в ЦС в день ТВП и ПЭ, однако эти различия не были статистически достоверными (р>0,05). Поэтому, на наш взгляд, оценка содержания TGF-β1 в ЦС не может являться прогностическим критерием имплантационной способности эндометрия.
В многочисленных работах показана способность TGF-βs, в том числе TGF-β1, усиливать синтез разными клетками, в том числе эпителиальными клетками эндометрия, различных молекул, участвующих в процессе имплантации, таких как факторы роста: VEGF, белок-1, связывающий инсулиноподобный фактор роста (IGFBP-1), металлопротеиназы (MMP-9), лейкемия-ингибирующий фактор (LIF) и снижение синтеза противовоспалительного интерлейкина (IL)-6 [22, 23, 33, 34]. Также было показано, что TGF-βs контролируют дифференцировку T-регуляторных (Тreg) клеток, выступающих в качестве основных медиаторов иммунной толерантности во время беременности [35]. Treg-клетки в свою очередь способны контролировать силу и продолжительность иммунного ответа посредством регуляции функции Т-хелперов, которые способны синтезировать GM-CSF. Полученные нами корреляции между содержанием GM-CSF (r=0,50, р<0,05), VEGF (r=0,38, р<0,05) и TGF-β1 в ЦС в день ТВП, а также между GM-CSF (r=0,47, р<0,05), VEGF (r=0,36, р<0,05,) и TGF-β1 в ЦС в день ПЭ, вероятнее всего, свидетельствуют о способности TGF-β1 усиливать синтез VEGF, GM-CSF клетками эндометрия. Наиболее выраженная сопряженность в отношении содержания VEGF и GM-CSF в ЦС была получена в день ТВП (r=0,72, р<0,05) на пике максимального гормонального воздействия (36 после введения хорионического гонадотропина) и, вероятнее всего, свидетельствует о контролируемой выработке VEGF и GM-CSF клетками эндометрия общими паракринными факторами (TGF-β1 и др.), осуществляющими системную регуляцию процесса имплантации.
Полученные нами результаты по неинвазивному исследованию содержания VEGF, GM-CSF и TGF-β1 в ЦС подтверждают полученные ранее данные при биопсии эндометрия и отражают значительное влияние перечисленных факторов роста на процесс имплантации эмбриона в полость матки, что делает возможным применение этого метода в качестве прогностической оценки эффективности протоколов ЭКО.
В последние годы проводятся исследования по использованию рекомбинантной формы GM-CSF с целью улучшения качества эмбрионов и имплантационных свойств эндометрия в терапии пациентов с повторными неудачами ЭКО [36–38]. Однако требуются дополнительные данные рандомизированных контролируемых исследований с доказанной эффективностью для внедрения этих препаратов в широкую клиническую практику. Еще на более ранней стадии находятся разработки методов клинического применения рекомбинантных препаратов VEGF, играющего ведущую роль в ангиогенезе и являющегося важнейшим звеном процесса имплантации и дальнейшего прогрессирования беременности.
Выводы
При иммуноцитохимическом исследовании ЦС в день ТВП прогностически благоприятными в отношении наступления беременности оказались уровни GM-CSF в пределах от 43,39 до 74,58 пг/мг и значения VEGF в интервале от 138,79 до 225,88 пг/мг.
В день ПЭ содержание в ЦС GM-CSF в пределах от 24,14 до 38,84 пг/мг и VEGF в интервале от 102,23 до 160,77, также было связано с наступлением беременности.
Имеется корреляционная зависимость между содержанием GM-CSF (r=0,27, р<0,05) и VEGF (r=0,31, р<0,05) в ЦС, определяемой в день ПЭ и наступлением беременности, что позволяет прогнозировать ее наступление в цикле ЭКО в 69% случаев.
Выявленные положительные корреляционные связи между содержанием VEGF, GM-CSF и TGF-β1 в ЦС в день ТВП и в день ПЭ свидетельствует об общности механизмов паракринной регуляции процесса имплантации. Наиболее выраженная сопряженность в отношении содержания VEGF и GM-CSF в ЦС получена в день ТВП (r=0,72, р<0,05).
Изолированное определение TGF-β1 в ЦС как в день ТВП, так и в день ПЭ не отражает результативности циклов ЭКО.



