Рак шейки матки является вторым после рака молочной железы наиболее частым злокачественным заболеванием у женщин репродуктивного возраста. Ежегодно более чем у полумиллиона женщин диагностируется рак шейки матки, при этом около 200 000 – с летальным исходом [1, 2]. Причины развития рака шейки матки до конца не изучены. Известно, что это многоэтапный и длительный процесс, приводящий к трансформации нормального эпителия шейки матки в цервикальную интраэпителиальную неоплазию (ЦИН) и инвазивный рак [3].
Проведенные в последние годы эпидемиологические и молекулярные исследования показали, что в подавляющем большинстве случаев ЦИН обусловлены высоко онкогенными типами вируса папилломы человека (ВПЧ). Синтез ранних вирусных онкопротеинов Е5, Е6 и Е7 способствует ингибированию клеточной дифференцировки, нарушению нормальных процессов апоптоза и пролиферации, повреждению хромосом, может инициировать гиперпластические процессы в пораженной ткани вплоть до рака шейки матки [4, 5].
В настоящее время в зарубежной литературе имеется много публикаций, в которых доказана роль микроРНК в развитии неопластической трансформации [6, 7]. МикроРНК – короткие одноцепочечные молекулы длиной 20–25 нуклеотидов, осуществляющие регуляцию экспрессии генов на посттранскрипционном уровне путем ингибирования синтеза белка с мРНК [8]. МикроРНК участвуют в регуляции большинства фундаментальных биологических процессов развития организма: делении клеток, смене фаз клеточного цикла, апоптозе, клеточной миграции и инвазии, ангиогенезе, формировании иммунного ответа. Многочисленные исследования показали, что повышение или снижение экспрессии определенных микроРНК ассоциируются с развитием предраковых и раковых процессов шейки матки [9, 10].
 Особый интерес представляет микроРНК mir-29b, снижение уровня экспрессии которой выявляли при раке различной локализации. Предполагается, что mir-29b выполняет функцию супрессора опухолевого роста, регулируя процессы клеточной пролиферации, апоптоза, метастазирования и хемочувствительности [11, 12]. Значительно в меньшей степени известно о роли mir-29b при предраковых поражениях шейки матки. В связи с этим целью исследования явилось изучение уровня экспрессии mir-29b в развитии ЦИН.
Особый интерес представляет микроРНК mir-29b, снижение уровня экспрессии которой выявляли при раке различной локализации. Предполагается, что mir-29b выполняет функцию супрессора опухолевого роста, регулируя процессы клеточной пролиферации, апоптоза, метастазирования и хемочувствительности [11, 12]. Значительно в меньшей степени известно о роли mir-29b при предраковых поражениях шейки матки. В связи с этим целью исследования явилось изучение уровня экспрессии mir-29b в развитии ЦИН.
Материал и методы исследования
В исследование были включены 74 женщины репродуктивного возраста (средний возраст составил 30,2±1,2 года). Пациентки были разделены на 3 группы: I группа – 24 женщины с диагнозом LSIL (плоскоклеточные интраэпителиальные поражения низкой степени); II группа – 20 пациенток с диагнозом HSIL (плоскоклеточные интраэпителиальные поражения высокой степени). Контрольную III группу составили 30 условно здоровых женщин без патологических изменений шейки матки. Всем пациенткам проводилась расширенная кольпоскопия по общепринятой методике с целью выявления наиболее выраженных изменений эпителия шейки матки. Диагноз SIL (плоскоклеточные интраэпителиальные поражения низкой и высокой степени) был верифицирован на основании цитологического и гистологического исследования шейки матки. Тестирование на инфицированность ВПЧ было проведено методом полимеразной цепной реакции (ПЦР) с использованием «Комплекта реагентов HPV квант-21, который предназначен для выявления, типирования и количественного определения ДНК ВПЧ низкого (6, 11, 44) и высокого (16, 18, 26, 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66, 68, 73, 82) канцерогенного риска» (ДНК-Технология, Россия).
Измерение уровня экспрессии микроРНК проводили методом количественной ПЦР в реальном времени с использованием комплекта реактивов TaqMan miRNA Assay (Applied Biosystems).
Статистическую обработку результатов исследования уровней экспрессии mir-29b проводили методом непараметрического анализа с использованием программы Statistica 10, IBM SPSS Statistics v22. Для сопоставления двух групп по количественным признакам применяли U-критерий Манна-Уитни. Различие между группами полагали статистически значимыми при р<0,05. Для выявления точки отсечки положительных результатов диагностического теста и определения его диагностической точности использовались бинарная логистическая регрессия и ROC-кривая.
Результаты исследования
При обследовании пациенток I и II групп выявлены различные аномальные кольпоскопические картины. Наиболее частыми кольпоскопическими признаками в обеих группах были атипическая зона трансформации с ацетобелым эпителием (АБЭ), который выявлялся чаще в пределах зоны трансформации и проявлялся в виде йоднегативных участков с четкими контурами (91,7 и 95% соответственно). При этом зона трансформации I наблюдалась у 23 пациенток I и у 18 – II группы; зона транформации II – у 1 пациентки в I группе и у 2 пациенток II группы. В I-й группе АБЭ с нежной пунктацией (П) выявлен у 7 (29,2%) пациенток, АБЭ с мозайкой (М) – у 9 (37,5%), одновременно с П и М – у 7 (29,2%). Эктопия шейки матки с атипической зоной трансформации выявлена у 6 (25%) пациенток. Атипические сосуды выявлены у 4 (16,7%) женщин. Во II группе кольпоскопически выявлены более выраженные изменения в виде АБЭ с грубой пунктацией (П) – у 5 (25%) пациенток, АБЭ с грубой мозайкой (М) – у 9 (45,0%), одновременно с грубой П и М – у 4 (20,0%). Эктопия шейки матки с атипической зоной трансформации выявлена у 5 (25%) пациенток. Атипические сосуды выявлены у каждой четвертой пациентки. В одном случае в I группе и в 2 случаях во II группе мы не выявили каких-либо патологических изменений на шейке матки. Однако по данным цитологического исследования были верифицированы диагнозы LSIL (в I группе) и HSIL (во II группе), что потребовало выскабливания цервикального канала. В контрольной группе нормальная зона трансформации выявлена у всех пациенток.
По результатам тестирования на ВПЧ выявлены различные высоко онкогенные типы вируса: 16 тип – у 19 пациенток (в I группе у 7, во II – у 12), 18 тип – у 9 женщин (в I группе у 3, во II – у 6), другие типы вируса (33, 45, 52, 58) – у 16 пациенток (в I группе у 14, во II группе – у 2 пациенток). Сочетание нескольких высоко онкогенных типов ВПЧ встречалось у 5 пациенток.
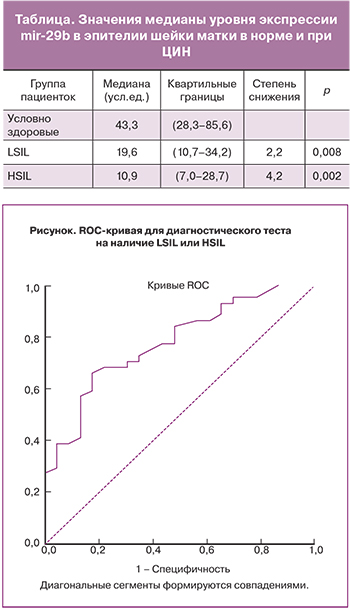
Результаты исследования экспрессии mir-29b в эпителии шейки матки в норме и при разной степени выраженности ЦИН приведены в таблице. Было выявлено снижение уровня экспрессии исследуемой микроРНК в 2,2 раза при LSIL, и в 4,2 раза – при HSIL (p=0,008 и 0,0002 соответственно).
Использование логистической регрессии и ROC-анализа (рисунок) показало, что оценка экспрессии mir-29b позволяет предсказать развитие ЦИН на основании исследования mir-29b с чувствительностью 70% и специфичностью 72,2%. Диагностическая эффективность составила 70,3%.
Обсуждение
Mir-29b входит в семейство микроРНК mir-29, мишенью для которых являются гены, участвующие в регуляции клеточной пролиферации, апоптоза, дифференцировки и старении клеток. В настоящее время имеется ряд публикаций, указывающих на функцию mir-29b как супрессора злокачественных образований [11, 12]. Экспериментальные исследования показали, что mir-29b активирует апоптоз в раковых клетках путем инактивации мРНК гена Mcl-1, кодирующего антиапоптотический белок, являющийся членом семейства Bcl-2 [13]. Более того, экспрессия белка р53, индуцирующего апоптоз во многих типах раковых клеток, прямо коррелирует с уровнем mir-29b [14]. Экзогенно введенная миелоидным мышам mir-29b тормозит рост и приводит к апоптотическому разрушению раковых клеток [12]. Мишенью для mir-29b являются также прометастатические факторы, участвующие в ангиогенезе, ремоделировании коллагена, протеолизе [11].
В отличие от других типов рака, для рака шейки матки имеются четко выраженные предраковые состояния – ЦИН различной степени тяжести. Поэтому крайне важно установить как рано микроРНК, участвующие в опухолевом процессе, меняют свою экспрессию в процессе неопластической трансформации, и как они могут быть использованы для прогноза заболевания.
В настоящем исследовании мы показали, что уровень экспрессии mir-29b в эпителии шейки матки значительно снижается уже на стадии ЦИН. Проведение логистического регрессионного анализа ROC-кривой показало, что количественное измерение экспрессии mir-29b в эпителии шейки матки позволяет диагностировать неопластические поражения с чувствительностью 70% и специфичностью 72%.
Заключение
Таким образом, проведенное исследование позволяет наряду с традиционными методами, рассматривать mir-29b, как один из информативных молекулярных маркеров прогнозирования степени поражения цервикального эпителия при неопластических заболеваниях шейки матки.



