Работа частично поддержана Государственным контрактом Министерства образования и науки РФ №16.512.11.2093 от 22.02.2011.
Высокая распространенность и рецидивирующее течение гиперплазии эндометрия (ГЭ), сопряженность с маточными кровотечениями и риском развития рака эндометрия свидетельствуют о необходимости развития данного направления. Успехи молекулярной биологии и медицинской генетики, достигнутые в последние годы, существенно расширили спектр методических возможностей для проведения научных исследований. Один из ключевых вопросов гинекологии и онко гинекологии – это поиск молекулярно-генетических предикторов формирования ГЭ и эндометриоидной карциномы (ЭК). Его решение позволило бы определить риск возникновения этих заболеваний и направленность последующего их развития. Это во многом способствовало бы объективизации тактики ведения больных.
Многофакторность генеза ГЭ значительно затрудняет разработку методов профилактики и лечения. Основные патофизиологические механизмы возникновения ГЭ сводятся к следующим: чрезмерное воздействие эстрогенов при недостатке прогестерона, нарушение экспрессии рецепторов половых стероидных гормонов, повышение ангиогенеза, дискоординация между пролиферацией и апоптозом и многие другие. Ряд авторов предполагают, что развитию ГЭ способствует чрезмерная пролиферации эндометрия [1, 2]. Это подтверждается увеличением экспрессии PCNA (proliferating cell nuclear antigen) – маркера, отражающего процессы репарации ДНК в пролиферирующих клетках. [3, 4]. Результаты целого ряда других исследований опровергают эту точку зрения, указывают на снижение пролиферативной активности при простой ГЭ (ПГЭ) по экспрессии
Ki-67 [4–6]. Таким образом, вопрос о роли пролиферации в генезе ГЭ остается до настоящего времени дискуссионным. Патогенетические механизмы возникновения ГЭ такжк принято рассматривать с позиций потери клетками способности вступать в апоптоз в ответ на проапоптотические стимулы. Известно, что это приводит к снижению запрограмированной клеточной гибели и накоплению трансформированных клеток. Если ранее апоптоз оценивался, в основном, по активности Ca2+-Mg2+- зависимой эндонуклеазы (фермента, участвующего в фрагментации ДНК), то в последние годы все большее внимание уделяется экспрессии проапоптотических и антиапоптотических белков, фрагментации ДНК методом TUNEL-теста. Наиболее изученными проапоптотическими факторами считаются – BAX, Bad, Bak, антиапоптотическими – BCL2, BCL-XL, BAG1 [7–9]. С точки зрения диагностики информативным считается соотношение BCL2 к BAX, так называемый апоптотический индекc [6]. Ряд авторов указывают на снижение этого индекса при разных типах ГЭ и, особенно при ЭК, по сравнению с морфологически неизмененным эндометрием [10, 11]. Другие исследователи выявили противоположную закономерность [12, 13]. Представляется, что разноречивость мнений связана с несовершенством классификации и трудностями диагностики разных типов ГЭ, а также различием методических подходов и воззрений.
В последние годы появилась реальная возмож ность определять экспрессию ряда новых генов – регуляторов клеточного роста. К ним относят ген, ингибирующий функцию протоонкогена N-myc (NDRG1 – N-myc downstream regulated gene). Считается, что белок этого гена необходим для активации ряда каспаз при р53 опосредованном апоптозе, этим объясняют его проапоптотические свойства [14]. Предположительно, в регуляции клеточного развития принимает участие ген сурвивин (BIRC5 – baculoviral IAP repeat-containing protein 5), ему приписывают антиапоптотический эффект [15]. Так ли это, окончательно не ясно, особенно при ГЭ. Приходится ориентироваться на результаты малочисленных и разноплановых исследований [16]. Пока не удалось однозначно оценить вклад этих факторов в развитие гипер- и неопластических процессов эндометрия. Хотя этот вопрос представляется важным и интересным. Проблема развития гипер- и неопластических процессов эндометрия крайне сложна, к числу регуляторов пролиферации и апоптоза также относят ген-супрессор опухолевого роста PTEN (phosphatase and tensin homologue deleted from chromosome 10). Большинство работ посвящено изучению его экспрессии при раке эндометрия [17], в то же время вопрос о его прогностической роли при ГЭ остается недостаточно изученным, хотя представляется весьма перспективным.
Таким образом, несмотря на интенсивный поиск молекулярно-генетических маркеров ГЭ, пока невозможно выбрать информативные прогностические факторы формирования и развития заболевания.
Измерение уровней экспрессии мРНК генов BCL2, BAX, BAG1, BIRC5, NDRG1, PTEN и четырех референсных генов B2M, TBP, GUSB, HPRT1 проводили методом количественной полимеразной цепной реакции в режиме реального времени с предварительной стадией обратной транскрипции (ОТ-ПЦР), согласно инструкции (ООО «НПО ДНК-Технология», Россия). Взятие материала осуществляли аспирационной кюреткой Пайпель де Корнье в пробирки со средой для стабилизации РНК. Для количественной оценки уровня экспрессии мРНК генов использовали метод сравнения индикаторных циклов (∆∆Сq) c нормировкой по референсным генам и медиане значений уровня экспрессии гена в контрольной группе стадии пролиферации, которое было принято за 1 единицу. В качестве меры центральной тенденции всех количественных показателей использовали медиану (Me), в качестве интервальной оценки – нижний (0,25) и верхний (0,75) квартили.
Иммуногистохимическое (ИГХ) исследование проводили на образцах тканей от 89 пациенток, разделенных на следующие группы: 1-я (контрольная) группа – эндометрий поздней фазы пролиферации (n=11), 2-я группа – ПГЭ (n=23), 3-я группа – КГЭ (n=18), 4-я группа – АГЭ (n=15), 5-я группа – ЭК (n=22).
ИГХ выявление антигенов в парафиновых срезах иммунопероксидазным методом двойных антител со стрептовидин-биотиновым комплексом (DAKO) проводили по общепринятой методике. В качестве первичных антител были использованы моноклональные антитела к антигену PTEN (Dako). В качестве вторичных антител применяли биотинилированные антитела к иммуноглобулинам мыши и кролика (Dako LSAB+KIT, PEROXIDASE). Рабочая концентрация составила 1:100 и 1:200. Производилась постановка позитивных и негативных контрольных реакций.
Оценка информативности полученных результа- тов ИГХ исследования и ОТ-ПЦР проводилась непараметрическим методом с помощью U-критерия Манна-Уитни. Коэффициент ранговой корреляции определяли по методу Спирмена.
Результаты исследования
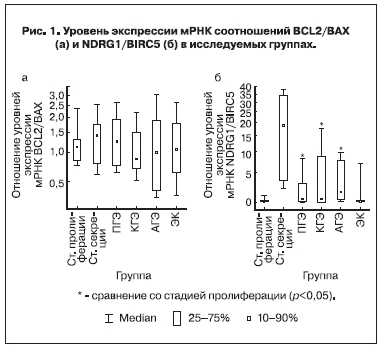
Результаты экспрессии мРНК генов апоптоза при различных типах ГЭ, ЭК и в морфологически неизмененном эндометрии отражены в табл. 1. Как видно, экспрессия мРНК генов BCL2 и BAX при различных типах ГЭ и ЭК существенно не различалась, однако была заметно ниже по сравнению со стадиями пролиферации (р<0,05) и секреции (p<0,005). Экспрессия ингибитора апоптоза BAG1 не различалась между ПГЭ, КГЭ и стадией пролиферации, однако была отмечена тенденция к повышению при ЭК. Достоверное увеличение экспрессии выявлено при АГЭ и в стадию секреции по сравнению со стадией пролиферацией (р<0,05). Апоптотический индекс BCL2/BAX не показал статистически значимых различий между группами (рис. 1а).
Цель исследования: определение клинической значимости экспрессии мРНК генов, участвующих в процессах апоптоза, и гена-супрессора опухолевого роста PTEN при разных типах ГЭ и ЭК.
Материали методы исследования
Проведено клинико-лабораторное обследование 133 женщин. Из них 64 с ГЭ (средний возраст 42,1±6,8 года, средний ИМТ 28,1±6,8 кг/м2) составили основную группу; 56,2% из них находились в реп родуктивном возрасте, остальные – в пременопаузе. Основная группа была подразделена на подгруппы в соответствии с типом ГЭ (по классификации ВОЗ) [18]. В 1-ю подгруппу была включена 31 пациентка с ПГЭ, во 2-ю – 18 с комплексной ГЭ (КГЭ), в 3-ю – 15 с атипической ГЭ (АГЭ) (во всех случаях комплексной). В качестве группы сравнения были включены женщины в пери- и постменопаузе (средний возраст 60,2±4,9 года, ИМТ 32,4±3,6 кг/м2), у которых взяли 22 образца ткани ЭК.. Контролем послужили образцы морфологически неизмененного эндометрия фазы пролиферации (n=26) и секреции (n=21), полученные от здоровых женщин репродуктивного возраста без воспалительных заболеваний органов малого таза и внутриматочной патологии. Исследование одобрено этическим комитетом ФГБУ НЦ АГиП им. академика В.И. Кулакова Минздрава России.
Операционно-биопсийный материал подвергали стандартной проводке на гистопроцессоре и заливке в парафиновые блоки. Срезы толщиной 5 мкм окрашивали гематоксилином и эозином.
Определение экспрессии мРНК генов апоптоза методом ОТ-ПЦР было проведено на 122 образцах ткани эндометрия, из них 31 – ПГЭ, 15 – КГЭ, 12 – АГЭ, 17 – ЭК, 26 – эндометрий стадии пролиферации и 21 – секреции.
Показалось важным провести анализ экспрессии мРНК гена BIRC5, обладающего антиапоптотическими свойствами, и NDRG1 – проапоптотическими. Обнаружено 3–7-кратное снижение BIRC5 в группах с разными типами ГЭ и ЭК по сравнению с пролиферативным эндометрием (р<0,01), достоверных различий между типами ГЭ и ЭК выявлено не было (табл. 1). При сравнении с эндометрием стадии секреции выявлено достоверное повышение данного маркера в группах АГЭ (р=0,014) и ЭК (р=0,002) в 2,8 и 2,1 раза соответственно.
Таблица 1. Уровень экспрессии мРНК генов апоптоза в морфологически неизмененном эндометрии, при различных типах ГЭ и ЭК (данные представлены в виде Ме (Q1-Q3).
Данные, представленные в табл. 1, свидетельствуют об информативности гена NDRG1. В группах ПГЭ, КГЭ и эндометрия стадии пролиферации его экспрессия была сравнима. При АГЭ оказалась выше, чем при ПГЭ в 3,7 раза (р=0,038) по сравнению с КГЭ – в 2,4 раза (р=0,22), с эндометрием стадии пролиферации — в 4 раза (р=0,017). В образцах неопластического эндометрия наблюдалась обратная ситуация – экспрессия NDRG1 была снижена в 7,7–28 раз (р<0,05) по отношению к разным типам ГЭ (ПГЭ, КГЭ и АГЭ соответственно) и в 7,2 раза (р=0,0022) по отношению к пролиферативному эндометрию. По сравнению с эндометрием стадии секреции при разных типах ГЭ экспрессия NDRG1 была ниже в 5,5–22 раза (р<0,05), а при ЭК более чем в 150 раз (р=2,3×10-7).
Поскольку апоптотический индекс BCL2/BAX оказался малоинформативным, было решено рассмотреть соотношение NDRG1 (как активатора апоптоза) к BIRC5 (как ингибитора; рис. 1б). Установлено повышение индекса при ПГЭ и КГЭ в 3,8 раза, при АГЭ – в 12,8 раза (р=0,014) по сравнению с пролиферативным эндометрием. При ЭК отмечалась обратная закономерность: снижение индекса NDRG1/BIRC5 в 2 раза (р=0,082) по сравнению с пролиферативным эндометрием. По сравнению с секреторным эндометрием индекс был снижен в 12–44 раза при различных типах ГЭ и в 350 раз – при ЭК (р=1,8×10-7).
Изучение экспрессии гена-супрессора опухолевого роста PTEN проводилось двумя независимыми методами ОТ-ПЦР и ИГХ. Полученные данные указывают на схожую экспрессию мРНК PTEN в образцах неизмененного эндометрия и при различных типах ГЭ. Достоверное снижение было выявлено лишь при ЭК по отношению к ПГЭ, КГЭ и эндометрию стадии пролиферации (р=0,005).
По результатам ИГХ исследования, в эпителии желез эндометрия поздней стадии пролиферации выявлена 100% экспрессия PTEN, в строме содержание PTEN-позитивных клеток составило 65±3,3%. В эпителии желез при ПГЭ и КГЭ количество PTEN-позитивных эпителиальных и стромальных клеток составило 96±4,8% и 97,88±4,9% соответс- твенно, что практически не отличалось от нормального эндометрия (рис. 2, см. на вклейке). При АГЭ установлено уменьшение PTEN-позитивных клеток (79,43±4%) (р<0,05) по сравнению с эндометрием стадии пролиферации. При ИГХ исследовании выявлено, что ЭК по признаку наличия экспрессии PTEN условно можно разделить на два иммунофенотипа: PTEN-негативные ЭК с полной или частичной инактивацией гена (1% PTEN-позитивных клеток в эпителии желез и 2% в клетках стромы) и PTEN-позитивные с сохранением экспрессии в 86,83±4,3% клетках эпителия и 76,25±3,8% стромы. Морфологически оба фенотипа высокодифферен- цированной ЭК не различались.
Обсуждение
Этиология ГЭ остается до конца непонятной, патогенетические механизмы четко не определены, клиническое течение неоднозначное – от спонтанной регрессии до ЭК. В последние десятилетия идет интенсивный поиск молекулярно- генетических предикторов развития, персистенции и прогрессирования ГЭ. Понятно, что единственного предиктора развития как ГЭ, так и ЭК быть не может, вероятно, придется ориентироваться на многие информативные показатели, как это делается в других областях науки, изучающих биологические системы. Проведенное исследование было направлено на поиск дополнительной диагностической и прогностической информации на основе изучения мРНК известных и малоизученных генов – регуляторов апоптоза. Обычно приходится ориентироваться на результаты метода ИГХ, позволяющего определить экспрессию генов в строме и железах. К сожалению, метод трудоемкий, дорогостоящий и не везде применим. Поэтому было проведено пилотное исследование экспрессии генов, ответственных за регуляцию апоптоза, более экономичным методом ОТ-ПЦР, для оценки его информативности и возможности применения в клинической практике.
Получены данные о снижении экспрессии BCL2 и BAX при различных типах ГЭ и ЭК по сравнению с эндометрием стадии пролиферации. Это не соответствует результатам многих исследований, в которых указывается на повышение уровня ингибитора апоптоза BCL2 и/или снижение активатора BAX [13, 19, 20, 21]. Проанализирована значимость апоптотического индекса BCL2/BAX, он оказался малоинформативным. Хотя этому скромному показателю зачастую отводится значительная роль [13, 17]. В литературе есть работы, авторы которых приводят результаты, близкие с полученными нами [12, 22], которые не позволяют четко определить роль апоптоза в генезе ГЭ и ЭК по указанным выше факторам.
Помимо общеизвестных маркеров апоптоза, методом ОТ-ПЦР диагностировано снижение экспрессии мРНК BIRC5 при различных типах ГЭ и ЭК по сравнению с эндометрием стадии пролиферации. Это может косвенно свидетельствовать об активации процессов апоптоза, что согласуется с понятиями онкогенеза и опухолевой прогрессии [23]. Установлен циклический характер экспрессии BIRC5 – повышение в стадию пролиферации и снижение в стадию секреции. Обратная зависимость была определена для белка NDRG1 – низкий уровень в фазу пролиферации и увеличение в фазу секреции. Полученные закономерности вполне согласуются с данными литературы [15, 24]. Замечена тенденция к возрастанию экспрессии NDRG1 при ПГЭ и КГЭ, достоверное повышение – при АГЭ (p<0,05). В образцах ЭК установлено снижение экспрессии этого белка по сравнению со всеми исследуемыми группами. Длительное снижение NDRG1 может способствовать снижению апоптоза и усилению пролиферации клеток. Это приводит к накоплению соматических мутаций и прогрессии роста опухоли. S. Li и соавт. выявили повышение экспрессии NDRG1 при ЭК. Однако авторы оценивали ишемизированную поврежденную ткань, которая дает неспецифическое окрашивание при ИГХ исследованиях [25]. Представляется, что для более полной интерпретации полученных данных и точных выводов относительно значимости NDRG1 в генезе ГЭ, необходимо проведение исследований методом ИГХ.
По нашему мнению, более информативным по сравнению с индексом BCL2/BAX является индекс NDRG1/BIRC5, где NDRG1 рассматривается как активатор р53-опосредованного пути апоптоза клеток, а BIRC5 как ингибитор апоптоза и стимулятор пролиферации. Для эндометрия стадии пролиферации индекс NDRG1/BIRC5 оказался невысоким, в секреторную фазу возрос в 160 раз (р=1,8×10-10). Это отражает готовность эндометрия к клеточной гибели через терминальную дифференцировку клеток. Повышение индекса NDRG1/BIRC5, отмеченное при различных типах ГЭ, по видимому, отражает возможности компенсаторно-приспособительных реакцией по уничтожению клеток, содержащих соматические мутации. Его снижение при ЭК, вероятно, можно рассматривать как недостаточность компенсаторных возможностей и как неблагоприятный фактор прогноза заболевания.
Ген-супрессор опухолевого роста PTEN регулирует рост эпителия, подавляет пролиферацию клеток и способствует вступлению клетки в апоптоз. [26]. Потеря функции PTEN делает клетки менее чувствительными к апоптогенным стимулам, может вести к бесконтрольному клеточному росту и возникновению опухоли [27]. Это происходит посредством ингибирования онкогена PKB/Akt, подавляющего митохондриальный путь индукции апоптоза. По результатам проведенного исследования можно сделать предположение, что степень угнетения активности гена PTEN определяет риск развития предрака и рака эндометрия, что было отмечено нами ранее [28]. Оценка экспрессии PTEN проводилась двумя независимыми методами (ОТ-ПЦР и ИГХ). Предположительно, этим обусловлена некоторая разница в полученных результатах. Потеря экспрессии PTEN носит локальный характер, возможно, в связи с этим методом ОТ-ПЦР при АГЭ не выявлено снижение его экспрессии, тогда как при ЭК процесс становится более диффузным, выявляется достоверное снижение мРНК PTEN.
Результаты настоящего исследования в совокупности с данными других авторов позволяют предположить, что гипер- и неопластические состояния эндометрия в значительной степени определяются изменениями механизмов апоптоза и снижением экспрессии гена-супрессора опухолевого роста PTEN. Понятно, что это не единственные механизмы формирования ГЭ и рака эндометрия. Однако в соответствии с полученными данными, в качестве факторов риска развития рака эндомет- рия можно рассматривать снижение экспрессии PTEN, NDRG1, индекса NDRG1/BIRC5.
Морфологическая оценка является основным методом верификации диагноза ГЭ и ЭК. Для принятия решения о виде терапии необходим поиск таргентных генов, ассоциированных с малигнизацией гиперпластически измененного процессов эндометрия. Можно полагать, что в будущем эти два метода (ОТ-ПЦР и ИГХ) позволят расширить представление о генезе ГЭ и ЭК, а также разработать новые подходы к лечению и прогнозированию развития процесса.
Выводы
Снижение экспрессии мРНК NDRG1 при ЭК может способствовать подавлению процессов апоптоза, активации пролиферации, накоплению соматических мутаций, развитию и прогрессии опухоли.
Повышение индекса NDRG1/BIRC5 при ПГЭ, КГЭ и особенно при АГЭ, вероятно, отражает возможности некоторых компенсаторно-приспособительных реакцией по уничтожению клеток, содержащих соматические мутации, его понижение при ЭК, вероятно, можно оценивать как недостаточность компенсаторных механизмов.
Снижение экспрессии PTEN, выявленное методом ОТ-ПЦР и ИГХ, можно рассматривать, как фактор риска формирования предраковых состояний эндометрия и ЭК.
Метод ОТ-ПЦР, вероятно, может быть использован в качестве скрининга для выявления ГЭ и дифференциального диагноза с ЭК, наиболее информативно определение мРНК NDRG1, PTEN и соотношение NDRG1/BIRC5.



