Актуальность данной темы определяется, прежде всего, продолжающимся ростом частоты операции кесарева сечения в Российской Федерации. Только за последние 10 лет количество абдоминального родоразрешения увеличилось на 252 тысячи – с 250 700 операций в 2005 году до 502 885 в 2014 году, то есть в 2 раза. На прошедшем в Ванкувере XXI Всемирном конгрессе ФИГО (4–9 октября 2015 года) было уделено особое внимание первичной профилактике операции кесарева сечения, поскольку предлежание плаценты после этой операции встречается в 15 раз чаще, а после третьей операции – уже в 3 раза чаще, чем после первой. При этом риск врастания плаценты возрастает в 16,7 раза, а риск гистерэктомии – более чем в 70 раз.
В последние годы в структуре показаний к операции кесарева сечения рубец на матке занимает лидирующие позиции. Практически у каждой четвертой именно рубец миометрия послужил непосредственной причиной к повторному абдоминальному родоразрешению [1–5]. Выбор тактики ведения беременности, оптимальных сроков и методов родоразрешения у таких пациенток представляет значительные трудности и в каждом конкретном случае должен решаться индивидуально. При этом существенное увеличение оперативного родоразрешения как за рубежом, так и в нашей стране перестало уже быть только медицинской проблемой [6–8].
В этой связи достижения в технике операции и создание современных синтетических шовных материалов позволили повысить репарационные возможности к формированию полноценного рубца на матке. Все это и предопределяет оптимизацию акушерской тактики у пациенток с рубцом на матке после кесарева сечения в пользу самопроизвольного родоразрешения. Самый действенный путь снижения частоты кесарева сечения – это первичная ее профилактика, но и ведение родов через естественные родовые пути с рубцом на матке также можно рассматривать как реальный путь снижения оперативного родоразрешения [9–12].

Материал и методы исследования
Исход беременности и родов после абдоминального родоразрешения зависит от полноценной репарации тканей матки после ее рассечения, что обеспечивает формирование состоятельного рубца. При этом рубец миометрия представляет собой плотное образование, состоящее из гиалинизированной, богатой коллагеновыми волокнами соединительной ткани, возникающее в результате регенерации при нарушении ее целостности. Заживление рассеченной стенки матки может происходить путем как реституции (полноценная регенерация), так и субституции (неполноценная регенерация). При полноценной регенерации заживление раны происходит благодаря гладкомышечным клеткам, при субституции – пучкам грубой волокнистой соединительной, нередко гиалинизированной ткани; при таком типе заживления с наибольшей вероятностью возможен разрыв матки в последующую беременность [3, 11, 13]. Степень полноценности заживления рассеченной стенки матки является одной из основополагающих проблем последующей беременности и успешного ее завершения. В настоящее время оценка состояния рубца на матке после операции кесарева сечения остается важной задачей в акушерстве [1, 3]. Гистологические исследования иссеченных рубцов, проведенные на базе Новосибирского городского перинатального центра показали, что при экстренном родоразрешении было характерно обнаружение массивных кровоизлияний в миометрии [14]. В тканях матки и рубцах была отмечена выраженная как диффузная, так и очаговая лейкоцитарная инфильтрация со склерозом сосудистой стенки (рис. 1–3). При плановой операции в рубцах отсутствовали кровоизлияния, и была умеренная лейкоцитарная инфильтрация (рис. 4).
И уже только на основании морфологических данных рубца (отсутствие кровоизлияний и лейкоцитарной инфильтрации) было сделано заключение о возможности ведения родов через естественные родовые пути после предшествующего планового кесарева сечения. При этом проведенные исследования показали принципиальную возможность ведения самопроизвольных родов с рубцом на матке вне зависимости от шовного материала, однако у 40% беременных после предыдущего кесарева сечения формировался неполноценный рубец [10, 14]. В этой связи в течение 6 лет начиная с 2009 года проведена серия экспериментальных работ с лабораторными крысами, в ходе которых изучались изменения рубца лабораторных животных после наложения лигатур на маточные рога (моделирование гидрометры) и применения мезенхимальных стромальных клеток костномозгового происхождения (ММСККП) с трансфицированным геном GFP. Было показано, что после введения ММСККП в сформированный рубец справа (2 месяца после перевязки) в нем присутствовали крупные группы кровеносных сосудов с форменными элементами крови внутри; такие группы сосудов не были найдены в рубце рога на противоположной стороне. При исследовании неокрашенных срезов в отраженном ультрафиолетовом свете было обнаружено достаточно яркое свечение в эндотелии и наружной оболочке сосудов рубца маточного рога только на стороне инъекции ММСККП. Экспрессия гена GFP не только в эндотелии сосудов, но и в их наружных оболочках, указывало на то, что возможно дифференцирование ММСККП, как в эндотелиальном, так и в перицитарном направлениях. Было сделано заключение, что после введения в рубец ММСККП они формируют кровеносные сосуды за счет дифференцировки в эндотелиоциты и перициты [14, 15].
В качестве модели были использованы самки крыс инбредной линии Wag весом 180–200 г возрастом 6 месяцев. Все манипуляции с животными осуществляли под общим ингаляционным эфирным наркозом в условиях чистой операционной с соблюдением «Правил проведения работ с использованием экспериментальных животных» (Приказ Министерства высшего и среднего специального образования СССР № 742 от 13 ноября 1984 г.) [16–18].
В асептических условиях проводили нижнесрединную лапаротомию. Маточные рога выводили в рану и тщательно обкладывали стерильными салфетками. Под конец каждого рога вблизи тела матки подводили кетгутовую лигатуру и перевязывали в указанном отделе. Брюшную полость ушивали наглухо послойно [13, 15, 18].
 ММСККП выделяли, вымывая костный мозг из эпифизов бедренных костей у крыс-самцов линии Wag. Полученную суспензию клеток помещали в пластиковые флаконы («Nunk», Дания), через 48 часов после эксплантации костного мозга не прикрепившиеся клетки сливали. Прикрепившиеся клетки культивировали в среде α-МЕМ с добавлением 10% эмбриональной телячьей сыворотки («Biolot», Россия) при 37°С в СО2 – инкубаторе с 5% СО2 в условиях насыщенной влажности. Смену среды производили каждые три дня. При субкультивировании монослойную культуру рассевали в плотности 1000–5000 клеток/см2 (в зависимости от ростовых свойств используемой эмбриональной сыворотки), использовали стандартные растворы Версена и трипсина [15, 19, 20]. ММСККП 2 пассажа трансфицировали ДНК плазмиды pЕGFP-N1 (Clontech Laboratories Inc., USA), содержащей ген зеленого флюоресцентного белка GFP.
ММСККП выделяли, вымывая костный мозг из эпифизов бедренных костей у крыс-самцов линии Wag. Полученную суспензию клеток помещали в пластиковые флаконы («Nunk», Дания), через 48 часов после эксплантации костного мозга не прикрепившиеся клетки сливали. Прикрепившиеся клетки культивировали в среде α-МЕМ с добавлением 10% эмбриональной телячьей сыворотки («Biolot», Россия) при 37°С в СО2 – инкубаторе с 5% СО2 в условиях насыщенной влажности. Смену среды производили каждые три дня. При субкультивировании монослойную культуру рассевали в плотности 1000–5000 клеток/см2 (в зависимости от ростовых свойств используемой эмбриональной сыворотки), использовали стандартные растворы Версена и трипсина [15, 19, 20]. ММСККП 2 пассажа трансфицировали ДНК плазмиды pЕGFP-N1 (Clontech Laboratories Inc., USA), содержащей ген зеленого флюоресцентного белка GFP.
Через 4 часа после трансфекции клетки разводили не трансфицированными клетками в соотношении 1:2,5, соответственно, и по 100 мкл смеси, содержащей 106 клеток в 1 мл при релапаротомии и после удаления нелизированных остатков шовного материала вводили в область сформированного рубца через 2 месяца после перевязки обоих маточных рогов [21]. Контролем выступали крысы с перевязанными маточными рогами после инъекций соответствующего объема культуральной среды без использования ММСККП и интактные животные. На каждую точку исследования было использовано 12 крыс (всего 108 животных).
Фрагменты маточного рога с рубцом, удаленные через 4 суток, 1, 2 и 3 недели после введения ММСККП, фиксировали в 4% растворе параформальдегида на фосфатном буфере (рН 7,4) не менее 24 часов, обезвоживали в градиенте этанола возрастающей концентрации, просветляли в ксилоле и заключали в гистопласт. Неокрашенные срезы толщиной 5–7 мкм изучали на световом микроскопе Axioimager M1 при увеличении до 1500 раз в режиме люминесценции с фильтром Alexa 488.
Сразу по истечении 3 недель после удаления лигатур с рогов матки (с последующим применением ММСККП (26 животных) или без него (46 особей)) к оставшимся крысам подсаживали самцов. Регистрировали дату родов и количество новорожденных крысят. В связи с тем, что беременность у этого вида животных длится 22 дня [13, 17, 18], наблюдение вели в течение 10 недель после подсаживания самцов (3 срока наступления и завершения беременности).
Статистическую обработку результатов проводили на прикладной статистической программе MS Excel 7.0 (Microsoft, USA). Достоверность различий определяли на основании критерия Стьюдента. Достоверным считали различие между сравниваемыми рядами с уровнем доверительной вероятности 95% и выше. При расчетах учитывали, что распределение исследуемых признаков было близким к нормальному.
Результаты и обсуждение
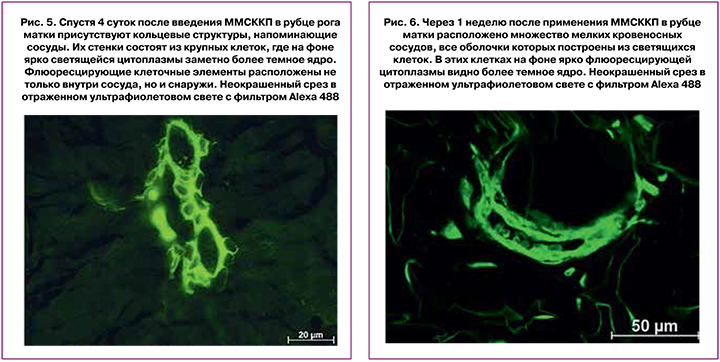
Через 4 суток после удаления лигатуры с перевязанных рогов матки и введения ММСККП в рубце миометрия, тканях вокруг и в миометрии были найдены единичные небольшие сосуды, полностью построенные из светящихся клеток. Несколько реже клетки со свечением формировали только часть сосудистой стенки (рис. 5).
Таким образом, уже к 4-м суткам после инъекции в рубце миометрия ММСККП собираются в группы и формируют кольцевые структуры, сходные с молодыми сосудами: тонкие однослойные стенки и очень широкий практически круглый просвет. Скорее всего, такие сосуды образуются в тканях de novo и только потом включаются в микроциркуляторное русло.
Спустя 1 неделю после введения ММСККП в рубце и тканях рядом с ним присутствовало множество мелких кровеносных сосудов, все оболочки которых были построены из светящихся клеток. В группе кровеносных сосудов светятся хорошо очерченная эндотелиальная выстилка и наружная оболочка. В просвете сосудов были расположены эритроциты, то есть сосуды были функциональны (рис. 6).
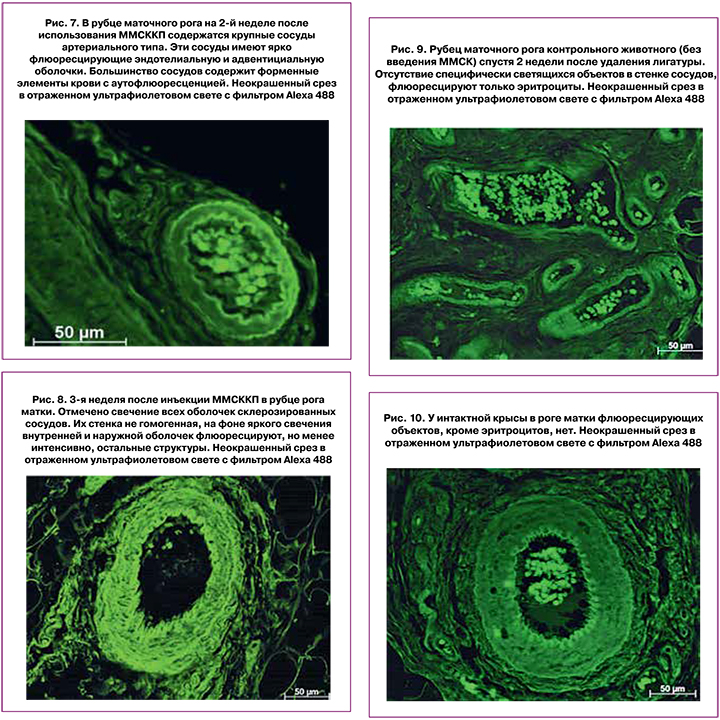
Через 2 недели после использования ММСККП было обнаружено множество сосудов различного диаметра с флюоресцирующими клеточными элементами и структурами в сосудистой стенке. Из светящихся клеток были построены целиком сосудистые стенки или их отдельные элементы. Большинство сосудов содержали разный объем форменных элементов крови, что свидетельствует об их полноценности и активном функционировании (рис. 7).
В то же время максимальное количество сосудов со светящимися стенками формировалось к 3-й неделе после введения ММСККП. Такие сосуды присутствовали в рубце, окружающей клетчатке и в тканях матки. Однако интенсивность флюоресценции заметно уменьшалась, что свидетельствовало об уменьшении интенсивности свечения и эндотелия и адвентиция (рис. 8).
В то же время сосуды, которые сначала были построены полностью или частично из введенных ММСККП, а затем из собственных клеток организма, остаются в тканях матки.
Таким образом, улучшается кровоснабжение атрофичных и склерозированных тканей рубца и создается возможность для его реорганизации. В литературе уже было отмечено, что в результате улучшения микроциркуляции в рубце может произойти омоложение коллагеновых и эластиновых волокон с появлением более тонких структур и упорядочиванием их расположения [16, 19].
На основании этого был сделан вывод, что стволовые клетки, введенные в рубец на матке, формируют кровеносные сосуды за счет их дифференцировки в клетки сосудистых оболочек. Экспрессия гена GFP не только в эндотелии сосудов, но и в их адвентиции, указывает на дифференцирование введенных ММСК как в эндотелиальном, так и в перицитарном направлениях.
Что касается группы контроля и интактных животных, то были получены следующие результаты. В контроле на все сроки эксперимента (животные с гидрометрой без применения ММСККП) и у интактных крыс в тканях матки и рубца было отмечено свечение только эритроцитов в многочисленных сосудах (рис. 9, 10).
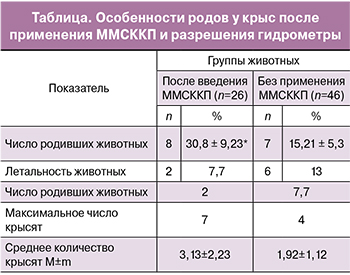
После инъекций ММСККП родили 8 из 26 (30,8%) животных, в контрольной группе без применения клеточных технологий – 7 из 46 (15,2%), различие достоверно (таблица).
Животные после применения ММСККП начали рожать раньше крыс без использования клеточных технологий. Первое животное родило 9 января 2013 года, второе – 11 января, третье – 14 и четвертое – 16 января, тогда как в контрольной группе первые роды были отмечены только 16 января. То есть после инъекции ММСККП крысы начали рожать на 7 дней раньше, чем в группе сравнения. С учетом длительности эстрального цикла у крыс в 4 дня [20] можно заключить, что у этих животных беременность наступает (восстанавливается проходимость маточных рогов) после введения ММСККП на 7 дней или 2 эстральных цикла раньше, чем у таких же крыс без введения клеток.
Количество крысят после применения ММСККП составило в среднем 3,13±2,23, максимально 7 новорожденных, тогда как без использования клеточных технологий средняя численность потомства была равна 1,92±1,12, а максимальное число крысят не было больше 4. Возможно, что в результате использования ММСККП и более быстрой регенерации структуры маточных рогов более часто восстанавливается проходимость обоих рогов, с 2 сторон. Вследствие этого беременность протекает во всех рогах матки и численность новорожденных больше.
В группе с применением ММСККП за время наблюдения в течение 10 недель с момента подсаживания самцов погибли 2 из 26 (7,7%) крыс, в группе сравнения без использования клеток – 6 из 46 (13,04%) животных, но при этом различие оказалось недостоверным.
Меньшая летальность животных после введения ММСК является хорошим результатом и указывает как на более быстрое восстановление просвета рога матки, так и на большую прочность оставшихся рубцовых тканей, способных выдержать полноценную родовую деятельность.
Заключение
После инъекции в рубец матки ММСК с трансфицированным геном GFP в нем возрастает число сосудов, образованных de novo с участием введенных клеток. Из светящихся ММСК были построены целиком сосудистые стенки или их отдельные элементы. Такие сосуды присутствовали в рубце, окружающей клетчатке и в тканях матки. После применения ММСК животные начали рожать на 2 эстральных цикла раньше, процент родивших крыс в этой группе был выше, у них было больше как общее количество потомства, так и максимальное число крысят. Летальность животных в этой группе, наоборот, была меньше. Таким образом, после использования ММСК имеется статистически достоверное, практически двукратное увеличение числа родивших животных и уверенная тенденция к ускорению репаративных процессов в матке крыс при рубцовом сужении ее просвета. В этой связи можно надеяться, что экспериментальное применение клеточных технологий открывает новые горизонты улучшения репарации рубца миометрия и в ближайшем будущем позволит акушерам-гинекологам вводить ММСК. Такая методика вселяет надежду на снижение частоты последующего кесарева сечения.



