Ежегодно в России регистрируют 26–36 млн случаев инфекций мочевыводящих путей (МВП). Чаще всего они развиваются в возрасте от 25 до 30 лет, а также у женщин старше 55 лет, в постменопаузальном периоде. Особенностью воспалительных заболеваний МВП является тенденция к их рецидивирующему течению: так, по данным литературы, обострение цистита в течение 6 месяцев после возникновения первичного эпизода возникает примерно у ⅓ пациентов, а у 10% оно переходит в хроническую рецидивирующую форму. Именно рецидивирующий характер хронического цистита (ХЦ) существенно ухудшает качество жизни пациенток и увеличивает количество случаев временной нетрудоспособности, что обусловливает социально-экономическую значимость данного заболевания [1–3].
Основным этиологическим фактором ХЦ является бактериальная флора влагалища. Наиболее часто у женщин встречается восходящий путь проникновения инфекции в мочевой пузырь, значительно реже – гематогенный, лимфогенный и нисходящий.
В патогенезе рецидивирующего цистита ключевую роль играют механизмы врожденного иммунитета слизистых оболочек и системный иммунитет.
Слизистая оболочка, выстилающая нижние отделы мочевыводящих путей (уротелий), – это один из важнейших факторов резистентности, представленный защитным слоем, обладающим значительной фагоцитарной активностью и способностью к синтезу и секреции специфических мукополисахаридов [4]. Слизистая оболочка мочевого пузыря также обладает бактериостатическими свойствами, антиадгезивным действием, вырабатывает секреторный IgA и ингибиторы роста бактерий. Стоит отметить и защитные физико-химические свойства мочи – низкое значение pH и высокую концентрацию мочевины при неизмененной уродинамике [5].
Несостоятельность врожденного иммунитета слизистых оболочек МВП приводит к активации инфекции и развитию острого воспаления, при котором отмечаются вазодилатация, повышение проницаемости сосудистой стенки, хемотаксис лейкоцитов в первичный очаг и запуск каскада биохимических реакций с участием цитокинов: гистамина, кининов, факторов системы комплемента, оксида азота, протеазы и т.д. [6–8].
Отмечено, что инфекционно-воспалительный процесс в уротелии вызывает усиление синтеза провоспалительных цитокинов (IL-1, IL-6) и, напротив, – снижение противовоспалительных цитокинов (IL-4, TGF, ИФН-γ). Не менее важная роль в патогенезе цистита принадлежит тучным клеткам, которые усиленно мигрируют в очаг воспаления и продуцируют фактор некроза опухоли альфа (TNFα), замыкая, таким образом, «circulus vitiosus» между повреждением эпителия и высвобождением провоспалительных цитокинов [9, 10].
Длительный инфекционно-воспалительный процесс в стенке мочевого пузыря может приводить к развитию гипоксии и ишемии уротелия с последующим нарушением проницаемости слизистой мочевого пузыря. Кроме того, бактериальная флора часто представлена резистентными микроорганизмами к проводимой антибактериальной терапии, что приводит к неэффективности традиционных методов лечения [11]. Таким образом, все эти процессы обусловливают хроническое рецидивирующее течение цистита.
В связи с этим поиск эффективных комплексных методов лечения рецидивирующего ХЦ является актуальной проблемой современной урогинекологии.
Цель исследования – оценить эффективность комплексного лечения пациенток с рецидивирующим ХЦ с использованием локальной цитокинотерапии (Суперлимф) в сочетании с антибактериальной терапией.
Материалы и методы
Проведено проспективное рандомизированное клиническое исследование в параллельных группах на базе отделения эстетической гинекологии и реабилитации ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России среди женщин с рецидивирующим ХЦ.
Критерии включения: 1. возраст женщин от 18 до 50 лет; 2. диагноз: хронический рецидивирующий неосложненный цистит, при появлении острого приступа, сопровождающегося двумя или более симптомами (боли в нижнем отделе живота при мочеиспускании, учащенное мочеиспускание, ложные позывы, недержание мочи, чувство неполного опорожнения мочевого пузыря, жжение при мочеиспускании), лейкоцитурией (количество лейкоцитов более 5 в поле зрения) по данным общего анализа мочи; 3. два эпизода в течение последних 6 месяцев или три эпизода в течение 1 года, 4. подписанное добровольное информированное согласие на участие пациентки в клиническом исследовании; 5. отрицательный результат теста на беременность и согласие на использование механической барьерной контрацепции (презерватив) на протяжении всего исследования; 6. готовность пациентки соблюдать все условия Протокола исследования.
Критерии исключения: 1. анатомо-функциональные нарушения мочевых путей в анамнезе и/или по данным ультразвукового исследования (гидронефроз, цистоцеле, опущение матки, парауретральная киста); 2. непереносимость или повышенная индивидуальная чувствительность к любому компоненту исследуемого препарата (в том числе повышенная чувствительность к белкам свиного происхождения); 3. дефицит сахарозы/изомальтозы, непереносимость фруктозы, глюкозо-галактозная мальабсорбция по данным анамнеза; 4. хроническая болезнь почек в анамнезе (в том числе по данным скорости клубочковой фильтрации); 5. температура тела выше 38 °С; 6. тяжелое органическое поражение печени (в том числе повышение аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ) или щелочной фосфатазы (ЩФ) более чем в 3 раза относительно верхней границы нормы или повышение общего билирубина более чем в 2 раза относительно верхней границы нормы либо развитие желтухи); 7. любые заболевания желудочно-кишечного тракта в фазе обострения; 8. локальные проявления инфекции половых органов, выявление возбудителей инфекций, передающихся половым путем (ИППП); 9. беременность и период лактации; 10. применение Суперлимфа в анамнезе без достижения терапевтического эффекта.
В исследование были включены 60 женщин, средний возраст которых составил 34,7±15,7 года. После периода скрининга пациентки были рандомизированы в две группы в соотношении 1:1 – с применением комплексной терапии (30 женщин, получающих антибактериальную терапию + Суперлимф) и монотерапии (30 женщин, получающих антибактериальную терапию). Контрольную группу составили 10 здоровых женщин (средний возраст 29,8±9,3 года). В ходе исследования были исключены 2 пациентки в связи с наступлением беременности.
Препарат Суперлимф представляет собой стандартизированный комплекс цитокинов, среди которых продемонстрирована активность интерлейкинов (ИЛ-1, -2, -6), фактора некроза опухоли альфа (ФНОα), фактора, ингибирующего миграцию фагоцитов (МИФ), трансформирующего фактора роста (ТФРр). Пациентки 1-й группы применяли Суперлимф ректально по 1 суппозиторию (25 ЕД) 1 раз в сутки 10 дней на 1-м и 3-м визитах. Общая продолжительность терапии составила 20 суток. В качестве антибактериального препарата в обеих группах использовался фосфомицина трометамол (Монурал) 3 г, однократно на ночь.
Исследование включало в себя 4 запланированных визита и состояло из следующих этапов: скрининга, терапии и наблюдения. Также Протоколом были предусмотрены незапланированные визиты и визит досрочного завершения исследования (при рецидиве заболевания). 1-й визит – 0–1–2-й дни исследования; 2-й визит – 11-й день после начала терапии ± 1 день; 3-й визит – 40-й день после окончания терапии ± 7 дней; 4-й визит – 90-й день после окончания терапии ± 7 дней.
Каждый визит включал в себя сбор жалоб, анамнеза, физикальное обследование, общий анализ мочи, бактериологическое исследование мочи с определением чувствительности к антибиотикам, исследование мазка из уретры и цервикального канала методом полимеразной цепной реакции (ПЦР) для выявления возбудителей ИППП, УЗИ мочевого пузыря и почек, исследование микробиоты уретры, цервикального канала, заднего свода влагалища, зева и носа.
Также каждая пациентка в течение всего исследования заполняла дневник мочеиспусканий, во время 1-го и 4-го визитов – шкалу симптомов острого цистита (ACSS, Приложение № 1 – доступно на сайте журнала, см. ссылку в начале статьи).
При статистическом анализе использовали русифицированную версию Statistica 13.3, рассчитывали среднее значение и среднеквадратическое отклонение (M±S). Для сравнения средних величин были использованы непараметрические методы: тест Уайта (был проведен вручную при помощи калькулятора и таблиц значений F).
Результаты и обсуждение
Основные клинико-анамнестические показатели на момент включения в исследование представлены в таблице.
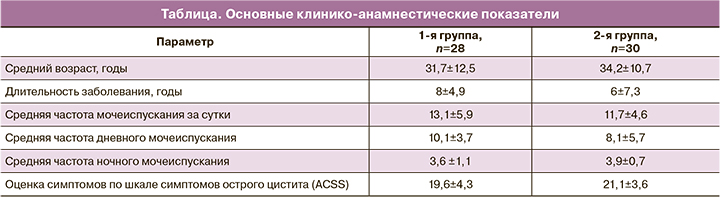
Дизурические расстройства (болезненное, учащенное мочеиспускание, жжение и др.) отмечены у всех пациенток, включенных в исследование. При анализе дневников мочеиспусканий было выявлено, что средняя частота мочеиспускания за сутки составила 12,8±5,3, дневного мочеиспускания – 9,6±4,5, ночного мочеиспускания – 3,5±0,9. При этом ургентные позывы на мочеиспускание зарегистрированы у 57 (95,0%) пациенток, а у 3 (5,0%) отмечено ургентное недержание мочи.
Все пациентки были опрошены с помощью анкет «Шкала симптомов острого цистита» (The Acute Cystitis Symptom Score, ACSS), которые представлены в Приложениях № 1, 2 (доступно на сайте журнала, см. ссылку в начале статьи). Она позволяет оценить не только степень выраженности симптомов, но и проанализировать динамику изменения состояния пациента и эффективность лечения. Этот опросник состоит из 18 вопросов, которые разделены на четыре категории: 1) вопросы о характерных симптомах (1–5); 2) вопросы для дифференциального диагноза (7–10); 3) вопросы о качестве жизни (11–13); 4) дополнительные вопросы об основном заболевании (14–18). Пороговым значением считается 6 баллов, которое имеет чувствительность 91,2% и специфичность 86,5% в отношении прогнозирования острого цистита. Результаты анкетирования во время 1-го и 4-го визитов представлены на рисунке.

Как видно на рисунке, пациентки 1-й группы, получавшие комплексное лечение (антибактериальная терапия + Суперлимф), отмечали статистически значимое снижение клинической симптоматики и повышение качества жизни в сравнении с 2-й группой, находящейся на монотерапии (р<0,001). Так, сумма баллов «классических» признаков (неприятные ощущения при мочеиспускании) в 1-й группе уменьшилась в 3,5 раза, во 2-й группе – в 1,7 раза, отличительных (боль в поясничной области, гнойные выделения, высокая температура) – в 5,1 и 1,9, дополнительных – в 2,1 и 1,3, а качество жизни улучшилось в 3,6 и 1,4 раза соответственно.
Для оценки микробиоценоза до (1-й визит) и после проведения терапии (4-й визит) была проведена ПЦР-диагностика мазков цервикального канала, заднего свода влагалища, бактериологический посев мазка из зева и носа, уретры. Микрофлора главным образом была представлена факультативно-анаэробными (аэробными) микроорганизмами (Enterobacteriaceae, Staphylococcus spp., Streptococcus spp.) и облигатно-анаэробными микроорганизмами (Eubacterium spp., Clostridium, Mobiluncus spp., Corynebacterium, Peptostreptococcus spp. и др.). По данным проведенного исследования, после терапии в 1-й группе значительно уменьшилась доля патогенной и условно-патогенной микрофлоры по сравнению с исходными данными (р<0,001).
В ходе исследования 2 пациентки выбыли во время 3-го визита в связи с наступлением беременности на фоне применения препарата Суперлимф. Пациентки имели в анамнезе хронический эндометрит, на фоне которого у 1 – 1 выкидыш, у 1 – 2 выкидыша, что было подтверждено данными анамнеза, микроскопии мазков из влагалища, шейки матки и уретры, посевов на условно-патогенную флору и ПЦР-исследованиями отделяемого из цервикального канала и полости матки, трансвагинального УЗИ органов малого таза, гистологического исследования соскоба из полости матки. Согласно данным литературы, невынашивание беременности сопровождается не моноинфекцией, а сочетанной урогенитальной инфекцией в субклинической форме. Одним из ключевых моментов в патогенезе считают дисбаланс в системе цитокинов. Повышение продукции провоспалительных цитокинов приводит к неполноценности имплантации. Избыточное отложение циркулирующих комплексов в тканях приводит к иммунопатологическим процессам, которые вызывают нарушения в микроциркуляторном русле. Применение препарата Суперлимф приводит к снижению уровня провоспалительных цитокинов и тем самым создает благоприятные условия для имплантации плодного яйца [12].
Стоит отметить, что в 1-й группе (Суперлимф + Монурал) длительность безрецидивного периода составляла в среднем на 40,5±19,7 дня больше в сравнении с 2-й группой (Монурал).
Применение иммунотропного препарата Суперлимф в комплексном лечении показало статистически значимо более высокую эффективность в сравнении с монотерапией. Благодаря стимуляции функциональной активности клеток фагоцитарного ряда (моноцитов и нейтрофилов), активации фагоцитоза, выработки цитокинов (ИЛ-1, ФНО), он индуцирует противоопухолевую цитотоксичность макрофагов, способствует гибели внутриклеточных микроорганизмов, регулирует миграцию клеток в очаг воспаления, увеличивает активность естественных киллеров, стимулирует регенерацию и эпителизацию раневых дефектов.
Заключение
Полученные результаты исследования показывают, что включение в комплексное лечение хронического рецидивирующего цистита препарата Суперлимф позволяет повысить эффективность лечения в 2,6 раза, удлиняет ремиссию между обострениями в среднем на 30,3±5,9 дня и достоверно улучшает качество жизни пациенток.



