Патологический климактерий является одной из значимых медико-социальных проблем современности. Частота развития климактерического синдрома (КС) у женщин в хирургической менопаузе достигает 70–90% [1] и не имеет отчетливой тенденции к снижению. При этом у 26% женщин наблюдается умеренное и у 60% тяжелое течение КС, появляются соматические и психические заболевания, что существенно ухудшает качество жизни (КЖ) пациенток [1] и в 25% случаев приводит к стойкому нарушению трудоспособности [2]. Гормональная менопаузальная терапия (ГМТ) – золотой стандарт лечения симптомов КС [3]. Однако имеется ряд абсолютных и относительных противопоказаний, ограничивающих назначение ГМТ [4, 5]. Приверженность к ГМТ часто неудовлетворительна [6]. В связи с этим поиск альтернативных средств коррекции КС, не задействованных в механизмах активации ядерного эстрогенового сигналинга, остается актуальным. Одним из перспективных растительных средств представляется Серелис – биологически активная пищевая добавка, содержащая стандартизированный высокоочищенный экстракт цитоплазмы пыльцы растений в сочетании с витамином-антиоксидантом D-альфа-токоферола ацетатом (витамин Е). Спектр фармакологических эффектов Серелиса достаточно широк, в частности нейропротекторный, вегетонормализующий, антиоксидантный, противотревожный и антидепрессивный. Нейротропный эффект Серелиса связан с регулированием синтеза и метаболизма серотонина и дофамина [7]. Его эффективность продемонстрирована во многих клинических исследованиях как в отношении редукции вазомоторных, так и психосоматических симптомов у женщин менопаузального периода [7–10]. Эффекты Серелиса сопоставимы с действием селективных ингибиторов обратного захвата серотонина (СИОЗС). При этом Серелис не влияет, в отличие от СИОЗС, на активность CYP2D6 и, следовательно, может без ограничений применяться у женщин, получающих тамоксифен в качестве терапии рака молочной железы [11]. Антиоксидантное действие Серелиса связано с усилением активности фермента NADR-оксидоредуктазы (NQO1) [6]. При этом важны и его дополнительные анксиолитический и антидепрессивный эффекты, так как у 83% женщин в менопаузе регистрируются коморбидные тревожно-депрессивные расстройства [12]. Препарат обладает также стресспротективной активностью.
В экспериментальных [13] и клинических [14] исследованиях представлены научно обоснованные указания на высокий профиль переносимости и безопасности Серелиса.
Однако, несмотря на наличие результатов исследований, свидетельствующих о высокой клинической эффективности Серелиса в лечении КС у женщин в естественной менопаузе, в доступной нам литературе мы не встретили работ о влиянии данного средства на клинические проявления КС у женщин в хирургической менопаузе.
Цель исследования: изучение эффективности препарата «Серелис» при лечении КС у женщин в хирургической менопаузе.
Материалы и методы
Проведено рандомизированное слепое плацебо-контролируемое, с одинаковым соотношением распределения в параллельных группах клиническое исследование. Исследование одобрено ответственным этическим комитетом, спланировано и проведено в соответствии с Хельсинкской декларацией. Методом сплошной выборки обследовано 129 женщин в возрасте от 45 до 58 лет, находившихся в хирургической менопаузе (>12 месяцев от момента последней менструации) c проявлениями КС, обратившихся к врачу-гинекологу в рамках специализированного приема по проблемам климактерия АО «Медицина» и ФГБУ МФК Минфина России, Москва. Из общей выборки были отобраны 92 пациентки с КС (средний возраст – 53,2 (49,1–57,3) года), удовлетворяющих критериям включения/невключения, которые составили группу рандомизации.
Критерии включения пациенток в исследование: возраст от 45 до 58 лет лет; хирургическая менопауза; симптомы КС легкой, средней или тяжелой степени (значение модифицированного менопаузального индекса (ММИ) Куппермана–Уваровой >11 баллов); наличие противопоказаний к приему гормональных средств или отказ от их приема; письменное информированное согласие на участие в исследовании.
Критерии исключения пациенток: естественная или медикаментозная менопауза; наличие клинически значимых изменений при гинекологическом осмотре и инструментально-лабораторном обследовании на этапе скрининга; индекс массы тела >30 кг/м2; тяжелые или декомпенсированные сопутствующие соматические заболевания; гематологические и онкологические заболевания; двигательные и поведенческие расстройства; наличие в анамнезе психической патологии и/или данных о приеме антипсихотических средств; прием гормономодулирующих или альтернативных препаратов для коррекции КС в предшествующие 8 недель до начала исследования; наличие противопоказаний к назначению Серелиса; отказ пациентки от участия в исследовании.
Рандомизация в две группы (с равным соотношением) выполнялась независимым статистиком с использованием программного обеспечения для рандомизации. В 1-ю группу вошли 45 пациенток, получавших ННС «Серелис» (Natumin Pharma AB, Швеция/Serelys Pharma S.A.M., Монако, регистрационное удостоверение Минздрава России
№ RU.77.99.32.003.Е.003755.08.16 от 25.08.2016 г.) по 1 таблетке 2 раза в день (рекомендованная производителем суточная доза). В данной группе исследование завершили все 45 пациенток. Во 2-ю группу вошли 47 пациенток, которые получали идентичные по размеру, цвету и вкусу таблетки плацебо, по 1 таблетке 2 раза в день. В данной группе исследование завершили 45 пациенток; выбыли вследствие нарушения протокола – 2 пациентки. Длительность приема ННС «Серелис» и плацебо составила 12 недель.
Общая продолжительность исследования составила 36 недель. Контрольными точками оценки результатов лечения были: стартовый визит – 0-й день, в фазе лечения – 12-я неделя, в фазе последующего наблюдения – 36-я неделя.
Критериями эффективности лечения являлись динамика числа пациенток с изменением степени тяжести КС по данным шкалы ММИ [15]; динамика частоты и выраженности симптомов КС по данным шкалы ММИ; динамика выраженности тревожно-депрессивных расстройств по данным шкалы HADS (Hospital Anxiety and Depression Scale) [16]; динамика оценки КЖ по данным опросника WHQ (Womens Health Questionnaire) [17].
Критериями оценки переносимости лечения являлись регистрация и подсчет частоты нежелательных явлений, зафиксированных в фазе лечения и последующего наблюдения.
Статистический анализ
Статистическая обработка полученных данных была выполнена с помощью пакета прикладных программ STATISTICA 8.0 (StatSoft.Inc., USA). Оценка нормальности распределения проводилась при помощи критерия Шапиро–Уилка. Описание количественных данных представлено в виде медианы и интерквартильного размаха в случае непараметрического распределения и в виде среднего и стандартного отклонения в случае нормального распределения. Сравнение количественных признаков между группами было проведено с использованием критерия Манна–Уитни при непараметрическом распределении и при помощи теста Стьюдента при нормальном распределении. Качественные данные представлены в виде абсолютных и относительных (в %) показателей. Значимость различий между группами по качественным признакам оценивалась на основании критерия χ2. Различия считали значимыми при значениях р<0,05.
Результаты
Группы пациенток были сопоставимы по основным клинико-демографическим показателям (табл. 1). В обеих группах всем пациенткам выполнена гистерэктомия матки с придатками, преобладали пациентки с длительностью постменопаузы более 1,5 года, преимущественно с умеренной степенью тяжести КС. При этом имели место высокая распространенность тревожно-депрессивных расстройств и значительное снижение уровня КЖ.
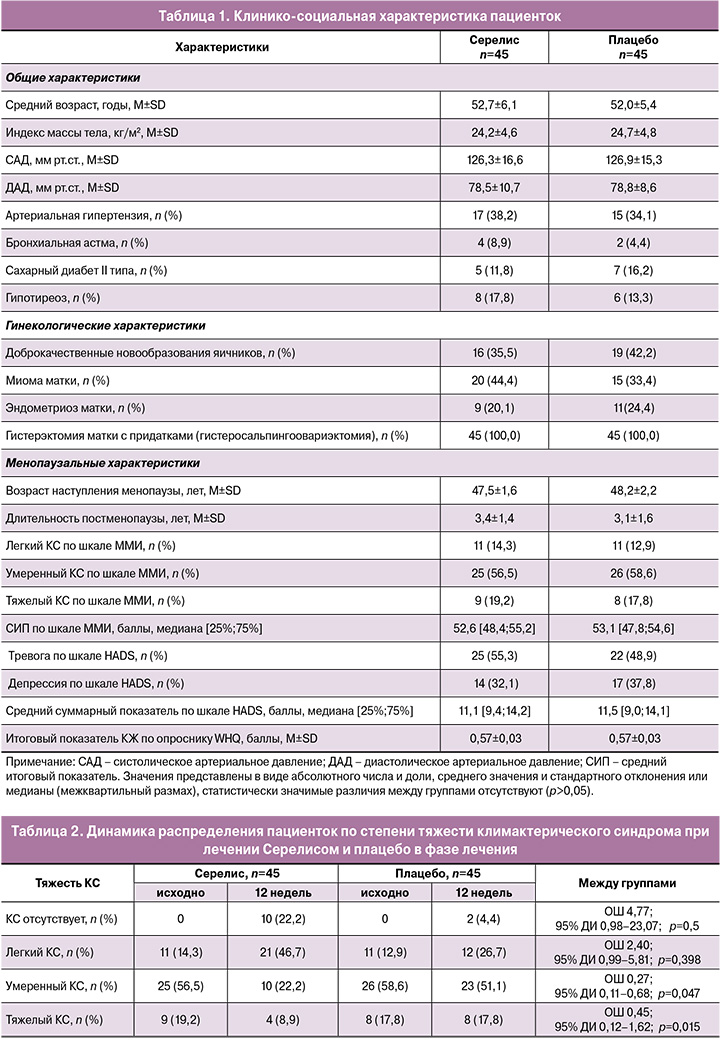
Первичным показателем эффективности являлось число пациенток, отреагировавших на лечение Серелисом, что проявлялось в изменении степени тяжести симптомов КС по шкале ММИ. Динамика распределения пациенток по степени тяжести КС при лечении Серелисом и плацебо в фазе лечения представлена в таблице 2. К моменту окончания лечения число пациенток, у которых отмечалось снижение степени тяжести симптомов КС в группе лечения Серелисом, составило 40/45 (88,9%), в группе плацебо – лишь 9/45 (20%) Различия между группами оказались статистически значимыми (ОШ 32,0; 95% ДИ 9,8–104,3; p<0,001).В группе Серелиса снижение среднего значения по подшкале нейровегетативных симптомов шкалы ММИ превысило 12 баллов, психоэмоциональных симптомов – 8 баллов и было статистически значимым (p=0,018 и p=0,017 соответственно), в то время как в группе плацебо изменения были минимальными и статистически незначимыми (рис. 1, 2).
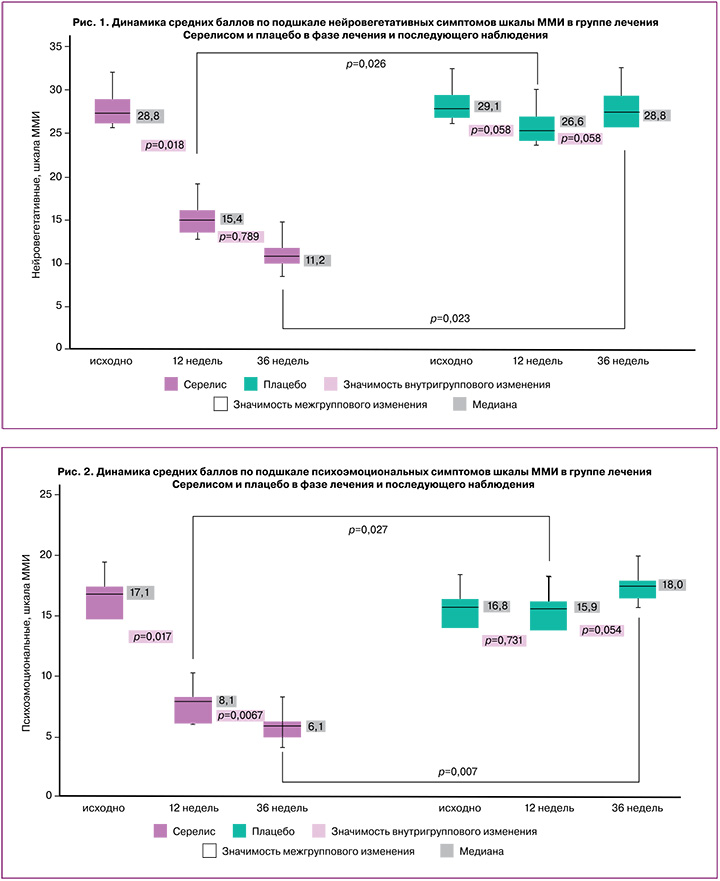
К моменту окончания лечения в группе Серелиса имело место статистически значимое снижение частоты таких симптомов КС, как приступы сердцебиения, зябкость и ознобы, ночная потливость, повышенная возбудимость и сонливость, нарушения сна, приливы жара, снижение работоспособности, раздражительность и плаксивость, расстройства аппетита, депрессивное настроение, навязчивые мысли, нарушения полового влечения (табл. 3).
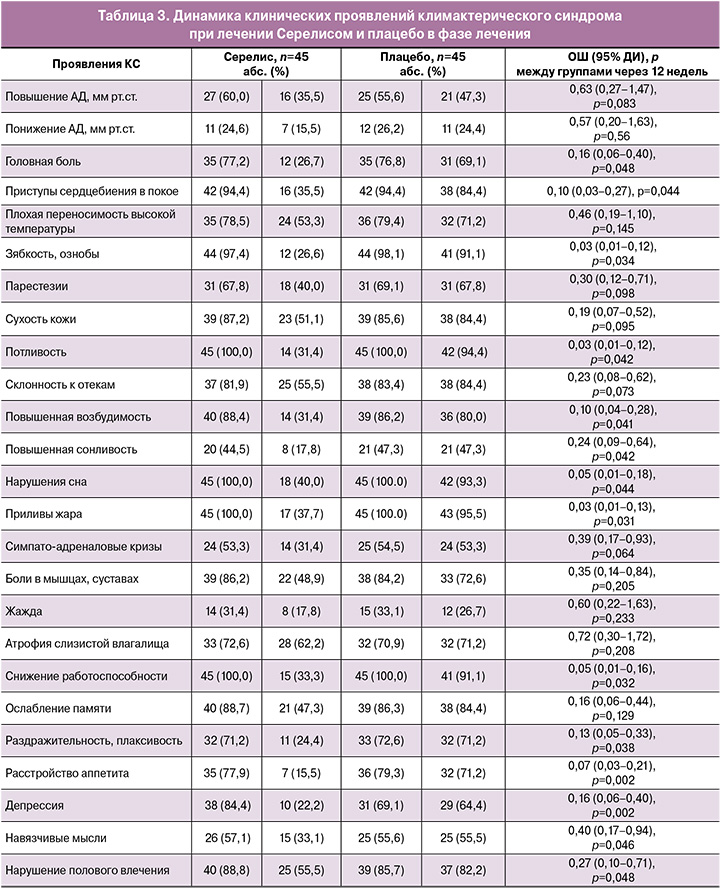
Средние баллы по подшкале обменно-эндокринных симптомов шкалы ММИ снизились незначимо в обеих группах (рис. 3).
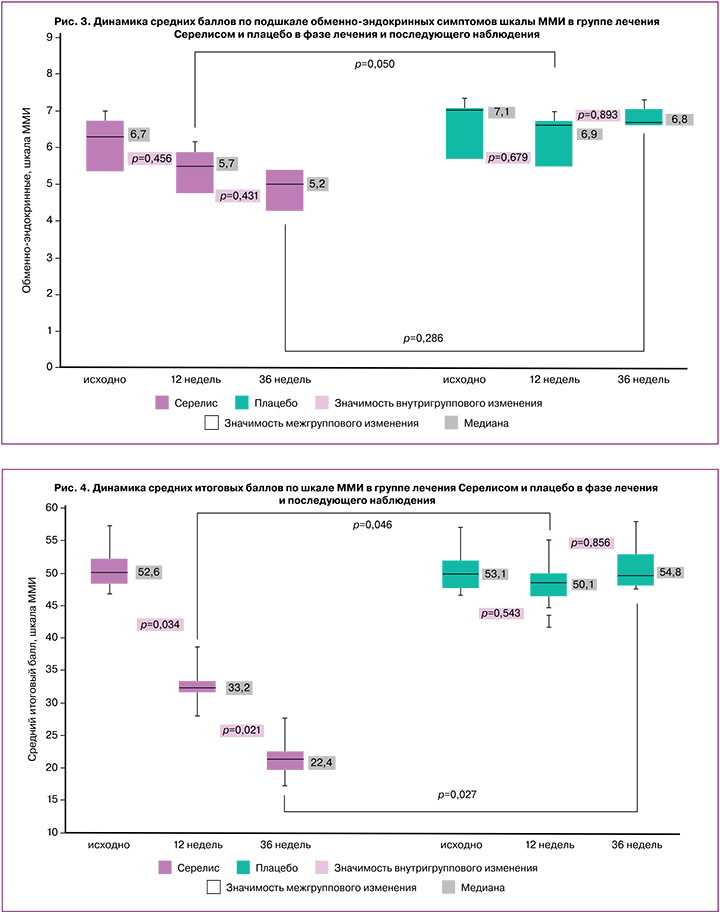
На рисунке 4 представлена динамика средних итоговых баллов по шкале ММИ в обеих группах пациенток в фазе лечения и последующего наблюдения.
К моменту окончания лечения в группе Серелиса медиана среднего итогового балла по ММИ снизилась с 52,6 до 33,2 балла (p=0,034), т.е. с умеренной до легкой степени тяжести КС. В группе плацебо отмечалось снижение среднего итогового балла по ММИ, но различия оказались статистически незначимыми (p=0,543). К моменту окончания лечения различия между группами достигали уровня статистической значимости (p=0,046).
В фазе последующего наблюдения в течение 12 недель в группе Серелиса отмечалось дальнейшее заметное, хотя и не достигавшее статистической значимости снижение среднего балла по подшкале нейровегетативных симптомов шкалы ММИ более чем на 4 балла и статистически значимое снижение среднего значения по подшкале психоэмоциональных симптомов шкалы ММИ более чем на 2 балла относительно значений, зафиксированных непосредственно после завершения лечения (p=0,789 и p=0,007 соответственно). В группе плацебо изменения были статистически незначимыми. Медиана среднего итогового балла по ММИ в группе Серелиса снизилась до 22,4 балла (p=0,021) и была значимо ниже по сравнению с группой плацебо (p=0,027).
Далее была проанализирована динамика психоэмоционального статуса в группах пациенток по шкале HADS в фазе лечения и в фазе последующего наблюдения (рис. 5).
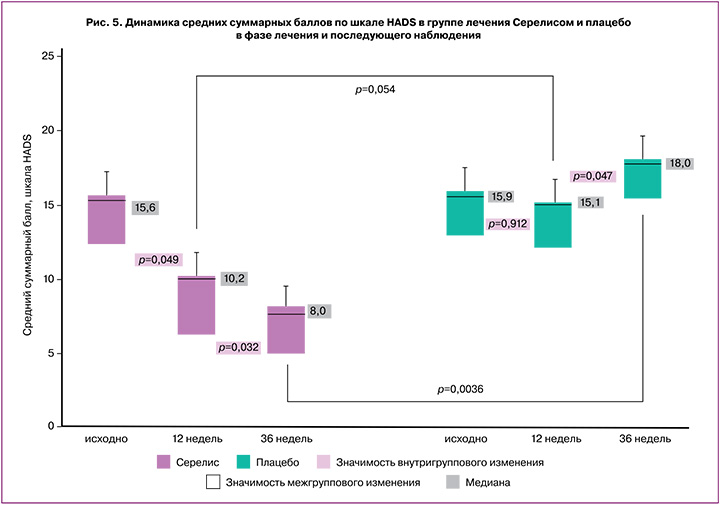
К моменту окончания лечения в группе Серелиса средний суммарный балл по шкале HADS статистически значимо снизился с 15,6 [12,4;18,2] до 10,2 [6,4;11,2] балла (p=0,049). В группе плацебо изменение среднего суммарного балла по шкале HADS в точках оценки эффективности лечения были статистически незначимы: 0-я неделя – 15,9 [13,0;17,7]; 12-я неделя – 15,7 [13,2;17,5] балла (p=0,912). Различия между группами были статистически значимыми (p=0,048). В фазе последующего наблюдения в группе Серелиса было отмечено дальнейшее статистически значимое снижение среднего суммарного балла по шкале HADS по сравнению с показателем, зафиксированным через 12 недель лечения (p=0,032). В группе плацебо наблюдалось ухудшение психоэмоционального статуса: снижение среднего суммарного балла по шкале HADS превысило 2 балла (p=0,032). Различия между группами достигали уровня статистической значимости (p=0,047).
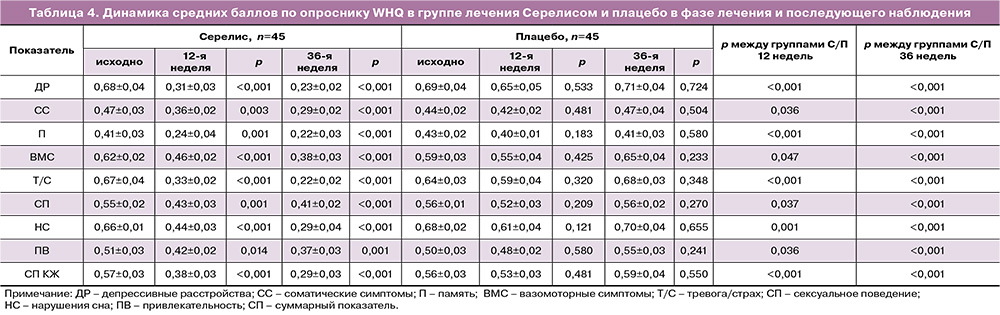
В таблице 4 представлена динамика средних баллов по опроснику WHQ в обеих группах пациенток в фазе лечения и последующего наблюдения. Как показано в таблице 4, к моменту окончания лечения в группе Серелиса имело место существенное улучшение КЖ – баллы по всем шкалам опросника WHQ были статистически значимо (p<0,05) ниже по сравнению с группой плацебо. Снижение среднего суммарного балла по опроснику WHQ достигло 33,3%, а в группе плацебо – лишь 5,3% (p<0,001). В фазе последующего наблюдения в группе Серелиса отмечалось дальнейшее статистически значимое снижение средних баллов по шкалам «депрессивные расстройства» (p<0,001), «соматические симптомы» (p<0,001), «вазомоторные симптомы» (p<0,001) и «тревога/страх» (p<0,001) относительно значений, зафиксированных через 12 недель лечения. Средний итоговый показатель по опроснику WHQ составил 0,29±0,03 балла против 0,59±0,04 балла в группе плацебо (p<0,001).
За время лечения и последующего наблюдения в течение 36 недель в группе Серелиса не было зарегистрировано ни одного нежелательного явления.
Обсуждение
Известно, что остро возникшее эстрогендефицитное состояние при хирургической менопаузе провоцирует нарушение многообразных нейроэндокринных взаимосвязей в системе «гипоталамус–гипофиз–кора надпочечников–щитовидная железа» [18], что обусловливает срыв механизмов адаптации и возникновение комплекса вазомоторных, психосоматических и поведенческих симптомов. При этом в возникновении КС ключевую роль среди компонентов нейрональной (или нейроэндокринной) регуляции отводят серотонинергической, гамма-аминомасляной/(ГАМК)-ергической, дофаминергической, норадренергической, холинергической системам [19]. Серелис характеризуется мощным нейротропным эффектом и антиоксидантной активностью. В частности, благодаря присутствию в экстракте цитоплазмы пыльцы триптофана – предшественника серотонина (около 0,09 мг/таблетка) [20], Серелис ингибирует обратный захват серотонина, увеличивая доступность серотонина в серотонинергических нейронах гипоталамуса, тем самым способствуя нормализации терморегуляции, сна и настроения [7]. Повышая экспрессию дофаминовых рецепторов D2 (DRD2) [7], Серелис блокирует метаболические пути разрушения дофамина. В результате происходят ослабление выраженности недостаточности дофаминергической нейротрансмиссии и, как следствие, модуляция нейроэндокринного сигналинга. Серелис также индуцирует активность NQO1 [6], который, как известно, поглощая супероксид, защищает от окислительного стресса, вызванного различными цитотоксическими веществами. Наличие в экстракте пыльцы фермента супероксиддисмутазы, обладающего выраженными антиоксидантными свойствами, способствует инактивации радикалов кислорода.
Эффективность Серелиса при лечении КС у женщин в естественной менопаузе продемонстрирована в ряде клинических исследований. В открытом проспективном исследовании Elia D. et al. [8] с участием 417 женщин в менопаузальном периоде, принимавших Серелис на протяжении 12 недель, установлено снижение частоты приливов жара на 65% (интенсивности – на 64%), потливости – на 66% (интенсивности – на 67%), раздражительности – на 54% и усталости – на 51% [9]. В проспективном обсервационном исследовании Fait T. et al. [9] показано, что у женщин в менопаузе применение Серелиса в течение 12 недель способствовало снижению выраженности приливов жара на 48,5%, нарушений сна – на 50,1%, раздражительности – на 47,9% и утомляемости – на 47,8%. В рандомизированном двойном слепом плацебо-контролируемом исследовании приняли участие 64 женщины в менопаузе, принимавшие Серелис [9]. Через 12 недель лечения были выявлены значимые различия в отношении частоты и выраженности приливов жара, головной боли, головокружения, усталости, настроения, либидо, у женщин на фоне приема Серелиса по сравнению с плацебо. Позитивная динамика указанных параметров позволила повысить КЖ у 71,9% пациенток более чем на 53%. В ходе открытого многоцентрового исследования, выполненного Elia D. et al. [8], с участием 417 женщин в менопаузе, принимавших Серелис на протяжении 12 недель, установлено, что после завершения терапии снижение частоты и интенсивности приливов жара наблюдалось у 85,6% пациенток. Наряду с этим 93% пациенток оценили результат терапии как «очень хороший» и «достаточно хороший» и лишь 2,5% – как «неудовлетворительный» [8].
В настоящем исследовании мы оценили динамику частоты климактерических симптомов и нежелательных явлений при использовании ННС «Серелис» с целью коррекции КС у женщин в хирургической менопаузе. Полученные нами результаты продемонстрировали поливалентность биологического действия ННС «Серелис», что подтверждалось позитивным влиянием как на комплекс соматических, так и нейропсихических симптомов КС.
Согласно данным современных исследователей, гинекологическое оперативное вмешательство как фактор риска психоэмоциональных расстройств после овариэктомии и/или гистерэктомии обусловливает развитие тревоги и депрессии у 83% женщин [15]. В нашем исследовании 87,4% пациенток имели психоэмоциональные расстройства тревожно-депрессивного спектра. Поэтому, кроме основных терапевтических факторов, которые определяют показания к применению Серелиса при КС, важны и его дополнительные анксиолитические и антидепрессивные эффекты. Обращает на себя внимание, что даже через 24 недели после отмены ННС «Серелис» отмечалась тенденция к дальнейшему снижению среднего суммарного балла по шкале HADS (-более 1 балла), в то время как в группе плацебо имелась направленность к увеличению (+более 2 баллов) относительно значения, зафиксированного непосредственно после лечения. Учитывая значимую роль тревожно-депрессивных расстройств в усугублении течения КС, развитии различной сердечно-сосудистой патологии и ухудшении КЖ пациенток [21], выявленное положительное влияние ННС «Серелис» на психоэмоциональный статус пациенток в хирургической менопаузе является значимым результатом.
Основная задача лечения КС – достижение оптимального уровня КЖ пациенток. Поэтому одним из существенных результатов настоящего исследования является подтверждение выраженного положительного влияния ННС «Серелис» на КЖ по сравнению с плацебо. Мы не выявили нежелательных явлений при приеме Серелиса, что свидетельствует о хорошей его переносимости.
Заключение
Таким образом, наши результаты показали, что прием ННС «Серелис» позволяет достичь значительного снижения выраженности нейровегетативных и психоэмоциональных симптомов, нивелировать расстройства тревожно-депрессивного спектра и значительно улучшить качество жизни.



