Рак яичников (РЯ) занимает одно из ведущих мест среди всех онкологических заболеваний женской половой сферы. Ежегодно в мире регистрируется более 225 тысяч новых случаев РЯ, из которых более половины приводят к летальному исходу [1]. Согласно статистике, в России в 2012 году зарегистрировано 12 935 случаев заболевания РЯ, из них 7789 (60,2%) пациенток умерло от данного вида злокачественной опухоли [2]. По данным American Cancer Society, в 2015 году в США заболело РЯ 21 986 женщин, что в 14 270 случаях привело к смерти пациенток [3, 4].
Наибольшее число случаев заболевания РЯ наблюдается у пациенток в возрастном диапазоне от 45 до 75 лет, при этом максимальное число заболевших наблюдается в возрасте 58,1 года. Пик заболеваемости приходится на возраст 65–69 лет. На протяжении жизни женщины риск заболеваемости РЯ составляет 1,13% [4–6].
В России ежегодно РЯ диагностируется более чем у 11 000 женщин (10,17 на 100 000), из них запущенные стадии процесса (III–IV) составляют 70–80%. За последние 10 лет показатель заболеваемости увеличился на 10,2% [2, 3].
Несмотря на многочисленные исследования, лечение больных РЯ является крайне сложной и актуальной проблемой.
Продолжительность жизни пациенток с данным заболеванием напрямую зависит от стадии процесса; при этом 5-летняя выживаемость больных с I стадией составляет 53–80%, II – 30–40%, III – 7–20%, IV – менее 10% [4]. По статистическим данным Европейского онкологического регистра, вне зависимости от стадии процесса, выживаемость в течение 1 года составляет 63%, 3-летняя – 41%, 5-летняя – 35% [4].
Основными причинами неблагоприятного прогноза при РЯ являются его крайне быстрое и агрессивное клиническое течение, раннее метастазирование (как лимфогенное, так и гематогенное), а также преимущественно высокая степень злокачественности опухолевого процесса. Согласно статистическим данным, большинство злокачественных опухолей яичников по гистологическому строению относятся к эпителиальным опухолям (70–80%) [4, 7].
Частота встречаемости серозной аденокарциномы составляет 42%, муцинозной аденокарциномы – 12%, эндометриоидной карциномы – 15%, недифференцированной карциномы – 17%; наиболее редкий вариант – светлоклеточная карцинома встречается в 6% случаев [1, 8]. Помимо гистологического строения на прогноз заболевания большое влияние оказывает степень клеточной дифференцировки, обуславливающая степень ее злокачественности. Так, наиболее благоприятным вариантом является G1 – высоко дифференцированная, промежуточный показатель характерен для G2 – умеренно дифференцированная; G3 – низкодифференцированная опухоль является наименее перспективным вариантом по прогнозу курабельности [4, 9].
В последнее время выделяют два варианта течения РЯ – тип I и тип II. К опухолям I типа относят менее агрессивные опухоли: высоко дифференцированные (серозные, муцинозные, эндометриоидные, светлоклеточные) карциномы и злокачественную опухоль Бренера. Опухоли II типа являются высоко злокачественными, низкодифференцированными, характеризуются быстрым ростом и агрессивным течением злокачественного процесса. К ним относят серозные, эндометриоидные карциномы, злокачественные смешанные мезонефроидные опухоли и недифференцированные карциномы [3, 9].
За последние десятилетия выработаны стандарты лечения больных РЯ, базирующиеся на результатах множества всесторонних исследований и проведенных мета-анализов. В основу тактики ведения пациенток с РЯ положено сочетание хирургического и химиотерапевтического воздействий, что позволяет достигать максимальной курабельности, особенно при распространенных стадиях процесса.
По данным большинства авторов, преимущество неоадьювантной химиотерапии у пациенток с III–IV стадиями РЯ заключается в повышении резектабельности опухоли за счет ее частичной регрессии; уменьшение или полное исчезновение отдельных метастатических поражений, позволяет в последующем интраоперационно оценить чувствительность опухоли к подобранной схеме лечения с целью прогнозирования течения заболевания. Предоперационное проведение химиотерапии положительно влияет на общее состояние пациентки, снижая выраженность асцита и плеврита, позволяет улучшить качество жизни.
За последние 30 лет накоплен большой опыт в применении химиотерапии в качестве одного из основных звеньев комплексного лечения РЯ. При генерализованных формах (III–IV стадии) РЯ перед выполнением циторедуктивной операции показано проведение 2–3 курсов химиотерапии по стандартной схеме 1-ой линии (таксол, карбоплатин) [4, 7]. Препараты химиотерапии обладают множеством побочных эффектов, одним и которых является негативное воздействие на процессы гемопоэза. Оказывая воздействие преимущественно на пролиферирующие клетки костного мозга, противоопухолевые препараты способны подавлять все разновидности листков кроветворения [7, 10]. Наиболее выражено угнетение гранулоцитарного и тромбоцитарного ростков, в меньшей степени токсическое воздействие наблюдается в отношении эритроцитарного ростка. Наибольший миелосупрессивный эффект наблюдается в первые 2 недели после ведения химиопрепарата, однако в ряде случаев возможны отсроченные реакции до 3–6 недель. Развивающаяся в данных условиях нейтропения, приводит к риску развития инфекционных осложнений. Тромбоцитопения приводит к развитию геморрагического диатеза [7]. Повышенная кровоточивость цитостатического генеза обусловлена не только глубиной тромбоцитопении, но и ее продолжительностью. Особенно важную роль данное осложнение играет при проведении оперативного вмешательства с максимальной циторедукцией в ближайшие сроки после нескольких курсов неоадъювантной химиотерапии [7, 10]. В результате тромбоцитопении хирург сталкивается с выраженной диффузной кровоточивостью тканей, увеличивающей объем интраоперационной кровопотери, что на фоне цитотоксической анемии является крайне неблагоприятным осложнением.
Таким образом, развивающаяся на фоне химиотерапии повышенная кровоточивость требует своевременной коррекции гемостатическими препаратами с целью снижения рисков послеоперационных осложнений.
Одним из современных, широко применяемых гемостатических препаратов группы ингибиторов фибринолиза является амбен (аминометилбензойная кислота). Амбен обладает антифибринолитическими свойствами, препятствующими растворению сгустков крови, по своему механизму действия близок к аминокапроновой кислоте, однако намного более активен. Основным свойством является угнетение фибринолиза за счет конкурентного торможения плазминоген активирующего фактора и подавления процессов образования плазмина. Благодаря конкурентному насыщению лизин-связывающих рецепторов аминометилбензойная кислота блокирует связывание плазминогена с фибриногеном. Одним из свойств препарата является способность ингибировать биогенные полипептиды-кинины. Амбен нашел широкое применение в терапии капиллярных, профузных и паренхиматозных кровотечений различной этиологии ввиду высокой эффективности и безопасности, а также оптимально удобной формы введения (как внутривенной, так и внутримышечной). При этом максимальная концентрация создается сразу после введения и поддерживается в течение 3 часов, что особенно актуально для проведения интраоперационной профилактики геморрагических осложнений.
Материал и методы исследования
В наше исследование было включено 25 пациенток с морфологически верифицированным РЯ распространенных стадий процесса (III–IV), проходящих лечение в ГКБ № 40 г. Москвы за период с 2014 по 2015 г. С целью верификации диагноза всем больным была выполнена биопсия метастатических очагов брюшины с последующим гистологическим исследованием.
Критерием включения пациенток в исследование являлось наличие серозного, эндометриоидного, мезонефроидного РЯ высокой степени злокачественности III–IV стадии, после 3 курсов неоадъювантной химиотерапии с последующим проведением циторедуктивной операции. Средний возраст обследованных женщин составил 61±5,7 года. Пациентки были отобраны с учетом идентичности антропометрических данных и общего соматического статуса.
В ходе исследования пациентки были разделены на 2 группы: основная (n=13) – больные, которым интраоперационно внутривенно вводили амбен в дозе 2 единицы (10 мл) из расчета 10 мг/мл с целью снижения кровопотери, и группа сравнения (n=12), которым была выполнена циторедуктивная операция без прикрытия гемостатическими препаратами.
Сравнивали величину кровопотери и показатели гемопоэза в обеих группах.
Результаты исследования
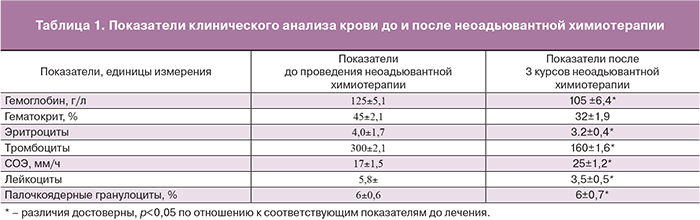
В предоперационном периоде для оценки показателей гемопоэза было выполнено клинико-лабораторное обследование (клинический анализ крови, активированное частичное тромбопластиновое время (АЧТВ), международное нормализованное отношение (МНО), фибриноген, Д-димер) (табл. 1, 2).
Как видно из табл. 1, у пациенток после 3 курсов неоадъювантной химиотерапии наблюдались клинико-лабораторные изменения, характерные для угнетения гемопоэза. Что касается показателей свертывающей системы, статистически значимой разницы до и после неоадьювантной терапии выявлено не было (табл. 2).
В ходе выполнения циторедуктивной операции у пациенток получавших амбен, наблюдался значительно меньший объем кровопотери по сравнению с группой женщин без гемостатической терапии. У пациенток первой группы она составила 80±12 мл, в то время как в группе сравнения данные показатели достигали 550±11 мл, что усугубляло тяжесть цитостатической анемии и осложняло течение послеоперационного периода.
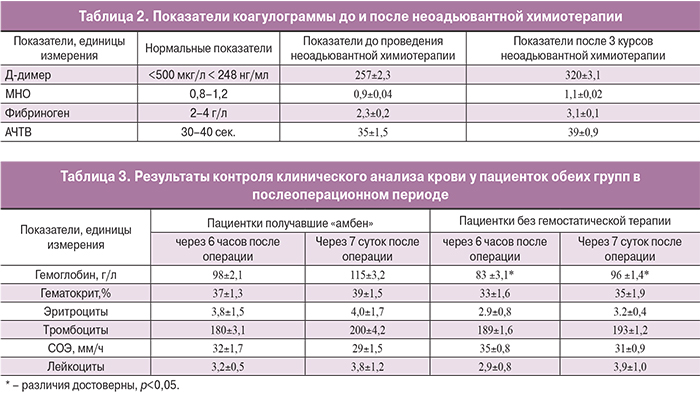
Через 12 часов и через 7 суток после оперативного лечения нами не было выявлено статистически значимых различий по основным показателям клинического анализа крови и коагулограммы у пациенток на фоне применения амбена и без него (табл. 3). Однако было зарегистрировано достоверно большее снижение показателей гемоглобина в послеоперационном периоде у пациенток, не получавших во время циторедуктивной операции гемостатической терапии, по сравнению с больными, которым был введен амбен, что является следствием повышенной интраоперационной кровопотери у пациенток группы сравнения.
Заключение
Таким образом, в ходе проведенного исследования нами получены достоверные результаты, свидетельствующие об эффективности однократного интраоперационного применения ингибитора фибринолиза амбен в дозе 100 мг с целью снижения кровопотери у больных распространенным РЯ после проведенной неоадъювантной химиотерапии. Благодаря гемостатическим свойствам лекарственного препарата амбен удается избежать развития анемии, что значительно улучшает течение послеоперационного периода.



