Ключевой задачей современного акушерства является антенатальная охрана плода, которая
тесно связана с проблемой снижения перинатальной заболеваемости и смертности, при этом
одной из основных причин их развития является плацентарная недостаточность (ПН), имеющая
мультифакторную природу [1—4].
В основе данного синдрома лежат патологические изменения в пладово- и/или маточно-плацентарном комплексах с нарушением компенсаторно-приспособительных механизмов на молекулярном, клеточном и тканевом уровнях. При этом нарушаются транспортная, трофическая, эндокринная, метаболическая, антитоксическая функции плаценты, лежащие в основе патологии плода и новорожденного |4—7].
Терапия ПН должна начинаться с воздействия на ведущие патогенетические механизмы, вызывающие нарушения функции и структуры плаценты. Стандартной схемы терапии хронической ПН, по-видимому, существовать не может вследствие многочисленных сочетаний этиологических
факторов. При этом подбор препаратов следует проводить индивидуально в каждом конкретном
случае с учетом степени тяжести и длительности течения ПН [5, 8, 9].
Тяжелые последствия ПН для новорожденного делают необходимым поиск новых современных
средств лечения. Многокомпонентное медикаментозное лечение беременных с ПН нередко обусловливает ряд вторичных патологических реакций в обшей системе "мать-плацента-плод", в том числе вследствие порой непомерной "фармакологической нагрузки" на развивающийся организм ребенка [10, 11]. В связи с этим вопрос об оптимальной терапии матери остается нерешенным. В последнее время передовые позиции в клинике стали занимать экстракорпоральные методы терапии. Одним из наиболее часто используемых в клинике методов является плазмаферез (ПА). Благодаря огромному спектру различных эффектов. таких как детоксикация, реокоррекция и снижение гиперкоагуляционного потенциала крови, иммунокоррекция. улучшение показателей кинетики кислородного метаболизма и тканевого дыхания, стимуляция эндокринной системы, повышение чувствительности к эндогенным и медикаментозным веществам, данный метод нашел широкое применение в клинической практике, в частности и для лечения ПН [12; 13]. Другим, не менее эффективным и безопасным методом является озонотерапия, при сочетанием применении усиливающая положительные эффекты плазмафереза [14-17].
Целью исследования явилась оптимизация комплексной терапии ПН с использованием сочетанного
применения плазмафереза и медицинского озона.
Материал п методы исследовании
Проведен анализ течения беременности, родов, послеродового периода, состояния плодов и ново-
рожденных у 127 женщин с хронической ПН.
Критериями отбора пациенток в группы исследования явились:
Срок беременности 24—35 нед; наличие хронической ПН, установленной при помощи: клинических данных и результатов УЗ И (УЗ-фетометрия — наличие задержки развития плода, изменения толщины и структуры плаценты, количества и качества околоплодных вод); параметров допплер о метрического исследования (нарушение фето- и/или маточно-плацентарного кровотока); данных кардиотокографии (наличие хронической внутриутробной гипоксии плода).
Относительными противопоказаниями для плазмафереза являются: анемия (Нb менее 90 г/л,
Ht менее 30%), гипопротеинемия (общий белок менее 60 г/л); для плазмафереза в сочетании с
озонотерапией: тромбоцитопения (тромбоциты менее 100x109/л), гипокоагуляция, аллергические
реакции на озон.
Группу 1 (основную) составили 58 беременных с ПН, в комплекс лечения которых были включены
сеансы плазмафереза и озонотерапия.
Группу 2 (сравнения) составили 69 женщин с ПН, которым проводили общепринятые методы
лечения.
Методика проведения плазмафереза. Пациентку укладывали на функциональную кровать.
Процедуру начинали с введения изотонического раствора натрия хлорида. Количество раствора,
вводимого до начала эксфузии крови, зависело от величины артериального давления, общего состояния женщины и колебалось от 100 до 400 мл. Эксфузию крови производили путем пункции локтевой вены в пластмассовые контейнеры «Гемакон 500/300*. После тщательного перемешивания кровь помещали в рефрижераторную центрифугу фирмы«Beckman-J6 MC» (США) и центрифугировали со скоростью 3800 об/мин при 1В СС в течение 6 мин. Плазму, отделившуюся от клеточной массы, удаляли с помощью плазмоэкстрактора. Оставшиеся клетки крови ресуспензировали в 150 мл изотонического раствора натрия хлорида и реинфузировали женщине. За один сеанс производили 1—2 забора крови в зависимости от состояния и массы тела пациентки, переносимости процедуры. Плазмоэксфузию производили в количестве 400—900 мл за сеанс. За курс проведения плазмафереза объем эксфузии плазмы составлял 800—1500 мл. Плазмозамещение осуществляли коллоидными, кристаллоидными препаратами гидрокcиэтилированного крахмала (инфукол, рефортан 6% или 10%) в соотношении 1:2. Курс лечения состоял из 3 сеансов плазмафереза с интервалом 2—3 дня в зависимости от объективных данных, характеризующих состояние пациентки, лабораторных показателей. Также в процессе терапии беременным группы 1 в комплексе с плазмаферезом проводили внутривенное капельное введение медицинского озона, который представляет собой озонокислсродную смесь, получаемую из сверхчистого кислорода путем его разложения в слабом электрическом разряде или посредством ультрафиолетового облучения. Проводили 5 процедур озонотерапии (сразу после сеанса плазмафереза, далее еще 2 процедуры через день) дозой 0,4 мг/л в 400.0 мл физиологического раствора внутривенно капельно.
Известно, что сосудисто-эндотелиальный (СЭФР) и плацентарный (ПФР) факторы роста регулируют рост и функцию сосудов плаценты. С одной стороны, они являются стимуляторами ангиогенеза и повышают проницаемость сосу до в внутри плацентарного ложа, с другой стороны, посредством аутокринного механизма регулируют инвазию, дифференцировку и метаболическую активность трофобласта в момент плацентации [2, 18]. В связи с этим эффективность лечения оценивали анализируя не только течение беременности, родов, состояние плодов и новорожденных, а также показатели данных факторов роста в сыворотке крови, которые определяли количественным иммуноферментным методом до и после терапии.
Кроме того, проводили морфологическое исследование последов (плаценты, плодных оболочек,
пуповины) у всех пациенток при помаши макроскопического, морфометрического и гистологического
методов.
Результаты исследования и обсуждение
Возраст пациенток колебался от 18 до 39 лет и составил в среднем 28,6± 1,3 года. Статистического
различия между возрастом беременных обеих групп выявлено не было. При этом наибольший
процент составили женщины возрастной группы 30—34 года, что можно объяснить наличием у них
в анамнезе сопутствующей экстрагенитальной патологии, хронических воспалительных заболеваний гениталий, длительного бесплодия, привычного невынашивания беременности. Анализ экстрагенитальной патологии показал, что частота перенесенных заболеваний верхних дыхательных путей, органов дыхания, сердечно-сосудистой, пищеварительной, моче вы делительной систем и оперативных вмешательств по группам достоверно не различалась.
В обеих группах с высокой частотой встречались такие гинекологические заболевания, как
эндометрит — у 13 (22,4%) пациенток группы I и 15 (21,7%) беременных группы 2 и эктопия шейки
матки — у 14 (24,1%) и 14 (20,3%) по группам соответственно. По поводу имеющегося бесплодия и/или эндометриоза, и/или миомы матки у 9 (15,5%) и 10 (14.5%) пациенток соответственно проводилось оперативное лечение.
Хронический сальпингоофорит и/или эндометрит имели характер вялотекущего процесса, трудно поддавались лечению, имели склонность к частому рецидивированию, по поводу чего проводилось тщательное обследование с выявлением возбудителей заболевания микробиологическими или моле куля р но-биологи чес ким и методами. При этом достоверных различий между группами пациенток выявлено не было.
При анализе репродуктивной функиии обследованных женщин выявлено, что частота самопроизвольных выкидышей или неразвивающихся беременностей (по группам соответственно 10 — 17,2% и 12 — 17,4%) и преждевременных родов (6—10,5% и 7—10,1%) была достоверно выше (p<0,05), чем в популяции, где частота ранних потерь составляет 10,1%, а преждевременных родов — 6.3% [2].
Характеризуя репродуктивную функиию пациенток, следует отметить, что в анамнезе у 10 (17,2%) пациенток группы 1, у 13 (17,4%) группы 2 предыдущая беременность осложнилась хронической ПН. внутриутробная инфекция отмечена в 2 (3,5%) и 3 (4,5%) случаях, преэклампсия — в 6 (10,5%) и 6 (8,7%) наблюдениях (по группам соответственно). Перинатальные потери отмечены в анамнезе у 1 (1,7%) пациентки группы 1 и у 1 (1,4%) группы 2.
Исходя из вышеизложенного, следует отметить, что пациентки обеих групп были сопоставимы по
клиническим характеристикам, а также по частоте и структуре экстрагенитальных заболеваний и
особенностям репродуктивного анамнеза.
Таким образом, комплексный анализ общей клинической характеристики женшин с хроничес-
кой ПН выявил следующие закономерности:
Таким образом, комплексный анализ общей клинической характеристики женщин с хронической ПН выявил следующие закономерности:
• высокую частоту заболеваний органов репродуктивной системы;
• длительное течение инфекционно-воспалительных заболеваний органов малого таза;
• отягощенный акушерский анамнез с высокой частотой осложненного течения беременности и репродуктивных потерь на различных сроках гестации.
Результаты научных исследований, проведенных в последние годы, выявили тесную взаимосвязь процессов ангиогенеза и активности факторов роста. Гипоксические состояния являются мощным стимулятором экспрессии факторов роста, а изменения продукции и активности факторов роста приводят к ПН в результате нарушения морфологии и функции плаценты. Сосудисто- эндотелиальный (СЭФР) и плацентарный (ПФР) факторы роста как эндогенные регуляторы ангиогенеза играют важную роль в развитии плацентарной ткани [2, 18]. Содержание ПФР в периферической крови является маркером внутриутробных процессов плацентации, становления и развития плацентарного кровообращения и функционирования фетоплацентарного комплекса.
C учетом вышеизложенного были определены уровни СЭФР и ПФР в сыворотке крови обследуемых пациенток на разных сроках гестации. Полученные данные представлены на рис. 1 и 2.
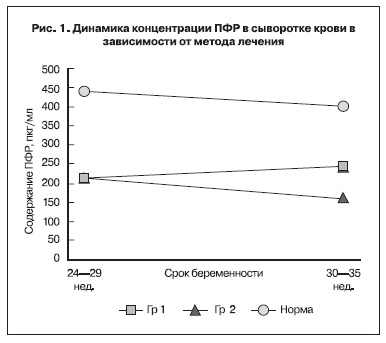
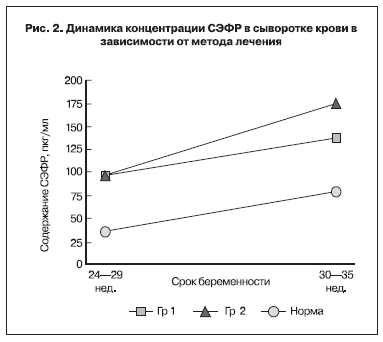
По мере прогрессирования неосложненной беременности уровень СЭФР возрастал на протяжении всего срока гестации, максимальными темпами – после 30 нед беременности, а уровень ФРП продолжал неуклонно расти и достигал своего пика к концу II триместра беременности.
Как видно из представленных данных, концентрации ПФР и СЭФР в сыворотке крови при обращении пациенток в сроках 24–29 нед гестации в обеих группах была сопоставима, однако в зависимости от метода лечения в сроках от 30–35 нед беременности достоверно отличались (р<0,05): в группе 2 концентрация ПФР была ниже в 1,7 раза, а концентрация СЭФР в 1,3 раза выше по сравнению с группой 1, что можно объяснить бóльшей эффективностью терапии в группе 1 с включением эфферентных методов лечения и озонотерапии. Как известно, у женщин с наличием ПН отмечается нарушение продукции ПФР с начала беременности, характеризующееся достоверно более низкими его показателями в течение всего периода беременности, отсутствием нарастания показателей в течении I–II триместров с максимумом значений к 30-й нед.
С целью верификации диагноза хронической ПН и оценки эффективности лечения было проведено морфологическое исследование последов пациенток, сравнительная характеристика которых представлена в таблице.
Таблица. Морфометрические параметры плаценты в зависимости от метода лечения.
В процессе исследования последов у всех пациенток исследуемых групп были выявлены патологические изменения, являющиеся морфологическими критериями хронической ПН.
При макроскопическом исследовании плацент показатели массы, объема и площади материнской поверхности плаценты, а также плодово-плацентарного индекса массы в группе 1 достоверно отличались от таковых в группе 2 (p<0,05). Также в группе 2 отмечалось достоверное увеличение содержания (p<0,05) плодового фибриноида и утолщение плацентарного барьера по сравнению с группой 1. Полученные данные свидетельствуют о бóльшей эффективности терапии с применением эфферентных методов.
Кроме того, мы проанализировали исходы беременности у пациенток, включенных в исследование. Достоверно чаще самопроизвольные роды были у женщин группы 1 (р<0,05), неблагоприятная ситуация в исходах беременности для плода чаще отмечалась у беременных группы 2, так как частота преждевременных родов у пациенток этой группы составила 30,4%, что более чем в 2 раза превышало данный показатель в группе 1 – 13,8% (р<0,05).
Наиболее часто встречающимся осложнением родового акта во всех группах явилось несвоевременное излитие околоплодных вод (20,1 и 27,5% соответственно), что, по-видимому, можно объяснить наличием инфекции у женщин, которая способствует разрыву плодного пузыря и преждевременному излитию вод.
По длительности родового акта и объему кровопотери достоверных различий по группам не выявлено. Общая продолжительность своевременных родов составила 10 ч 48 мин+1 ч 36 мин, преждевременных родов – 9 ч 12 мин+0 ч 38 мин. Средний объем кровопотери в родах составил 250,2+23,6 мл.
Обвитие пуповины вокруг шеи, туловища, ноги отмечалось с одинаковой частотой в обеих группах. Во всех случаях при осложнениях в III периоде родов (дефект или частичное плотное прикрепление плаценты, гипотоническое кровотечение) производилось ручное обследование стенок послеродовой матки.
Частота кесаревых сечений составила соответственно по группам 39,7 и 55,0% (р>0,05).
Экстренное кесарево сечение достоверно чаще (р<0,05) проводили в группе 2 (55,2%), чем в группе 1 (34,8%), причем достоверно чаще (р<0,05) показаниями к родоразрешению в группе 2 были острая гипоксия плода (21,7 против 12,1% в группе 1) и обострение генитального герпеса (8,7 против 3,5% в группе 1).
Одними из самых распространенных послеродовых осложнений являлись анемия и субинволюция матки. Обращает на себя внимание достоверно более высокая (р<0,05) частота развития эндометрита у 3 (4,3%) пациенток и анемии – у 19 (26,1%) родильниц группы 2 по сравнению с группой 1. Меньшую частоту эндометрита в группе 1 можно связать с бактерицидным воздействием ПА и медицинского озона на очаги инфекции. Кроме того, известно, что медицинский озон используется в лечении анемии, что привело к меньшей частоте ее развития в послеродовом периоде у родильниц группы 1.
Исход родов для плода, течение периода новорожденности были проанализированы у 127 (58 и 69 по группам соответственно) детей. Гестационный возраст к моменту рождения колебался от 32 до 40 нед беременности. Масса доношенных новорожденных колебалась от 2890 до 3850 г и составила в среднем 3445+122 г, недоношенных – от 1120 до 2340 г, в среднем – 1844+75 г. Массоростовые показатели новорожденных от матерей с ПН, пролеченных общепринятыми методами (группа 2), были достоверно ниже (р<0,05), чем в группе 1, что закономерно и обусловлено высокой частотой преждевременных родов, а также задержкой внутриутробного развития плода у беременных этой группы.
Перинатальное состояние новорожденных определяли на основании оценки состояния по шкале Апгар. Асфиксия различных степеней тяжести достоверно чаще (р<0,05) отмечалась в группе 2. Это закономерно и связано с высокой частотой преждевременных родов и вышеописанными изменениями, выявленными при проведении функциональных методов исследования, а также осложненным течением гестационного периода у данной группы пациенток. У основной массы новорожденных – 106 (67,5%), родившихся в срок гестации 38–40 нед, не отмечалось нарушений в течении раннего адаптационного периода. Отклонения же у доношенных детей отмечались в 51 (32,5%) случае. Они проявлялись в виде снижения двигательной активности, вялости, заторможенности, падении массы тела на 8% и медленном подъеме кривой ее нарастания, отпадении пуповины после 7-го дня и др. В целом все отклонения от нормы были умеренно выражены, что указывало на относительно удовлетворительное течение раннего адаптационного периода у доношенных новорожденных.
У всех детей, родившихся преждевременно, процессы адаптации были замедлены и характеризовались большей потерей массы тела (12–14% по отношению к первоначальной). Причем обнаруживалась четкая зависимость: чем меньше масса тела при рождении, тем больше процент ее потери. Падение массы тела было более длительным, а восстановление происходило в течение 2–3 нед. Данный факт достоверно чаще (р<0,05) встречался в группе 2, где было больше преждевременно рожденных детей.
Большое значение для оценки физического развития новорожденного имеют характеристики пропорциональности телосложения и состояние трофики. Было рассчитано соответствие массоростовых параметров по перцентильным оценочным таблицам с целью диагностики задержки развития плода. Задержка развития плода установлена у 12 (20,3%) детей группы 1 и у 25 (36,2%) группы 2 (р<0,05). Гипотрофия 3-й степени достоверно чаще (р<0,05) диагностирована у новорожденных группы 2 – в 5 (7,2%) случаях. Дефицит массы тела по отношению к росту в пределах 3–10 перцентилей оценочной таблицы установлен в 11 (15,9%) случаев в группе 2, что достоверно выше (р<0,05), чем в группе 1 – в 4 (6,9%). У новорожденных со средней степенью тяжести гипотрофии отмечено уменьшение толщины кожной складки в сочетании с трофическими нарушениями кожи и снижением тургора тканей. Первая степень задержки развития плода с показателями массы тела от 25 до 10 перцентилей выявлена у 10 (17,2%) новорожденных основной группы и у 18 (26,1%) детей группы сравнения (р<0,05).
Внутриутробное инфицирование плода и реализация инфекции достоверно чаще (р<0,05) отмечены у детей, рожденных матерями группы 2 – в 21 (30,4%) случае. Это свидетельствует о том, что у женщин группы сравнения беременность протекала в более неблагоприятных условиях для плода, что создавало реальные условия для внутриутробного инфицирования и реализации инфекции у новорожденного.
У новорожденных от матерей с хронической ПН на фоне общепринятых методов лечения достоверно чаще отмечались низкие массо-ростовые показатели и недоношенность; асфиксия различных степеней тяжести; дизадаптационные явления с длительным течением в раннем неонатальном периоде; задержка развития плода; реализация инфекции в неонатальном периоде.
Заключение
По результатам нашего исследования можно сделать вывод, что неблагоприятное течение беременности оказывает отрицательное влияние на адекватную продукцию и функционирование факторов роста. Выявлено значительное снижение концентрации ПФР и увеличение концентрации СЭФР у пациенток с традиционными методами терапии ПН, что можно объяснить бóльшей эффективностью терапии в основной группе женщин, которым проводились эфферентные методы лечения и озонотерапия.
Таким образом, полученные данные свидетельствуют о том, что включение в комплексную терапию ПН лечебного плазмафереза и озонотерапии высокоэффективно, приводит к благоприятному течению беременности и родов, а также улучшает прогноз для плода и новорожденного со снижением частоты развития дизадаптационных явлений и реализации инфекции в раннем неонатальном периоде.



