Современное акушерство стремится не только к значительному снижению показателей материнской и перинатальной смертности, но и к уменьшению перинатальной заболеваемости и инвалидизации детей, рожденных от матерей с низким индексом здоровья [1]. В настоящее время отмечена тенденция к росту экстрагенитальных заболеваний у беременных, в том числе хирургических, что оказывает негативное влияние на течение и исход гестационного процесса [1–4]. Литературные источники свидетельствуют о прогрессирующем увеличении в последние десятилетия заболеваемости острым панкреатитом (ОП) (от 200 до 800 на 1 млн населения в год), при этом доля женщин среди заболевших за этот период в России возросла на 30% [5]. Трудности диагностики и лечения ОП у беременных способствуют высокому риску развития акушерских осложнений [6]. Известно, что развитие данной патологии при беременности осложняется в 58% наблюдений преждевременными родами, что непосредственно отражается на показателях перинатальной заболеваемости и смертности [5, 7, 8].
По данным литературы показатель перинатальной смертности при сочетании беременности и ОП варьирует от 33,9 до 380‰ [5, 9–12].
В последние годы большое внимание уделялось вопросам диагностики и лечения хирургических заболеваний у беременных. В то же время существующие способы профилактики невынашивания беременности у данного контингента больных, основанные на применении спазмолитических, токолитических, гормональных препаратов и витаминов, не всегда способствуют позитивному эффекту и снижению репродуктивных потерь [13]. Предлагаемые способы профилактики носят симптоматический характер воздействия на течение беременности, что обусловлено недостаточностью знаний патогенетических особенностей функционирования системы «мать-плацента-плод» в условиях развития ОП и стресса, обусловленного болевым синдромом. Проведенными ранее исследованиями было доказано, что сочетание беременности с ОП сопровождается развитием синдрома эндогенной интоксикации, нарушениями коагуляционного потенциала крови, что непосредственно оказывает влияние на течение и исход гестационного процесса [14, 15]. В связи с этим актуальными остаются вопросы дальнейшего изучения клинико-патогенетических особенностей фетоплацентарной системы и течения беременности в сочетании с острыми хирургическими заболеваниями для повышения качества оказания медицинской помощи данной категории больных.
Цель исследования: снизить частоту перинатальных потерь у беременных с ОП путем оптимизации лечебно-профилактических мероприятий.
Материал и методы исследования
Под нашим наблюдением находились 127 беременных с диагнозом: острый панкреатит (ОП), получавших лечение в условиях хирургического и реанимационного отделений ГУЗ Саратовская городская клиническая больница № 1 им. Ю.Я. Гордеева г. Саратов за период с 1992 по 2014 гг. Основную группу составили 43 беременные, которым в комплекс лечебно-профилактических мероприятий дополнительно были включены: дискретный плазмаферез на 1-е и 3-и сутки от момента госпитализации и начала терапии, микронизированный прогестерон 200 мг в сутки интравагинально (патент на изобретение № 2535108 от 08.10.2014 г.) [16]. В группе сравнения (n=84) назначалась стандартная терапия ОП. В контрольную группу (n=30) были включены практически здоровые беременные, сопоставимые по срокам гестации с пациентками основной группы и группы сравнения.
Критериями включения в основную группу и группу сравнения были отечная форма ОП в сочетании с беременностью, срок гестации от 4 до 37 недель. Критериями исключения из обследования в обеих группах стали клинические и лабораторные признаки панкреонекроза; органная недостаточность; врожденные тромбофилии; наличие злокачественных или предраковых заболеваний.
Всем пациенткам проводилось общее клинико-лабораторное обследование в соответствии со стандартами обследования беременных, поступающих в стационар. Для изучения особенностей функционирования системы «мать-плацента-плод» с позиции стресса в условиях острой хирургической патологии и оценки эффективности лечебных мероприятий нами проводился комплекс лабораторных исследований. Концентрацию пролактина (ПР), эстрадиола (Э), дегидроэпиандростерона сульфата (ДЭАС) в сыворотке крови беременных определяли методом иммуноферментного анализа с использованием коммерческих наборов фирмы «Био-Рад». Для определения содержания в крови прогестерона (П), кортизола (К) использовались коммерческие наборы фирмы «Алкор-Био» (РФ). Изучение уровней трофобластического β1-гликопротеина (ТБГ) и плацентоспецифического α1-микроглобулина (ПАМГ-1) проводили с использованием наборов фирмы «Диагностика» (РФ). Учет результатов иммуноферментного определения гормонов и гравидарных белков проводили на фотометре «Униплан» (фирма «Пикон», РФ). При поступлении и в динамике всем беременным выполнялось комплексное ультразвуковое исследование (УЗИ) с допплерометрией на аппарате HITACHI–5500 с применением широкополосных, сверхвысокоплотных конвексных датчиков 3,5–5,0 МГц и полостных датчиков 5,0–7,5 МГц. Обследование включало проведение двухмерной эхографии органов малого таза и брюшной полости, спектральной допплерографии в режиме цветного допплеровского картирования и энергетической допплерографии с определением допплеровских кривых скоростей кровотока в сосудах. Морфологический анализ плацент проводили по стандартизированной схеме (А.П. Милованов, 1999).
Статистическая обработка результатов исследования проведена с помощью пакета прикладных программ Excel MS Office Professional и Statistiсa 6.0, c выведением М+m, процентов, логарифмических средних (x) с 95% доверительным интервалом и достоверностью различий по t-критерию Стьюдента и точного критерия Фишера (Р).
Результаты исследования и их обсуждение
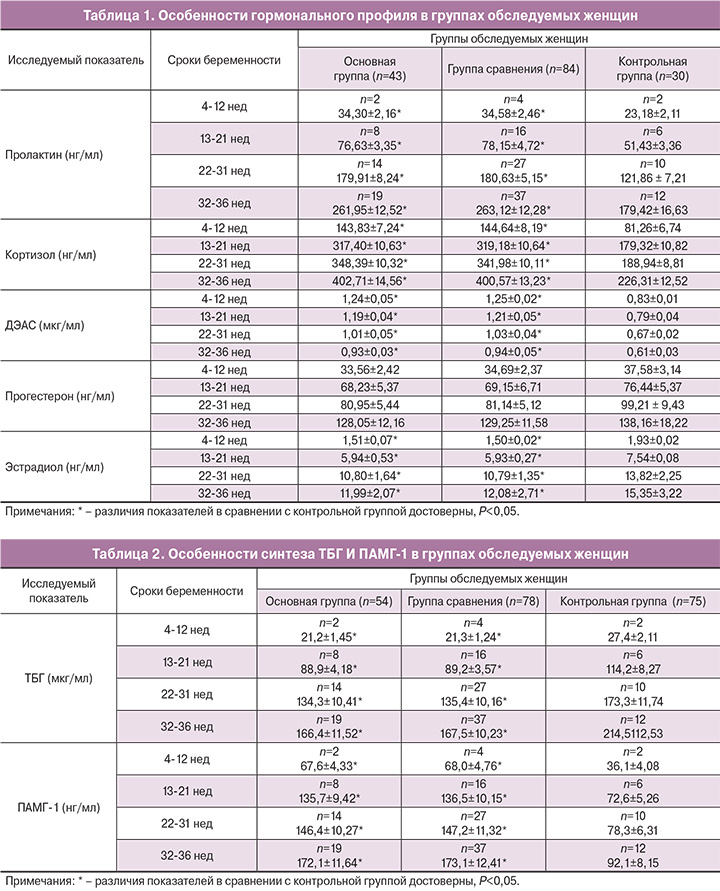
Возраст беременных варьировал от 22 до 35 лет, средний возраст в группах не имел значимых различий (Р>0,05). Срок гестации при поступлении беременных в стационар находился в пределах 4–37 недель, при этом частота возникновения ОП возрастала прямо пропорционально сроку беременности (рис. 1). Во второй половине беременности диагноз панкреатита устанавливался в 7–10 раз чаще по сравнению с первым триместром беременности. Распределение частоты встречаемости ОП у женщин с учетом срока беременности совпадало с мнением многих исследователей [1, 7, 9, 11, 17, 18, 19].
Мы впервые провели анализ динамики стрессорных гормонов у беременных с ОП. В качестве стрессорных гормонов были выбраны ПР, К и ДЭАС. Установлено, что сочетание беременности и ОП сопровождается достоверным увеличением содержания ПР, превышающего нормативные значения в 1,5 раза (табл. 1).
Проведенными ранее исследованиями была доказана немаловажная роль ПР в прогрессировании и невынашивании беременности [20, 21]. Аналогичная ситуация прослежена при определении содержания К и ДЭАС в сыворотке крови беременных с ОП (табл. 1). Концентрация К во все изучаемые сроки гестации увеличивалась в 1,8 раза, а уровень ДЭАС – в 1,5 раза по отношению к показателям контрольной группы. По нашему мнению, значительное возрастание ПР, общего К и ДЭАС является ответной реакцией гипофизарно-надпочечниковых структур организма женщины в ответ на болевой синдром и стресс, обусловленных развитием ОП.
Совершенно иная динамика отмечена при исследовании стероидных гормонов Э и П (табл. 1). При сочетании беременности и ОП исходно было установлено незначительное уменьшение содержания в сыворотке крови П, но достоверное снижение Э (в 1,3 раза) по отношению к контрольной группе. Снижение П и Э у беременных с ОП может быть обусловлено нарушением синтеза гормонов в плаценте ввиду формирования плацентарной дисфункции, что подтверждается разнонаправленными изменениями в синтезе специфических протеинов ТБГ и ПАМГ-1.
Результаты исследования белков «зоны беременности» при сочетании ОП и беременности во все сроки гестации показали достоверное снижение (в 1,3 раза) концентрации ТБГ по отношению к контрольной группе (табл. 2).
В то же время при исследовании специфического маркера материнской части плаценты ПАМГ-1 констатировано достоверное увеличение его содержания в сыворотке крови беременных с ОП (в 1,9 раза) при всех сроках гестации в сравнении с аналогичными данными здоровых беременных (табл. 2).
Проведение комплексного УЗИ при поступлении беременных с ОП позволило исключить акушерскую патологию по данным фето- и плацентометрии. Размеры эмбриона/плода соответствовали сроку гестации по аменорее, задержки роста плода и маркеров хромосомных аномалий развития плода не было выявлено ни в одном случае. Значимых различий по частоте локализации трофобласта/плаценты не обнаружено. Однако при измерении толщины плаценты обращали на себя внимание достоверное увеличение ее толщины во всех случаях и неоднородность структуры плацентарной ткани в 51,2% наблюдений. Кроме того, развитие ОП при беременности сопровождалось значимыми изменениями качественных параметров маточной гемодинамики: систоло-диастолическое отношение (СДО) возрастало и в правой, и в левой маточных артериях в 1,3 раза, пульсационный индекс (ПИ) – в 1,4 раза и индекс резистентности (ИР) – в 1,3 раза, что свидетельствует о нарушении маточно-плацентарного кровотока при данной патологии (табл. 3).
Динамическое исследование гормонального профиля у беременных с ОП выявило резкое снижение уровня стрессорного гормона ПР на 4–5-е сутки (в 1,9 раза) по отношению к исходными данными, при проведении лечебных мероприятий по стандартной схеме (группа сравнения). В то же время содержание общего К и ДЭАС в динамике несколько увеличивалось и оставалось достоверно выше контрольных значений. Повышение сывороточных концентраций общего К (в 2 раза) и ДЭАС (в 1,6–1,7 раза) относительно показателей при физиологической беременности можно объяснить возрастанием фетальных кортикостероидов в условиях прогрессирования плацентарной недостаточности при ОП и гипоксии плода. Повышение уровней К и ДЭАС на 7–10-е сутки совпадало со снижением концентрации П (в 1,6 раза) и увеличением содержания Э в сыворотке крови беременных (в 1,7 раза), что сопровождалось появлением клинических и ультразвуковых симптомов угрожающего прерывания беременности у 83,3% женщин. Полученные данные согласуются с мнением ряда авторов, отметивших определенную роль ПР в инициации сократительной деятельности матки [1, 20–22].
По мнению J.E. Tyson и соавт. (1985), плацентарный ПР ингибирует сокращения матки путем подавления продукции простагландина Е2 [23].
С другой стороны, снижение синтеза и секреции плодового ПР в конце беременности вызывает, через активацию фермента коры надпочечников плода 5α-редуктазу, манифестное образование плодового К. С током крови К поступает в плаценту, тормозит в ней секрецию прогестерона и повышает высвобождение эстрогенов, что является важным фактором в индукции родовой деятельности [22].
Исследование специфических протеинов «зоны беременности» в динамике свидетельствовало о прогрессировании нарушений белково синтетической функции маточно-плацентарного комплекса при ОП: на 7–10-е сутки констатировано снижение ТБГ в 1,4 раза, а концентрация ПАМГ-1 возрастала в 2 раза. Снижение уровня ТБГ и увеличение ПАМГ-1 следует отнести к проявлениям дезадаптивного характера системы «мать-плацента-плод» с доминированием программ, направленных на угнетение или остановку дальнейшего развития беременности при ОП [2, 22, 24]. По мнению Н.А. Ляличкиной и соавт. (2012) снижение ТБГ до 12 недель беременности можно считать предиктором развития плацентарной недостаточности [24].
Дополнительное использование в программе стандартной терапии ОП дискретного плазмафереза, а также микронизированного прогестерона в связи с дефицитом его содержания у беременных с ОП позволило предотвратить резкие колебания стрессорных гормонов, способствуя сохранению стабильных концентраций ПР и стероидных гормонов, а также нормализации синтеза плацентоспецифических белков во все сроки проведения лечебных мероприятий. В настоящее время накоплен достаточно обширный опыт применения эфферентных методов при лечении различной акушерско-гинекологической патологии, в том числе и при невынашивании беременности, а также при сочетании беременности с острым аппендицитом [25–29]. Общепризнанными специфическими эффектами плазмафереза являются: детоксикация, коррекция гемостазиологических и иммунологических нарушений, а также повышение чувствительности к эндогенным и медикаментозным веществам [25].
Проведение комплексного УЗИ показало сохранение и прогрессировании нарушений маточной гемодинамики у беременных на 4–5-е сутки при стандартном лечении ОП, с увеличением скоростей кровотока и снижением индексов периферического сопротивления сосудов на 7–10-е сутки, что способствовало возникновению структурных изменений шейки матки (укорочение длины шейки матки по данным цервикометрии в 1,5 раза: с 35,13±2,24 до 23,16±1,17 мм) и клинических симптомов угрожающего прерывания беременности. В опубликованной работе М.Л. Чехонацкой и соавт. (2008) было установлено увеличение скоростей артериального и венозного кровотоков на фоне снижения периферического сопротивления маточных сосудов при координированных сокращениях матки в последние две недели гестации [30]. Кроме того, в группе сравнения на 7–10-е сутки лечения выявлено прогрессирующее увеличение толщины плаценты (с 27,5±2,3 до 35,2±2,7 мм); ретроплацентарная гематома, размерами от 05–14 мм до 20–36 мм диагностирована у 33,3%, а отсутствие сердцебиения эмбриона/плода констатировано у 17,9% беременных.
Дополнительное использование дискретного плазмафереза и микронизированного прогестерона в программе стандартной терапии ОП позволило своевременно восстановить изменения маточно-плацентарного кровотока, предотвратить развитие плацентарной недостаточности и пролонгировать беременность во всех случаях.
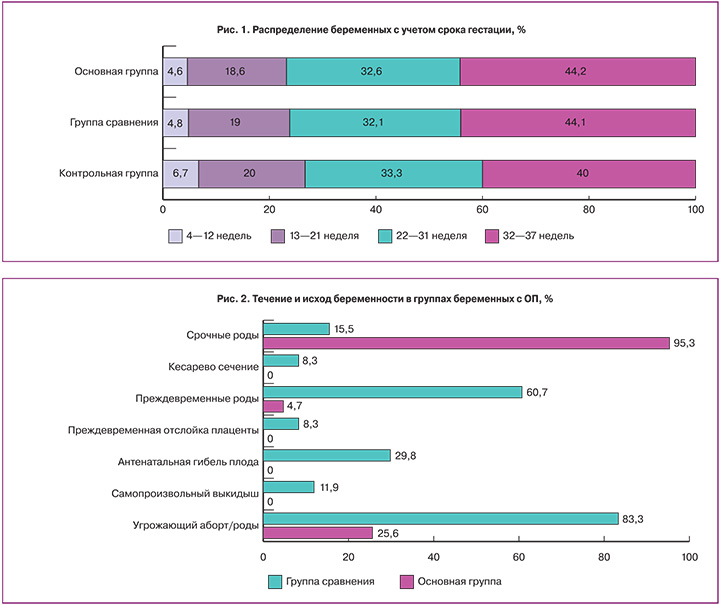
При анализе течения и исходов беременностей с ОП установлена высокая частота осложнений гестации при использовании стандартного лечения (рис. 2).
Угроза прерывания беременности на 7–10-е сутки лечения в хирургическом стационаре зафиксирована у 83,3% женщин. Удельный вес самопроизвольного выкидыша составил 11,9%, неразвивающейся беременности – 29,8%, преждевременных родов – 60,7%. Оперативное родоразрешение выполнено только в 8,3% у беременных с ОП в связи с преждевременной отслойкой плаценты. При расчете показателей перинатальной смертности при сочетании беременности и ОП с учетом преждевременных родов получены следующие результаты: мертворождения за счет антенатальной гибели плодов составили 203,1‰ (n=13), а ранняя неонатальная смертность (до 7 суток после родов) — 106,4‰ (n=5). Таким образом, перинатальная смертность при развитии ОП у беременных составляет 281,3‰, а общие репродуктивные потери — 45,2% (n=38). Полученные нами данные о высокой частоте потерь беременности и антенатальной гибели плода при возникновении ОП согласуется с мнением большинства исследователей [7, 8, 11, 18].
По результатам морфологического исследования плацент (n=80) в группе сравнения были выявлены характерные изменения для хронической плацентарной недостаточности в 78,8% наблюдений, а признаки острой недостаточности плаценты – в 21,2% случаев.
Следует подчеркнуть, что до настоящего времени, остается дискутабельным вопрос о целесообразности пролонгирования беременности при развитии ОП. Некоторые хирурги и акушеры-гинекологи в случае постановки диагноза ОП склоняются в пользу прерывания беременности в связи с определенными сложностями лечения данной категории беременных, высоким риском акушерских осложнений и летального исхода [9, 11]. По мнению И.В. Маева и соавт. (2007), прерывание беременности в I триместре или стимуляция преждевременных родов во второй ее половине улучшают прогноз для матери при ОП [9]. Е.Ю. Еремина (2012) считает, что в случае развития ОП нецелесообразно сохранение беременности любого срока при наличии угрозы ее прерывания [5].
Применение в комплексе лечебных мероприятий разработанного нами способа, основанного на использовании дискретного плазмафереза на 1-е и 3-и сутки, а также микронизированного прогестерона с 1-х суток лечения ОП, позволяет пролонгировать беременность во всех случаях. В большинстве наблюдений беременность у пациенток основной группы закончилась родами в срок (95,3%), преждевременные роды констатированы в 4,7% случаях при сроке гестации 35–36 недель в связи с преждевременным разрывом плодных оболочек. У всех женщин родоразрешение осуществлялось через естественные родовые пути. Оценка новорожденных по Апгар в основной группе соответствовала 7–9 баллам, а средняя масса новорожденных составила 3584,2±196,5 г.
Заключение
Сочетание беременности и ОП увеличивает частоту самопроизвольных выкидышей, неразвивающейся беременности, преждевременных родов, способствует повышению перинатальной смертности (до 281,3‰) и удельному весу общих репродуктивных потерь (до 45,2%). Возникновение ОП у беременных сопровождается повышением стрессорных гормонов, дезадаптацией синтеза плацентоспецифических протеинов, нарушениями маточно-плацентарного кровотока, что приводит при стандартном ведении к формированию хронической плацентарной недостаточности в 78,9% и осложняется острой недостаточностью плаценты в 21,2% наблюдений. Дополнительное включение в комплекс лечебных мероприятий разработанного способа, основанного на использовании дискретного плазмафереза и препаратов прогестерона, позволяет своевременно и эффективно воздействовать на имеющиеся нарушения гомеостаза у беременных с ОП, восстановить гормональный дисбаланс и маточно-плацентарный кровоток, предотвратив тем самым негативное воздействие продуктов эндотоксиновой агрессии на структуру и функцию трофобласта/плаценты, а также эмбриона/плода. Применение разработанного способа позволило сократить частоту угрожающего прерывания беременности при развитии ОП в 3 раза; уменьшить число преждевременных родов в 13 раз, а показатели перинатальной смертности свести до нуля.



