Одной из основных причин материнской и младенческой заболеваемости и смертности являются преждевременные роды (ПР). Это сложная акушерская проблема, имеющая большое социальное значение [1].
По оценкам Всемирной организации здравоохранения, ежегодно в мире преждевременно рождается около 15 млн детей, то есть каждый 10-й ребенок появляется на свет ранее 37 недель беременности. Около миллиона детей каждый год умирают из-за осложнений, связанных с ПР.
В развитых странах частота ПР составляет не более 5%, тогда как в развивающихся достигает 25% [2, 3]. Наиболее сложная ситуация складывается в странах с самым низким уровнем дохода, где почти половина всех детей, рожденных до 32-й недели беременности, умирает. Обращает на себя внимание тот факт, что мертворождение при ПР встречается в 8–13 раз чаще, чем при срочных [4].
В России частота ПР после введения новых критериев живорождения в 2012 году составила 4,6% (в 2011 году – 3,9%) [5] и пока не имеет тенденции к снижению. Экономические затраты на выхаживание одного недоношенного ребенка составляют около 1,5 млн рублей [6].
Нельзя не отметить, что развитие и активное внедрение новых вспомогательных репродуктивных технологий увеличивает количество беременных женщин с угрозой невынашивания и, как следствие, повышает статистику ПР и неонатальную смертность [7].
Этиология ПР не известна. Большинство авторов выделяют такие этиопатогенетические механизмы, как интраамниальная инфекция, перерастяжение матки (вследствие многоплодия и/или многоводия), преждевременное излитие околоплодных вод, истмико-цервикальная недостаточность, ПР в анамнезе, аномалии развития матки, курение, тяжелая экстрагенитальная патология матери и др. [8].
Активное развитие и внедрение на Западе персонализированной медицины способствовало тому, что в последние годы предпринимались попытки поиска генов, ответственных за ПР. Описаны отдельные ассоциации полиморфизма генов с риском ПР, но данные противоречивы [9, 10].
 По данным исследования R. Menon и соавт., оценка более 100 биомаркеров не позволила адекватно прогнозировать ПР и снизить их частоту [11].
По данным исследования R. Menon и соавт., оценка более 100 биомаркеров не позволила адекватно прогнозировать ПР и снизить их частоту [11].
Известно, что прогестерон является основным гормоном беременности с момента зачатия и до наступления родов. В результате взаимодействия прогестерона с рецепторами Т-клетки продуцируют прогестерониндуцированный блокирующий фактор (ПИБФ; англ.: progesterone-induced bocking factor, PIBF), который, воздействуя на лимфоциты, смещает иммунный ответ матери в сторону Th2-типа, оказывая тем самым цитопротективное действие. При пониженном содержании прогестерона вырабатывается недостаточно ПИБФ, и происходит чрезмерная активация Т-лимфоцитов, несущих маркеры CD56 и CD16, ингибируется продукция провоспалительных цитокинов (интерлейкина-1,6, фактора некроза опухоли-α, интерферона-γ), увеличение содержания которых сопровождается активацией протромбиназы с образованием гематом, тромбозов, нарастает расстройство микроциркуляции, что может привести к плацентарной недостаточности и прерыванию беременности [12, 13].
Кроме описанных выше иммунологических эффектов, ПИБФ ингибирует фосфолипазу А2, что предотвращает синтез простагландинов [14]. При его недостатке происходит повышение активности фосфолипаз, под действием которых высвобождается арахидоновая кислота – предшественник эйкозаноидов – кислородсодержащих производных. В эндотелиальных клетках из полиненасыщенной арахидоновой кислоты при участии специфического мультиферментного комплекса циклооксигеназы синтезируются простациклин и ряд активных простагландинов. Последние оказывают выраженное утеротоническое действие на миометрий, способствуют возрастанию сократительной способности матки, ускорению «созревания» шейки матки. По мнению многих авторов, простагландины играют важную роль в развитии родовой деятельности [15–17].
Заслуживает внимания исследование I. Hudić и Z.В. Fatusić, в рамках которого были обследованы беременные (6–24 недели) и выявлена корреляция низкого уровня ПИБФ в крови и угрозы прерывания беременности. Авторы делают вывод, что ПИБФ может использоваться с целью диагностики и прогнозирования угрожающего аборта [18].
В исследовании L. Lin и соавт. проведен иммуноферментный анализ ПИБФ1 при преэклампсии в крови и плаценте [19]. Полученные данные свидетельствуют о снижении экспрессии ПИБФ в плаценте у женщин с тяжелой преэкламспией.
В исследовании Л.С. Рора показано, что у пациенток с патологическим течением I триместра (6–12 недель), обусловленным прогестероновой недостаточностью, выявлено снижение содержания прогестерона по сравнению с физиологическим течением беременности, уменьшение количества рецепторов к прогестерону, а также экспрессии генов рецепторов прогестерона и гена ПИБФ1 более чем на 50% [20].
Согласно литературным данным, ПИБФ1 появляется в крови начиная с ранних сроков беременности, нарастает, достигая максимума к 40 неделям, и резко снижается после родов [21, 22].
ПИБФ1 заслужил внимание исследователей как медиаторный белок, играющий важную роль в нормализации иммунного ответа в I и II триместрах и оказывающий антиабортивное действие. Выше также были изложены его эффекты, имеющие место на более поздних сроках беременности.
Целью данного исследования стало изучение экспрессии мРНК гена ПИБФ1 в плаценте при ПР с целью установления роли ПИБФ1 в патогенезе ПР.
Материал и методы исследования
В рамках исследования мы проанализировали экспрессию мРНК гена ПИБФ1 в плаценте у женщин с ПР, а также содержание прогестерона в крови. Материал для исследования собирался на клинических базах кафедры акушерства и гинекологии лечебного факультета РГМУ. Плаценты отправлялись на исследование с информированного согласия родильниц.
Обследованы 63 женщины, из которых у 34 беременность закончилась ПР (28–37 недель), у 29 – своевременными родами. Группы сформированы на основании срока родов и полученного лечения во время беременности: 1-я группа – контрольная, своевременные роды, неосложненная беременность, n=11; 2-я группа – своевременные роды, негормональное лечение, n=8; 3-я группа – своевременные роды, прием прогестерона во время беременности, n=10; 4-я группа – ПР, негормональное лечение, n=22; 5-я группа – ПР, прием прогестерона, n=12. Критериями исключения были: преэклампсия, тяжелая экстрагенитальная патология и инфекционные заболевания женской половой системы.
 Определение уровня экспрессии мРНК гена ПИБФ1 проводилось на базе лаборатории молекулярно-генетических методов ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России. Выделение РНК и анализ экспрессии генов проводили методом обратной транскрипции и полимеразной цепной реакции в режиме реального времени (ОТ-ПЦР) согласно инструкциям производителя («ДНК-Технология», Россия) с использованием набора реагентов «Проба НК» с дополнительной фенольной депротеинизацией.
Определение уровня экспрессии мРНК гена ПИБФ1 проводилось на базе лаборатории молекулярно-генетических методов ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России. Выделение РНК и анализ экспрессии генов проводили методом обратной транскрипции и полимеразной цепной реакции в режиме реального времени (ОТ-ПЦР) согласно инструкциям производителя («ДНК-Технология», Россия) с использованием набора реагентов «Проба НК» с дополнительной фенольной депротеинизацией.
Гистологическое исследование плацент проводилось на базе патологоанатомического отделения ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России.
Обработка результатов осуществлялась с помощью программы MS Excel на основании данных, полученных с помощью прибора. Использован метод сравнения индикаторных циклов (метод ΔCq). Уровень экспрессии мРНК гена ПИБФ1 измерялся в относительных единицах, отражающих представленность транскрипта относительно нормировочного фактора, рассчитанного на основе уровня экспрессии мРНК референсных генов (В2М и GUSB).
Статистическая обработка полученных данных выполнена при помощи компьютерной программы Statistica 10 (StatSoft Inc., США). В исследуемых группах определяли вид распределения данных с помощью теста Колмогорова–Смирнова. Для сравнения данных в нескольких группах использован тест Краскела–Уоллиса и Манна–Уитни, которые применяются в малочисленных группах с неясным законом распределения величин. Статистические гипотезы считались подтвержденными при уровне значимости р<0,05.
Описательная статистика включала в себя определение медианы (Me), интерквартильного диапазона (25–75%), минимального и максимального значений. Для сравнения уровней экспрессии мРНК гена ПИБФ1 в нескольких группах был применен медианный тест Краскела–Уоллиса, предназначенный для малочисленных групп. Статистические гипотезы считались подтвержденными при уровне значимости р<0,05.
Результаты исследования и обсуждение
Выявлены различия в экспрессии мРНК гена ПИБФ1 в плаценте у женщин со своевременными родами (контрольная группа и группа «своевременные роды без гормонального лечения») и женщин, беременность которых закончилась ПР (p<0,005).
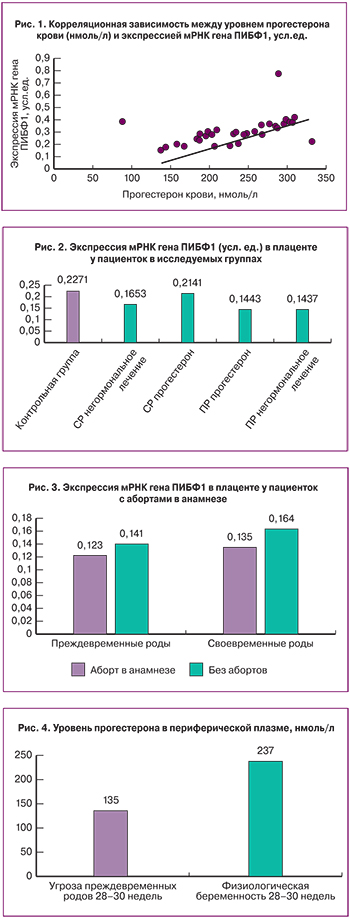
Выявлена умеренная прямая зависимость между уровнем прогестерона в крови и экспрессией мРНК гена ПИБФ1 в плаценте. Коэффициент корреляции r=0,66 (95% ДИ 0,22–1,12) (рис. 1).
Наименьший уровень экспрессии мРНК гена ПИБФ1 соответствует группе пациенток с ПР, которые не получали препараты прогестерона во время беременности. Достоверных различий в экспрессии мРНК гена ПИБФ1 между 4-й и 5-й группами выявлено не было (рис. 2).
У женщин с 1 и более медицинским абортом в анамнезе отмечено снижение экспрессии мРНК гена ПИБФ1 в плаценте по сравнению со значением медианы в группе (рис. 3). Возможно, это могло быть результатом дисгормональных нарушений рецепторного аппарата матки после прерывания беременности.
У пациенток с угрозой ПР уровень прогестерона в крови оказался ниже, чем при физиологической беременности (p=0,0043) (рис. 4).
У всех пациенток с низкой экспрессией мРНК гена ПИБФ1 были выявлены гистологические признаки плацентарной недостаточности. Наиболее значимым в структуре нарушения созревания хориона стало увеличение числа случаев ускоренного созревания ворсинчатого хориона, сочетающееся с циркуляторными и инволютивно-дистрофическими изменениями (рис. 5 и 6).
Рассматривая лечение исследуемых во время беременности, в частности, терапию прогестероном, следует отметить, что в группе ПР непосредственно до родов получали лечение 3 из 12 обследованных женщин, у остальных он был назначен по поводу угрозы прерывания беременности в I и/или II триместрах и отменен после снятия диагноза. Таким образом, имевший, по нашему мнению, место дефицит прогестерона никак в дальнейшем не компенсировался.
Заключение
Полученные в результате настоящего исследования данные свидетельствуют о достоверном снижении экспрессии мРНК гена ПИБФ1 в группах женщин с поздними ПР. В условиях дефицита прогестерона это могло привести к срыву адаптационно-приспособительных реакций материнского организма, направленных на сохранение беременности, и стать одним из факторов начала преждевременной родовой деятельности.
Дальнейшие исследования, основанные на более широкой выборке, вероятно, смогут подтвердить полученные в настоящей работе результаты и развить идею о влиянии ПИБФ на преждевременную родовую деятельность.



