Привычный выкидыш ранних сроков беременности – акушерское осложнение, требующее специальных методов ведения беременности в I триместре. Согласно определению ВОЗ, диагноз привычной потери беременности ранних сроков устанавливается в случае произошедших подряд трех и более самопроизвольных прерываний беременности на сроке гестации до 22 недель (код N96 по МКБ-10). Женщины с привычным выкидышем на ранних сроках гестации составляют группу риска, в которой существенно повышена вероятность развития плацентарной недостаточности, наступления ранних преждевременных родов, задержки роста плода, излития околоплодных вод при недоношенном сроке беременности, отслойки плаценты во втором и третьем триместрах беременности [1, 2].
Сложным является ведение беременности у женщин из супружеских пар с привычным выкидышем неясного генеза (идиопатическим привычным выкидышем). Такой диагноз ставится при исключении генетических, анатомических, гормональных, инфекционных, аутоиммунных факторов привычных потерь беременности. Частота идиопатического привычного выкидыша составляет от 5 до 20% в структуре невынашивания [3]. На настоящий момент считается, что отторжение эмбриона при привычном выкидыше неясного генеза вызвано иммунологическими причинами, или аллоиммунными нарушениями. По данным некоторых авторов, шанс доносить беременность без терапии после трех выкидышей, обусловленных иммунными причинами, составляет 30%, после четырех – 25%, после пяти – 5% [4, 5]. Считается, что вероятность иммунологических нарушений в генезе привычного выкидыша растет с увеличением числа потерь беременностей [6].
Выявление аллоиммунных причин выкидыша рассматривается, как необходимая предпосылка для обоснования патогенетической иммунотерапии. Наиболее дискуссионным видом иммунотерапии, использующимся для лечения привычного невынашивания, стала иммуноцитотерапия (ИЦТ) – иммунизация отцовскими лейкоцитами [7–9]. Показано, что ИЦТ во время беременности (особенно в супружеских парах с совместимостью по HLA-антигенам) способствует формированию состояния иммунной системы, необходимого для стимуляции развития плаценты и обеспечения нормального развития эмбриона [10, 11]. ИЦТ широко используется для коррекции привычного выкидыша как в России [8, 12], так и за рубежом [13, 14], однако механизмы ее влияния на гестационные процессы до сих пор неясны.
Считалось, что одним из результатов ИЦТ является подавление агрессивных эффекторных реакций материнской иммунной системы, выражающееся в снижении содержания субпопуляций клеток с естественной киллерной активностью и в увеличении продукции блокирующих антител [3, 6–9].
Особую значимость приобрели исследования субпопуляции Т-регуляторных клеток с фенотипом CD4+CD25+ и конститутивной экспрессией фактора Foхр3+ (Трег). Считается, что осуществляемая Трег специфическая иммуносупрессия способствует формированию состояния толерантности, необходимого для реализации гестационных процессов в первом триместре беременности [15]. В связи с этим обсуждается точка зрения, что целью иммунотерапии должна быть не иммуносупрессия, а стимуляция толерантности к аллоантигенам плода отцовского происхождения [16].
Также важная роль в иммунорегуляции принадлежит толерогенной молекуле СD200. В результате взаимодействия CD200 с рецепторами как дендритных клеток, так и клеток с естественной киллерной активностью, индуцируется генерация Трег-клеток и, соответственно, формирование специфической периферической толерантности [17–20].
Исследований, посвященных одновременной оценке в периферической крови особенностей субпопуляций лимфоцитов с киллерной активностью, Трег-клеток и клеток, экспрессирующих CD200, у беременных с привычным выкидышем аллоиммунного генеза в первом триместре гестации на фоне ИЦТ не проводилось.
Целью настоящей работы стало исследование динамики субпопуляционного состава лимфоцитов периферической крови в течение первого триместра беременности на фоне проведения ИЦТ у женщин с привычным выкидышем аллоиммунного генеза, включая субпопуляции киллерных клеток с различным фенотипом, естественных Т-регуляторных клеток и клеток, экспресирующих CD200.
Материал и методы исследования
Основную группу исследования составили 25 беременных с привычным выкидышем аллоиммунного генеза (две и более потери беременности от одного партнера, произошедшие в первом триместре беременности, с подтвержденным нормальным кариотипом плода). В статье проанализированы результаты исследований женщин, выносивших беременность до доношенного срока.
Критериями включения женщин в исследование были: подписание формы информированного согласия на участие в исследовании, возраст женщин от 20 до 40 лет, самопроизвольное наступление беременностей, нормальный кариотип обоих партнеров, нормозооспермия у партнера, отсутствие анатомических, генетически обусловленных, аутоиммунных, гормональных нарушений, препятствующих наступлению и вынашиванию беременности, отсутствие тяжелых экстрагенитальных заболеваний. Все пациентки с привычным выкидышем прошли предгестационную подготовку, включающую лечение воспалительных процессов органов малого таза при наличии показаний.
Контрольную группу составили 11 беременных на сроке 12 недель гестации с физиологическим течением беременности до доношенного срока.
В первом триместре беременным с привычным выкидышем была проведена процедура ИЦТ – иммунизация женщин аллогенными клетками партнеров, дважды в первом триместре с интервалом в один месяц в сроке 5–6 недель и 8–9 недель беременности. При этом пациенткам подкожно вводили 50 млн клеток лейкоцитарной взвеси партнера в ладонную поверхность предплечья в 10–12 точек.
Кровь для анализа у беременных с привычным выкидышем забирали натощак из локтевой вены в сроке 5–6 недель до иммунизации, в 8–9 недель и 12 недель гестации после введения клеток.
Поверхностный фенотип клеток периферической крови определяли с помощью стандартного набора моноклональных антител (мАт), меченных FITC или PE, к антигенам CD3, CD4, CD5, CD8, CD16, CD19, CD16, CD56, CD25, CD127, CD200 («Becton Dickinson» и «eBioscience», США). Оценивали содержание основных субпопуляций T-клеток (СD3+, CD4+, CD8+), В-клеток (CD19+), B1-клеток (CD19+CD5+), NK-клеток (СD56+, СD16+), а также содержание Трег (СD4+CD25highCD127low/-). Лимфоцитарный гейт, позволяющий исключить из анализа другие клетки крови, выявляли с помощью мАт к СD45, меченных Per-CP («Dako», Дания). Моноклональные антитела добавляли непосредственно к цельной крови, затем лизировали с помощью раствора FACS Lysing Solution («Becton Dickinson», США). Анализ проводили с использованием проточного цитофлуориметра FACSСalibur («Becton Dickinson», США).
Статистическую обработку данных производили общепринятыми методами вариационной статистики. Данные представлены как среднее ± ошибка среднего. Соответствие расчетных выборок показателей нормальному распределению оценивали с помощью критерия Колмогорова–Смирнова с использованием пакета Statistica 6.0 для Windows XP. Значимость наблюдаемых отклонений средних значений измеренных параметров оценивали с помощью двухвыборочного t-критерия Стьюдента с различными дисперсиями для средних значений с использованием пакета статистического анализа для Microsoft Office Excel 2007.
Результаты исследования
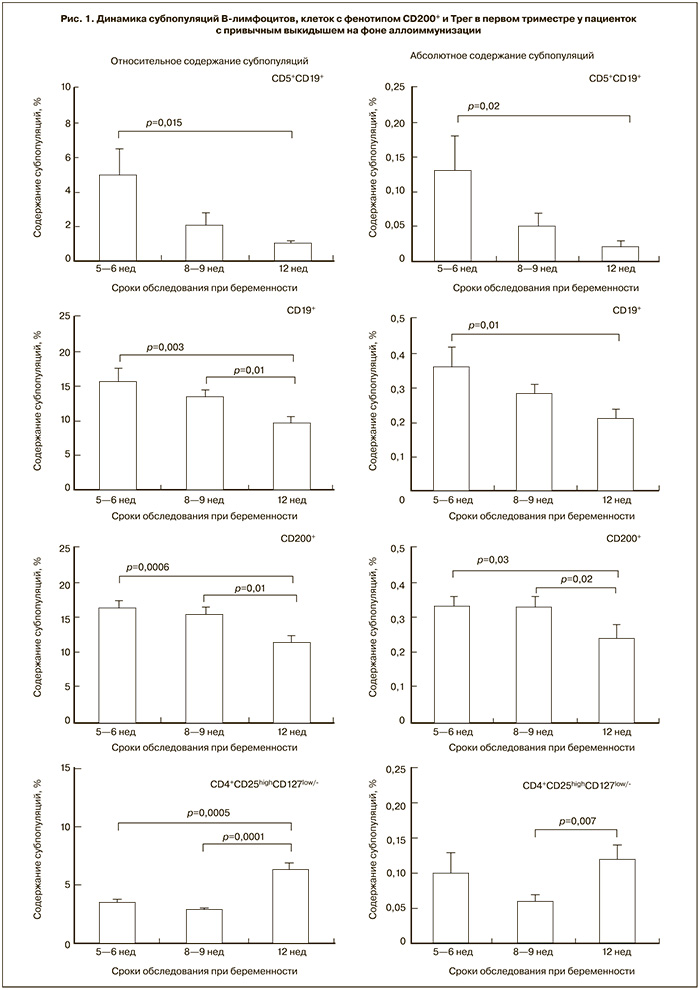
Было проанализировано содержание лимфоцитов различных фенотипов в периферической крови женщин с привычным выкидышем до назначения лечения и после каждой процедуры аллоиммунизации. Результаты исследования представлены в таблице.
Из данных, приведенных в таблице, следует, что в течение первого триместра в периферической крови беременных с привычным выкидышем в анамнезе нет динамики в содержании основных субпопуляций лимфоцитов (CD3+, CD4+, CD8+), а также в содержании субпопуляций киллерных клеток (CD56+, CD3-CD56,16+, CD56,16+, CD3+CD56,16+, CD16+, CD3+CD16+, CD3-CD16+).
В содержании субпопуляций В-лимфоцитов (CD5+CD19+ и CD19+), Трег и клеток, несущих CD200, выявлена динамика, которая представлена на рис. 1. Содержание указанных субпопуляций в сроки беременности 5–6 недель и 8–9 недель не отличаются между собой, в 12 недель гестации зарегистрирован рост как относительного, так и абсолютного содержания Трег, значимое снижение содержания клеток с фенотипом CD200+ и В-лимфоцитов.
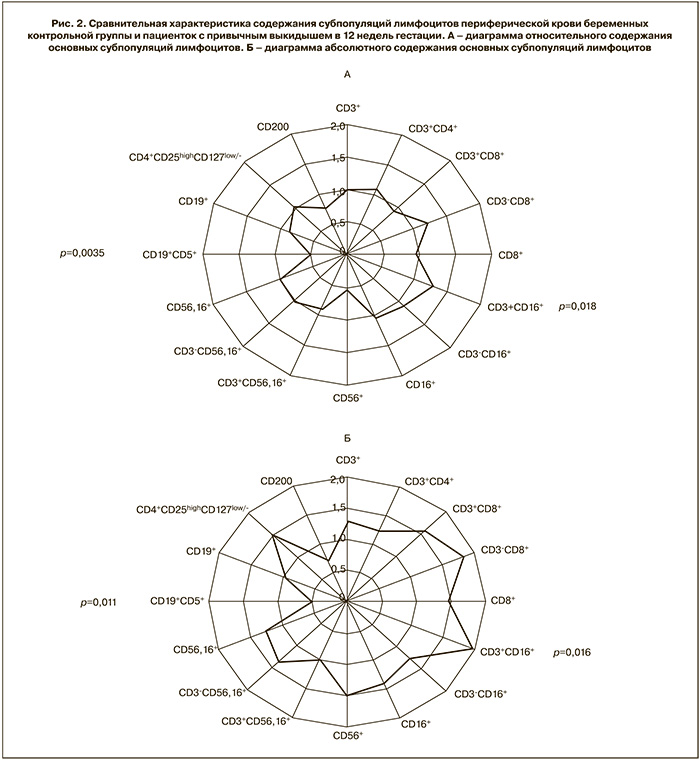
Сравнение содержания субпопуляций лимфоцитов в сроке 12 недель гестации у женщин с привычным выкидышем и у беременных контрольной группы представлено на рис. 2.
Данные на диаграмме по осям представлены как отношение среднего значения содержания конкретной субпопуляции лимфоцитов в периферической крови беременных пациенток с привычным выкидышем к среднему значению содержания той же субпопуляции лимфоцитов в периферической крови контрольной группы беременных женщин на сроке 12 недель гестации.
Как показано на рис. 2, у женщин с привычным выкидышем значимо ниже содержание В1-лимфоцитов (CD5+CD19+), значимо выше содержание субпопуляции с киллерной активностью и фенотипом CD3+CD16+, и отсутствуют различия с контрольной группой беременных в содержании остальных субпопуляций, включая содержание Трег и клеток, экспрессирующих CD200.
Обсуждение полученных результатов
Как уже упоминалось, ИЦТ широко используется в терапии пациенток с привычным выкидышем как в России, так и за рубежом. Однозначного вывода об ее эффективности не сделано до настоящего времени, поскольку протоколы иммунизации в клиниках различаются, а также нет единого мнения о показателях, используемых для оценки влияния ИЦТ на состояние иммунной системы [3, 6, 21, 22]. Чаще всего эффективность иммунизации связывают со снижением содержания субпопуляции лимфоцитов с киллерной активностью и, преимущественно, с фенотипом CD56+ [9, 23–25].
В представленной работе в периферической крови женщин с привычным выкидышем в первом триместре беременности, развивающейся на фоне ИЦТ, не выявлено динамики киллерных субпопуляций лимфоцитов с различными фенотипами (CD56+, CD3-CD56,16+, CD56,16+, CD3+CD56,16+, CD16+, CD3+CD16+, CD3-CD16+). Подобный результат можно объяснить тем, что в беременность вступали пациентки после проведенной предгестационной подготовки и без инфекционно-воспалительной патологии.
В ранее опубликованных нами результатах исследований было показано, что у пациенток с привычным выкидышем при обследовании вне беременности содержание Трен-Клеток было значимо ниже, а клеток, несущих CD200, – значимо выше, чем у здоровых женщин с реализованной репродуктивной функцией [26].
Проведение двух курсов иммунизации в предгестационной подготовке не привело к изменению выявленных закономерностей [27]. В сроке 5–6 недель вестница содержание Трен-Клеток и клеток с фонетикой CD200+ было таким же, как до предгестационной подготовки [26]. Однако в настоящей работе нами установлено, что к концу первого триместра беременности, протекающей на фоне ИЦТ, содержание Трен-Клеток и клеток с фонетикой CD200+ оказалось таким же, как в крови беременных контрольной группы.
Можно предположить, что увеличение в 12 недель вестница содержания Трен-Клеток до значений в контрольной группе и снижение до контрольных значений содержания клеток, несущих CD200, может рассматриваться как один из механизмов иммуномодулирующего действия аллоиммунизация, способствующий формированию толерантности и обеспечивающий нормальное протекание беременности.
В представленной работе выявлено уменьшение содержания по сравнению с контрольной группой беременных популяции В1-лимфоцитов – клеток с фонетикой CD5+CD19+. В опубликованной нами ранее работе было показано значимое увеличение абсолютного содержания В1-лимфоцитов, отражающее влияние иммунизации, проводимой во время предгестационной подготовки женщин с привычным выкидышем, на состояние гуморального иммунитета [27]. Кроме того, в многочисленных исследованиях подтверждена активация В-клеточного звена иммунитета после иммунизации, которая сопровождается появлением антилейкоцитарный антиотцовских антител в крови иммунизированных женщин [6, 28, 29].
По-видимому, неоднократное введение алогичных лимфоцитов при подготовке к беременности и при ранних сроках беременности вызывает активацию эффективного звена иммунитета, как клеточного, так и гуморального, и последующую супесью избыточных реакций, обеспечивающуюся активацией регулярного звена клеточного иммунитета, функция которого нормализуется в ходе ИЦТ.
Обнаруженная в представленной работе динамика содержания субпопуляций В-лимфоцитов (CD5+CD19+ и CD19+), Трен-Клеток и клеток с фонетикой CD200+ позволяет предположить, что иммунизация беременных женщин клетками полового партнера привела к сбалансированности воспалительных реакций и к достижению такого состояния иммунной системы, которое способствовало вынашиваю данной беременности.
Нами не обнаружено отличий в содержании CD56-позитивных субпопуляций клеток в группе женщин с привычным выкидышем и в контрольной группе, но выявлено более высокое содержание популяции CD3+CD16+ по сравнению с содержанием в крови беременных с неотягощенным акушерским анамнезом. По-видимому, указанная популяция является NKT-подобными клетками, роль которых в иммунорегуляция беременности остается неисследованной. Нельзя исключить, что избыточная килечная активность, связанная с увеличением содержания NKT-подобных клеток, могла быть также компенсирована в присутствии Трен-Клеток, оказывающих супрессивное воздействие на NKT-клетки [30].
Полученные нами результаты согласуются с доминирующей в последнее десятилетие концепции о необходимости провоспалительного состояния иммунной системы для успешности процессов имплантации и плацентами в первом триместре беременности и формирования противовоспалительного фона при последующих стадиях беременности [31, 32].
Заключение
У 25 беременных с привычным выкидышем аллоиммунного геенна данная беременность выношена на фоне 2-кратной иммунизации лейкоцитами полового партнера в первом триместре. Проанализировано содержание различных субпопуляций лимфоцитов периферической крови до иммунизации, в 5–6, 8–9 и 12 недель беременности после каждой процедуры иммунизации. Не выявлено значимой динамики в содержании основных субпопуляций лимфоцитов (CD3+, CD4+, CD8+), а также в содержании субпопуляций килечных клеток (CD56+, CD3-CD56,16+, CD56,16+, CD3+CD56,16+, CD16+, CD3+CD16+, CD3-CD16+). Обнаружено увеличение относительного и абсолютного содержания Трен-Клеток и снижение содержания клеток с фонетикой CD200+ к 12 неделям вестница до значений, сопоставимых с данными в контрольной группе беременных. Показано снижение к этому сроку содержания лимфоцитов с фонетикой CD5+CD19+ по сравнению с контролем при сходстве общего содержания В-лимфоцитов. Указанные изменения могут свидетельствовать о достижении состояния иммунной системы, которое способствовало вынашиваю данной беременности.



