Преждевременные роды ассоциированы с высокой перинатальной заболеваемостью и смертностью и являются одной из наиболее актуальных проблем современного акушерства [1, 2]. В патогенезе осложнений беременности и раннего неонатального периода значимая роль отводится воспалительным реакциям, приводящим к хроническому оксидативному стрессу на фоне дисбаланса нормальной продукции активных форм кислорода (АФК) и активности антиоксидантной защитной системы [3, 4]. Известно, что преждевременные роды часто сопровождаются манифестацией симптомов, типичных для хронического оксидативного стресса – накоплением продуктов перекисного окисления липидов, ковалентной модификации белков, падением эффективности энергопреобразующей функции митохондрий и ростом числа повреждений ядерной и митохондриальной ДНК [3].
В связи с этим в последнее время заметно вырос интерес к исследованиям механизмов индукции оксидативного стресса митохондриального генеза и его роли в развитии патологий беременности, в том числе преждевременных родов [5].
В настоящее время основная роль в развитии ПР отводится инфекции, при которой наблюдается нарушение механизмов активации фагоцитов и, как следствие, повышенный воспалительный ответ [4].
Критичной является продолжительность и/или острота инфекции на фоне транзитного снижения активности антиоксидантных систем, приводящего к накоплению продуктов перекисного окисления липидов [5]. При достижении порогового значения содержания таких продуктов становится возможным протекание химических реакций, приводящих к модификации структуры белков, например, посредством образования внутримолекулярных ковалентных сшивок при участии альдегидной группы малонового диальдегида, свободной аминогруппы лизина и других активных групп [6]. Долговременное воздействие АФК на клетки и ткани организма при дисбалансе защитных систем приводит к нарушению тканевого гомеостаза, дисфункции тканей и органов, системным нарушениям на уровне целого организма, а в некоторых случаях к полиорганной недостаточности [7].
Поскольку в основе молекулярных механизмов окислительных повреждений лежит снижение активности антиоксидантных ферментов, можно предполагать, что при беременности нарушение структурно-функционального состояния клеточных мембран может быть опосредовано окислительной деструкцией как белков, так и липидов сосудистого эндотелия, приводящей к активации клеток иммунной системы матери [5, 8]. При этом показано, что на начальной стадии патологического процесса происходит накопление в периферической крови матери продуктов распада клеток и внутриклеточных органелл синцитиотрофобласта, связанное с развитием инфекции и/или асептического воспаления [4, 9].
В связи с этим можно предположить, что углубленные исследования в данной области позволят не только выявить первичные повреждения ткани и нарушения, приводящие к накоплению в периферической крови матери факторов индукции преждевременных родов, но и открыть реальные возможности для осуществления рациональной профилактики, прогнозирования и научно обоснованной терапии данной патологии.
Цель исследования: оценить диагностическую значимость сочетанного определения уровня малонового диальдегида и активности каталазы в крови беременных женщин при угрозе и/или преждевременных родах.
Материал и методы исследования
Критериями включения в исследование послужили: информированное добровольное согласие пациента, одноплодная беременность, отсутствие регулярной родовой деятельности, угроза преждевременных родов на сроке гестации от 22 до 36 недель. I группу составили беременные женщины, родившие на сроках 22–36 недель и не позднее 7 дней после проведения обследования, во II группу включены женщины с угрозой ПР (в соответствии с критериями ВОЗ и приказом Минздравсоцразвития РФ №1687н от 27.12.2011 г.) и последующим родоразрешением при доношенном сроке беременности, III группа (контроль) – условно здоровые беременные женщины с физиологически протекающей беременностью, родоразрешенные в срок. Для анализа биохимических показателей (уровня МДА и ферментативной активности каталазы) каждая группа была разбита на 3 подгруппы в зависимости от срока беременности, на котором осуществляли взятие крови для исследования. Таким образом, для каждой из трех включенных в исследование групп было сформировано по 3 подгруппы: (1) 22–27 недель гестации, (2) 28–32 недели гестации и (3) 33–36 недель гестации.
Критериями исключения являлись: тяжелая экстрагенитальная патология, истмикоцервикальная недостаточность, преэклампсия, преждевременное излитие околоплодных вод, многоплодная беременность, пороки развития плода, декомпенсированная плацентарная недостаточность.
Для определения концентрации малонового диальдегида в плазме крови использовали модифицированный метод Женча [10], основанный на реакции МДА с тиобарбитуровой кислотой с образованием окрашенного продукта с максимумом поглощения при 535 нм.
Измерение активности каталазы в плазме крови проводили методом полярографии высокого разрешения с помощью электрода Кларка по модифицированному методу Рота и Дженсена [11] на оксиграфе (Hansatech, UK). Метод основан на измерении количества О2, образующегося в результате реакции расщепления перекиси водорода (2H2O2=2H2O+O2). Активность каталазы в плазме крови рассчитывали в единицах активности на мл (Е/мл), где одна единица соответствует активности фермента, катализирующего превращение одного микромоля субстрата (H2O2) в минуту.
Статистическую обработку данных проводили в программах MS Excel и Statistica 6.0.
Результаты исследования
Всего обследованы 112 женщин. I группу составили 36 беременных, родивших на сроках гестации 22–36 недель в течение 7 дней после проведения обследования, II группу – 42 пациентки с угрозой преждевременных родов, родившие при доношенном сроке беременности, III группу – 34 условно здоровые беременных.
 Возраст женщин, включенных в исследование, варьировал в пределах от 18 до 40 лет и составил в среднем 28,9±3,8 года (I группа – 31,5±5,4 года, II группа – 27,6±4,4 года, III группа – 29,6±4,4 года).
Возраст женщин, включенных в исследование, варьировал в пределах от 18 до 40 лет и составил в среднем 28,9±3,8 года (I группа – 31,5±5,4 года, II группа – 27,6±4,4 года, III группа – 29,6±4,4 года).
При изучении особенностей соматического и гинекологического анамнеза было выявлено, что среди пациенток I и II групп достоверно чаще, чем в контроле, встречались нарушения жирового обмена (n=5, 13,5%; OR=1,9 (1,1–22,2)), варикозное расширение вен нижних конечностей (n=4, 10,8%; OR=3,9 (1,1–64,7)), пиелонефрит (n=5, 13,5%; OR=1,55 (1,5–4,3)) и цистит (n=6, 16,2%; OR=1,7 (1,6–5,1)). Таким образом, данные патологии являются статистически значимыми факторами риска развития угрозы преждевременных родов.
Анализ гинекологического анамнеза показал, что в I группе была выше частота встречаемости хронических воспалительных заболеваний органов малого таза (n=4, 10,8%; OR=1,7 (0,5–5,3)), миомы матки (n=3, 8,1%; OR=2,3 (0,7–7,6)), медицинских абортов на сроке до 12 недель гестации (n=13, 35,1%; OR=2,6 (0,5–12,5)) и самопроизвольных выкидышей (n=21, 56,7%; OR=1,1 (0,2–4,7)) в анамнезе. II группа существенно не отличалась от контроля по перечисленным показателям.
При анализе инфекционно-воспалительной заболеваний в I группе достоверно чаще встречались рецидивирующая герпетическая инфекция (n=2, 5,4%; OR=4,1 (1,7–21,7)) и бактериальный вагиноз (n=6, 16,2%; OR=1,4 (1,3–6,5)). Анализ структуры неблагоприятных исходов беременности установил, что аборт и самопроизвольный выкидыш статистически значимо чаще встречались в анамнезе женщин, родивших преждевременно. Частота случаев неразвивающейся беременности статистически не различалась среди женщин всех групп.
Был также проведен анализ характера течения беременности, акушерских и перинатальных исходов. Течение беременности в I триместре у пациенток I группы достоверно чаще осложнялось ранним токсикозом (n=2, 5,4%; OR=4,6 (1,3–15,2)) и ретрохориальной гематомой (по данным УЗИ) (n=4, 10,8%; OR=2,2 (1,4–12,1)). Во II триместре у пациенток I группы чаще отмечалось формирование истмикоцервикальной недостаточности (ИЦН) в 16,2% случаев (n=6, OR=1,4 (0,4–4,9)), в том числе потребовавшей проведения хирургической коррекции в 8,1% (OR=21,2 (7,8–57,8)), и угрожающего выкидыша в 56,7% случаев (n=21, OR=6,6 (1,8–23,7)). Из особенностей течения III триместра беременности следует отметить преобладание в I группе случаев задержки роста плода и плацентарной недостаточности (n=3, 8,1%; OR=4,4 (1,1–16,3)). Во II группе существенных отличий от женщин с физиологически протекающей беременности выявлено не было.
Изучения исхода родов для плода установили, что у детей женщин I группы достоверно чаще диагностировали респираторный дистресс-синдром (n=17, 45,9%; OR=7,1 (2,3–22,0)) и врожденную пневмонию (n=12, 32,4%; OR= 5,5 (1,9–15,4)).
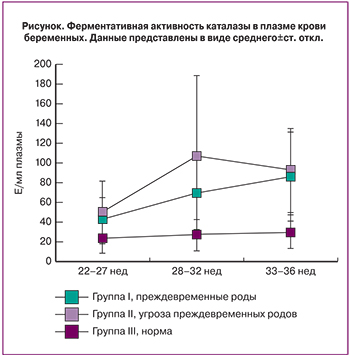
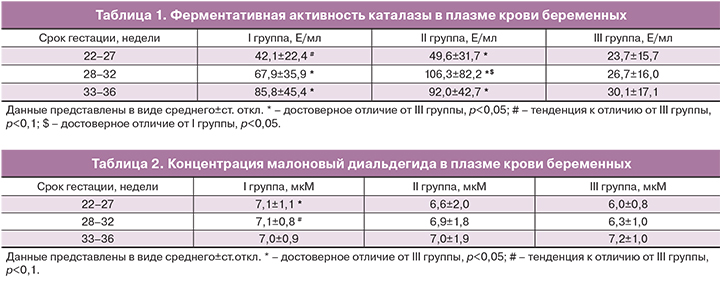
Анализ концентрации МДА и ферментативной активности каталазы в плазме крови был проведен для трех групп (преждевременные роды, не реализовавшаяся угроза преждевременных родов, физиологическая беременность). Результаты измерения ферментативной активности каталазы представлены в табл. 1 и на рисунке.
Однофакторный дисперсионный анализ выявил взаимосвязь между сроком беременности и ферментативной активностью каталазы в II группе (F(2.39)=3,6, p=0,04, рисунок) – активность каталазы увеличивалась по мере увеличения срока беременности. В I группе наблюдали аналогичную тенденцию (F(2,33)=2,9, p=0,07, рисунок). В III группе не выявлено зависимости срока беременности с активностью каталазы (F(2,31)=0,4, p=0,6, рисунок). Следует отметить, что во II группе (женщины с угрозой преждевременных родов, завершившейся рождением доношенного ребенка) максимальное значение активности каталазы наблюдали на сроке гестации 28–32 недели, в то время как в I группе (реализовавшиеся преждевременные роды) повышенную активность каталазы наблюдались вплоть до 33–36 недель беременности.
На сроке беременности 22–27 недель во II группе активность каталазы была достоверно выше (p=0,02) по сравнению с III группой, а в I группе отмечалась тенденция к повышению (p=0,06). Между собой I и II группы не различались по данному показателю.
На сроке беременности 28–32 недели в I и II группах наблюдали достоверное повышение активности каталазы (p=0,004; p=0,002) по сравнению с III группой. Сравнительный анализ активности каталазы в I и II группах показал, что во II группе встречается достоверно больше пациенток с активностью каталазы выше 150 Е/мл плазмы (p=0,045 по точному критерию Фишера). Таким образом, при угрозе преждевременных родов на сроке 28–32 недели беременности активность каталазы ниже 150 Е/мл плазмы является негативным прогностическим фактором.
При сроке беременности 33–35 недель активность каталазы в I и II группах не различалась, но была достоверно выше, чем в III группе (p=0,0001 и p=0,0003).
Результаты измерения концентрации МДА в плазме крови представлены в табл. 2.
С помощью однофакторного дисперсионного анализа было выявлено достоверное увеличение концентрации МДА в плазме крови с увеличением срока беременности у женщин III группы (F(2,31)=5,3411, p=0,01). При этом в двух других группах данной тенденции не отмечено.
Концентрация МДА во II группе ни на одном из исследуемых сроков гестации достоверно не отличалась от данного показателя в I и III группах.
Следует отметить, что у беременных I группы на сроке 22–27 недель концентрация МДА в плазме крови была достоверно выше по сравнению с контролем (p=0,029), при сроке 28–32 недель наблюдалась тенденция к повышению данного показателя (p=0,069), а при сроке 33–35 недель достоверных различий между данными группами выявлено не было.
Обсуждение
Энергопреобразующий аппарат митохондрий плаценты играет ключевую роль в регуляции энергетического метаболизма плода, контролируя его развитие на всех сроках гестации [12]. Синтезируемая митохондриями АТФ необходима для обеспечения трансплацентарного переноса соединений, используемых развивающимся плодом, а также метаболитов, транспортируемых из крови плода в кровь матери [13, 14]. Вследствие нелинейного характера развития эмбриона, на всех этапах гестации выдерживается тонкий баланс между скоростью продукции макроэргических соединений и потреблением кислорода митохондриями самой плаценты, поскольку плацентарные митохондрии не только отвечают за предоставление свободной энергии в достаточном для удовлетворения изменяющихся запросов плода количестве, но и за поддержание парциального давления кислорода в плаценте на уровне, не превышающем потребностей. Таким образом обеспечивается избегание состояния гипероксигенации и окислительного стресса. Нарушение такого баланса приводит или к снижению транспортной функции плаценты и синдрому задержки развития плода, или к стабилизации состояния хронического окислительного стресса и преждевременным родам [15].
Полученные данные позволяют предположить, что начало родовой деятельности при ПР сопряжено с окислительным стрессом, уровень которого превышает емкость антиоксидантных систем матери либо по причине его высокой интенсивности, либо из-за ослабления самой системы. Дефицит активности каталазы как ключевого звена антиоксидантной защиты периферической крови матери в группе женщин родивших преждевременно, по сравнению с женщинами, сохранившими беременность, может служить одной из причин преждевременных родов. Особенно явно эта закономерность наблюдается на сроке беременности от 28 до 32 недель. Данное предположение подтверждается представленными результатами о повышении уровня МДА, являющегося маркером окислительного стресса, в группе женщин с преждевременными родами на сроках гестации 22–27 и 28–32 недели, когда чаще всего и возникает угроза преждевременных родов.
Заключение
Таким образом, полученные данные указывают на системный характер компенсаторных реакций в организме беременной женщины, направленных на снижение уровня продукции активных форм кислорода ферментом каталазой при угрозе преждевременных родов. Снижение активности каталазы в крови беременных при преждевременных родах указывает на нарушение системы регуляции продукции активных форм кислорода, свидетельствующие об истощении адаптационных ресурсов матери и плаценты.
Повышенный уровень малонового диальдегида на сроках 22–27 недель и пониженная активность каталазы в 28–32 недели могут являться негативными прогностическими признаками при угрозе преждевременных родов. Дальнейшие исследования в данном направлении позволят сформировать регрессионную модель, позволяющую повысить диагностическую точность определения вероятности преждевременных родов и определить выбор соответствующей лечебной тактики.



