Дефицит железа у беременных по-прежнему занимает одну из ведущих позиций в рутинной клинической практике врача акушера-гинеколога. Анемия во время беременности может вызвать неблагоприятные перинатальные исходы, включая преждевременные роды, преждевременное излитие плодных оболочек и повышенную материнскую и фетальную смертность. Физиологическая (дилюционная) анемия и железодефицитная анемия являются двумя наиболее распространенными ненаследственными формами анемии, а некоторые случаи могут быть результатом сопутствующих заболеваний, таких как диабет [1]. В рутинной клинической практике врача, ведущего беременность, важно помнить, что анемия – это не всегда дефицит именно железа, или не только железа. Хотя, безусловно, именно дефицит железа у беременных является ведущей причиной и самой частой. Анемии бывают связаны с дефицитами: меди, лития, тиамина, рибофлавина, витаминов В12, В9, молибдена, марганца, белка, витамина С. И это далеко не полный список. Поскольку витаминами и микроэлементами, участвующими в регуляции системы кроветворения, являются также кальций, магний, кобальт, витамины K, B6, B5, D, E, омега‑3, омега‑6 жирные кислоты [2, 3].
Помимо дефицитных анемий, необходимо учитывать и другие более редкие виды анемий, ассоциированных в части случаев с генетическими факторами, или с хроническими/острыми заболеваниями, влияющими на систему кроветворения. А в части случаев и с особенностями беременности, такими как неадекватная продукция эритропоэтина – как физиологическая особенность во время беременности. Также необходимо помнить об анемии хронического воспаления, которая протекает с нормальным или высоким уровнем ферритина и в современных условиях получила довольно широкое распространение [1, 4].
Дефицит железа (ДЖ) у беременных может развиваться на любом сроке гестации вследствие повышенного расходования и/или недостаточного поступления железа в организм. При этом необходимо помнить, что уже давно существуют четко разработанные нормы и градации по дефициту железа у беременных, где выделяют предлатентный (ПДЖ), латентный (ЛДЖ) и манифестный (МДЖ) варианты ДЖ [6]. Частота железодефицитной анемии (ЖДА) у беременных в мире в среднем колеблется от 25 до 50%. В развивающихся странах ее распространенность у женщин репродуктивного возраста составляет 40–50%, а в развитых – до 18–20% [1, 3]. Различные авторы полагают, что к концу беременности ДЖ развивается у всех без исключения беременных [1, 3, 6].
Материалы и методы
Проведено наблюдательное исследование 90 беременных с различными формами ДЖ (ПДЖ, ЛДЖ, МДЖ), наблюдавшихся в нашей клинике по беременности. Они были разделены на 3 группы (I, II, III) в соответствии с триместрами беременности по 30 человек в каждой группе.
Критериями исключения были беременные с ВИЧ, получавшие антиретровирусную терапию, а также беременные с онкогематологическими заболеваниями в анамнезе.
Всем беременным проводилось клиническое обследование и наблюдение в соответствии с существующими федеральными клиническими протоколами [5].
Подавляющее большинство беременных исследуемых групп относились к группе высокого риска развития осложнений.
Так, гестационный сахарный диабет был выявлен у 38/90 (42,2%) беременных, гипотиреоз, проявившийся во время беременности, – у 31/90 (34,4%) беременной. Привычное невынашивание беременности в анамнезе имели 76/90 (84,4%) беременных, из которых у 32/76 (42%) невынашивание проявилось антенатальной гибелью плода как минимум в одном эпизоде потери беременности.
Предшествующее этой беременности первичное или/и вторичное бесплодие отметили 65/90 (72,2%) беременных; при этом методы вспомогательных репродуктивных технологий были использованы у 34/65 (52,3%) из них.
Для выявления варианта ДЖ мы оценивали уровень сывороточного ферритина (СФ), сывороточного железа (СЖ), трансферрина, общую железосвязывающую способность сыворотки крови (ОЖСС), показатели клинического анализа крови: гемоглобин (Hb), эритроциты (Э), гематокрит (Ht), показатель MCV (средний объем эритроцита), MCHC (среднее количество гемоглобина в эритроците). Для оценки варианта ДЖ (ПДЖ, ЛДЖ, МДЖ) мы использовали критерии федерального клинического протокола [6].
После выявления ДЖ и верификации его варианта (ПДЖ, ЛДЖ, МДЖ) мы проводили коррекцию наиболее активной, биодоступной пероральной формой железа – железа фумарат (эквивалентно 50 мг железа элементного) в комбинации с фолиевой кислотой 500 мкг (препарат «Ферретаб комп.») по схеме согласно инструкции по применению – 1 таблетка в сутки. Мы назначали прием в 16 ч, за 2 ч до приема пищи, запивая водой с лимоном. Учитывая наличие фолиевой кислоты в составе препарата, являющейся кофактором для метаболизма железа мы пересматривали в индивидуальном порядке всю нутрицевтическую поддержку, дабы не превышать суммарные дозировки фолатов, рекомендованные во время беременности. Нутрицевтическая поддержка беременности осуществлялась в расширенном варианте, согласно клиническому протоколу «Нормальная беременность», поскольку в исследовании не было беременных не относящихся к группам риска по дефициту факторов питания [5]. Мы оценивали эффективность терапии фумаратом железа через 21 день по лабораторным показателям.
Результаты
Средний возраст беременных в группах исследования составил от 27 до 49 лет (35±0,5 лет).
При обследовании выявлена высокая частота патологии желудочно-кишечного тракта. Наиболее часто встречался хронический гастрит. Его частота среди пациенток I, II и III групп составила 13/30 (43,3%), 15/30 (50%) и 13/30 (43,3%) соответственно. У этих же пациенток (с патологией желудочно-кишечного тракта) отмечались наиболее низкие стартовые показатели обмена железа.
При анализе репродуктивной функции мы отметили наиболее низкие стартовые показатели уровня железа среди пациенток, паритет беременностей и родов, у которых был 2 и выше (5/30 (16,6%) – в I группе, 6/30 (20%) – во II группе и 6/30 (20%) – в III группе).
Исходя из показателей исходных нарушений обмена железа, можно утверждать, что в целом группы были однородны по степени выраженности дефицита железа перед началом терапии, однако мы отметили следующие особенности.
ПДЖ ожидаемо чаще встречался среди первично обратившихся беременных в I триместре беременности по сравнению с беременными II и III триместрах беременности. Так в I группе ПДЖ был выявлен у 25/30 (83,3%), во II группе – у 18/30 (60%), и в III группе – у 7/30 (23,3%) беременных.
ЛДЖ был выявлен у 4/30 (10%) беременных I группы, у 8/30 (26,7%) беременных II группы, у 15/30 (50%) беременных III группы.
МДЖ был диагностирован всего у 1/30 (3,3%) беременных I группы, в отличии от 4/30 (13,3%) пациенток II группы и 8/30 (26,7%) пациенток III группы, где встречался значительно чаще.
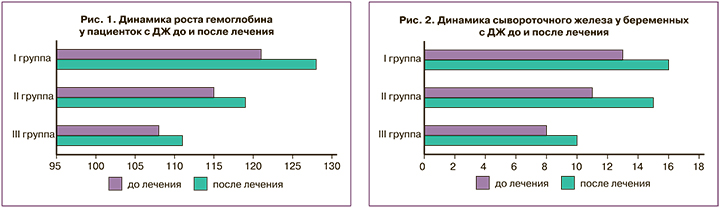
Анализируя результаты полученных данных (таблица) отметили наиболее выраженный эффект был получен среди пациенток I и II группы, начавших терапию на более ранних сроках беременности, в отличие от пациенток III группы. Вероятно, это связано, как со сроком беременности и выраженностью ДЖ, так и с более выраженным дефицитом кофакторов усвоения железа у пациенток в III триместре беременности (витамины группы В, белок и т.д.), а также особенностью пищеварения с увеличением срока беременности [2].
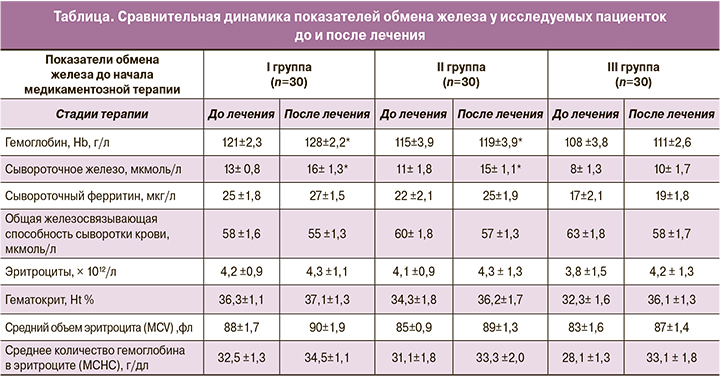
При анализе гематологических и феррокинетических показателей отмечен наиболее выраженный прирост гемоглобина (рис. 1), сывороточного железа (рис. 2), ОЖСС, гематокрита. Немного медленнее нарастал уровень ферритина. Мы полагаем, что для объективной оценки динамики роста ферритина необходимо так же оценивать концентрацию белка в сыворотке крови и уровень кофакторов усвоения железа и формирования морфологии эритроцитов (витамин С, фолиевая кислота, медь, цинк, литий). Необходимо отметить, что пациенток с анемией, при которой мы выявили снижение количества эритроцитов и изменение их морфологических характеристик (анизоцитоз, микроцитоз) изначально было крайне малое количество (отсутствие таких женщин в I группе, 1 и 3 беременных, во II и III группах соответственно) (таблица).
Следует отметить хорошую клиническую переносимость фумарата железа у беременных с ДЖ. Побочные эффекты в виде диспепсии (изменение вкусовых ощущений) были отмечены всего у 1/30 (3,3%) пациенток I группы, 2/30 (6,6%) беременных II группы и у 4/30 (10%) пациенток III группы. Ситуаций, потребовавших бы отмены препарата, и усугубления патологии ЖКТ у женщин с гастритами в анамнезе не было.
Заключение
По результатам проведенного наблюдательного исследования мы полагаем, что препарат, содержащий фумарат железа и фолиевую кислоту, может эффективно применяться для профилактики и лечения различных стадий дефицита железа во время беременности начиная с I триместра. Более ранняя дотация железа (в том числе профилактическая, на стадии ПДЖ и ЛДЖ) позволяет получить быстрый и выраженный положительный эффект.



