Бактериальный вагиноз – это инфекционный невоспалительный синдром полимикробной
этиологии, связанный с дисбиозом вагинального биотопа, который характеризуется резким
увеличением облигатно- и факультативно-анаэробных условно-патогенных микроорганизмов и
количественным снижением или полным исчезновением лактобактерий, особенно перекись-
продуцирующих. Этиологическими агентами бактериального вагиноза наиболее часто являются микроаэрофильные – Gardnerella vaginalis (G. Vaginalis), облигатно-анаэробные грамположительные (Mobiluncus species; Peptostreptococcus species и др.) и грамотрицательные бактерии (Prevotella spp., Bacteroides spp. и Fusobacterium spp.) Частым спутником бактериального вагиноза также являются генитальные микоплазмы: одновременное выявление G. vaginalis и Mycoplasma hominis наблюдается у 30,6% больных, G. vaginalis и Ureaplasma urealyticum – у 53,8% больных. Как правило, при лабораторных исследованиях удается идентифицировать ассоциации различных микроорганизмов, при этом микроорганизмы взаимодействуют по прин ципу
симбиоза [1, 3].
В течение длительного времени представления о составе вагинальной микрофлоры базирова
лись на результатах бактериологических методов анализа исследуемого материала и выделения
микроорганизмов. Применение молекулярнобиологических методов исследования показало,
что не все микроорганизмы вагинального биотопа, которые могут играть роль в развитии различных патологических состояний, были идентифицированы ранее.
Одним из не выявляемых ранее при использовании культуральных методов диагностики
микроорганизмов вагинального биотопа, является Atopobium vaginae (A. Vaginae). Впервые название рода Atopobium было предложено английскими учеными Collins и Wallbanks в 1992 г., что послужило причиной объединения описанных ранее разными авторами Lactobacillus
minutus (Hauduroy, 1937), Lactobacillus rimae (Olsen, 1991) и Streptococcus parvulus (Weinberg, 1937). При дальнейших исследованиях представители рода Atopobium были изолированы из ротовой полости человека (Atopobium rimae, Atopobium parvulum) и выявлены при ряде инфекционных процессов, например при абсцессах малого таза, ротовой полости и инфицировании ран [4, 10].
Первые находки A. vaginae в вагинальном содержимом женщин рассматривались как выделение
нового представителя нормальной микрофлоры влагалища рода Lactobacillus, что было следствием выявления некоторой перекись-продуцирующей активности микроорганизма [12, 13]. Затем появились сообщения об обнаружении A. vaginae при различных патологических состояниях. Выделенный микроорганизм от женщины с тубоовариальным абсцессом имел схожие свойства с A. vaginae. Интересно, что установить бактериальную этиологию при развитии воспалительных заболеваний органов малого таза методом пункции заднего свода влагалища до этого случая не удавалось, за исключением Escherichia coli и Chlamydia trachomatis [6]. Такой же микроорганизм был найден в крови и амниотической оболочке при инфекционном процессе. Дальнейшие исследования A. vaginae показали, что это не столько представитель нормального вагинального биотопа, а скорее возможный признак, по меньшей мере, неблагополучия состава микрофлоры.
В связи с вышеизложенным, в последние годы были пересмотрены и подходы к диагностике бактериального вагиноза. Широко распространенный за рубежом метод оценки вагинальной микрофлоры Ньюджента, основанный на оценке количественного соотношения анаэробной микрофлоры к лактоморфотипам в вагинальных мазках, окрашенных по Граму, оказался неинформативным для идентификации Atopobium. Еще менее информативным для выявления микроорганизма являлся метод Амсела, изначально рассчитанный на выявление патогномоничных клинических и лабораторных признаков заболевания.
Идентификация A. vaginae культуральным методом сопряжена с трудностями, обусловленными
анаэробными свойствами микроорганизма, а также сходством с Corynebacterium, не слишком
специфичной морфологией при микроскопии мазка, окрашенного по Граму, и макроскопическими свойствами культуры.
Именно этими особенностями микроорганизма и сложностями диагностики объясняется только
недавнее его обнаружение. Анализ вагинального содержимого с использованием универсальных
бактериальных праймеров при помощи 16S РНК тотальной амплификации, последующая оценка
результатов с помощью электрофореза на геле позволили обнаружить новый микроорганизм.
И на сегодняшний момент только методы молекулярной диагностики позволяют обнаруживать
A. vaginae при исследовании вагинального содержимого [7, 9].
Согласно современным отечественным и зарубежным рекомендациям, в терапии бактериального вагиноза в настоящее время применяются препараты группы 5-нитроимидазолов и клиндамицин. При этом по результатам исследований было продемонстрировано, что A. vaginae с высокой частотой проявляет устойчивость к метронидазолу, являясь чувствительным только к одному из
рекомендованных препаратов – клиндамицину.
Согласно исследованию M. Ferris, A. vaginae демонстрировал устойчивость к метронидазолу (минимальная ингибирующая концентрация более 32 мг/мл) и аминогликозидам, слабый уровень чувствительности – к цефтриаксону и цефоксину (в среднем 2 мг/мл), умеренную чувствительность – к антибактериальным препаратам группы карбопенемов (меропинему, имипенему) и ампициллинов и высокий уровень чувствительности (менее 0,015 мг/мл) – к клиндамицину.
В аналогичном исследовании при сравнении 9 различных штаммов A. vaginae, выделенных от
разных пациенток, чувствительность к метронидазолубыласлабовыражена,аминимальнаяингиби-
рующая концентрация варьировалась от 2 до более 256 мг/мл. Когда отметка 16 мг/мл была принята за границу между чувствительностью и устойчивостью микроорганизма, оказалось, что только 4 штамма из 9 могли считаться чувствительными и слабочувствительными. Все штаммы также оказались устойчивыми к налидиксовой кислоте. Была зарегистрирована убедительная чувствительность к клиндамицину (0,016 мг/ мл), а также рифампицину, азитромицину и пенициллину [2, 8].
Однако, если первые результаты изучения микроорганизма свидетельствовали об устойчивости
A. vaginae к метронидазолу, то недавние исследования демонстрируют, что устойчивость не является
отличительным и абсолютным свойством этого микроорганизма, так как некоторые штаммы все
же могут проявлять чувствительность. Механизм формирования резистентности пока не ясен, возможно, в ее формировании играют роль мутации и активация генов устойчивости к метронидазолу
(nim-genes) [5, 11].
Все вышеизложенное диктует необходимость разработки и внедрения в практику новых возможностей терапии бактериального вагиноза. Одним из лекарственных препаратов, доказавших свою эффективность в терапии различных инфекционных заболеваний урогенитальной системы,
является гексикон. Вагинальные суппозитории гексикон представляют собой антисептический
препарат для местного применения и содержат в качестве активного вещества хлоргексидина биглюконат. Основа препарата представлена полиэтиленоксидами с различной степенью полимеризации, матричная структура которых способствует активной адсорбции экссудата,
быстрому проникновению в ткани действующего вещества суппозиториев и подавлению роста
микроорганизмов в очаге воспаления. Механизм действия гексикона заключается в диссоциации
солей хлоргексидина в физиологической среде и освобождении катионов с последующим их связыванием с отрицательно заряженными оболочками бактерий. Даже в низких концентрациях
гексикон способен вызывать нарушение осмотического равновесия бактериальных клеток, потерю ими калия и фосфора, что служит основой его бактерицидного эффекта. Таким образом, нарушение осмотического давления внутри микробной клетки является главным механизмом,
определяющим бактерицидное действие препарата.
С целью оптимизации терапии бактериального вагиноза, ассоциированного с A. vaginae, было
проведено исследование эффективности и безопасности препарата гексикон (суппозитории ваги-
нальные), по сравнению с эффективностью и безопасностью традиционной терапии (метронидазол,
клиндамицин).
Материал и методы исследования
В исследование были включены 60 женщин, которые были рандомизированы в 3 группы,
согласно назначаемой терапии:
– 1-я группа – 20 пациенток, которым проводили терапию препаратом метронидазол гель 0,75%
интравагинально в дозе 5 г 1 раз/сут в течение 5 дней;
– 2-я группа – 20 пациенток, которым проводили терапию препаратом клиндамицин крем 2%
интравагинально в дозе 5 г 1 раз/сут в течение 7 дней;
– 3-я группа – 20 пациенток, которым проводили терапию препаратом гексикон по 1 суппозиторию интравагинально 2 раза/сут в течение 7 дней.
Комплекс лабораторных исследований включал в себя микроскопическое исследование клинического материала из уретры, боковых и заднего сводов влагалища, цервикального канала и прямой кишки; бактериологическое исследование для идентификации Neisseria gonorrhoeae, Trichomonas vaginalis, условно-патогенных и непатогенных (Lactobacillus spp.) микроорганизмов; исследование методом полимеразной цепной реакции (ПЦР) для идентификации Chlamydia trachomatis и Mycoplasma genitalium; серологическое исследование на сифилис и вирус иммунодефицита человека. Всем пациенткам проводили исследование вагинального отделяемого для идентификации A. vaginae, G. vaginalis методом ПЦР в режиме реального времени.
Диагноз бактериального вагиноза устанавливался в соответствии со следующими критериями:
жалобы на вагинальные выделения, дискомфорт в области половых органов; наличие при объективном обследовании гомогенных вагинальных выделений с характерным «рыбным» запахом; обнаружение «ключевых клеток» при микроскопическом исследовании; значение рН вагинального отделяемого более 4,5; положительный результат аминотеста.
Основным критерием включения в исследование являлась идентификация A. vaginae в клиническом
материале (вагинальном отделяемом), полученном у пациенток.
Результаты исследования и обсуждение
На момент обращения за медицинской помощью длительность заболевания у пациенток составляла
от 2 дней до 1 месяца. Основными субъективными проявлениями заболевания являлись патологические выделения из половых путей сливкообразного характера с неприятным запахом у 20 (100,0%) пациенток 1-й группы, у 19 (95,0%) – 2-й группы и у 20 (100,0%) пациенток 3-й группы. Также пациентки предъявляли жалобы на диспареунию (в 10,0% наблюдений) и дискомфорт в области половых органов (в 15,0% наблюдений). У всех пациенток, включенных в исследование, при микроскопическом исследовании вагинального мазка были выявлены «ключевые клетки». Положительный результат аминотеста при обследовании определялся у 19 (95,0%) пациенток 1-й группы и у 100% пациенток 2-й и 3-й групп. Также у большинства пациенток был выявлен повышенный уровень рН вагинального отделяемого – более 4,5.
При качественной оценке состава вагинальной микрофлоры при микроскопическом исследовании, а также при исследовании методом ПЦР в режиме реального времени были получены следующие результаты: A. vaginae был идентифицирован у всех пациенток, включенных в исследование,
G. vaginalis – у 19 (95,0%) пациенток 1-й группы, у 18 (90,0%) – 2-й группы и у 19 (95,0%) пациенток 3-й группы. В меньшем проценте наблюдений выявлялись другие микроорганизмы, ассоциированные с бактериальным вагинозом – Mobiluncus (75,0–90,0%) и Leptotrix (85,0–100,0%).
Также в процессе исследования была проведена оценка лактобациллярной составляющей
вагинальной микрофлоры. Согласно результатам исследования, у подавляющего большинства
пациенток (75,0–85,0%) представители семей ства Lactobacillaceae не определялись; у 3 (15,0%) пациенток 1-й группы, у 2 (10%) – 2-й группы и у 2 (10,0%) пациенток 3-й группы число лактобацилл находилось на уровне 102–103 КОЕ/мл, а у 2 (10,0%), 2 (10,0%) и 1 (5,0%) пациенток исследуемых групп соответственно – на уровне 104–105 КОЕ/мл.
Через 7–10 дней после окончания терапии была проведена оценка субъективных и объективных
клинических показателей, а также выполнены лабораторные исследования.
Согласно результатам опроса пациенток было установлено, что 4 (20,0%) пациентки 1-й группы, 2 (10,0%) пациентки 2-й группы и 1 (5,0%) пациентка 3-й группы предъявляли жалобы на выделения из половых путей; также 2 (10,0%) пациентки 1-й группы и 1 (5,0%) пациентка 2-й группы свидетельствовали о зуде и жжении во влагалище после проведенной терапии. В 3-й группе только одна пациентка свидетельствовала о дискомфорте в области половых органов.
При оценке характера вагинальных выделений были получены следующие данные: у 2 (10,0%)
пациенток 1-й группы, 1 (5,0%) пациентки 2-й группы и 1 (5,0%) пациентки 3-й группы вагинальные выделения имели сливкообразный характер и неприятный «рыбный» запах, характерный для бактериального вагиноза. У 2 (10,0%) пациенток 1-й группы и 1 (5,0%) пациентки 2-й группы вагинальные выделения были творожистыми и сопровождались гиперемией и отечностью слизистой оболочки влагалища. Положительный результат аминотеста был выявлен у 2 (10,0%) пациенток 1-й группы, значение рН вагинального отделяемого превышало норму у 4 (20,0%) пациенток 1-й группы, у 1 (5,0%) – 2-й группы и у 1 (5,0%) пациентки 3-й группы (рис. 1).
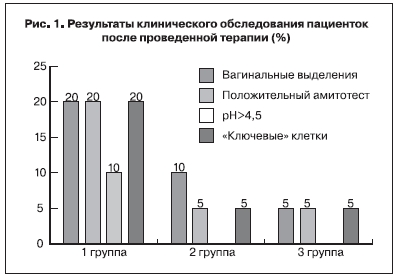
Таким образом, клинические признаки бактериального вагиноза после проведенного лечения
были зарегистрированы у 2 (10,0%) пациенток 1-й группы, у 1 (5,0%) – 2-й группы и у 1 (5,0%) пациентки 3-й группы. У 2 (10,0%) пациенток 1-й группы и у 1 (5,0%) пациентки 2-й группы, кроме того, были выявлены клинические признаки кандидозного вульвовагинита.
При микроскопическом исследовании «ключевые клетки» обнаруживались в вагинальном
отделяемом у 4 (20,0%) пациенток 1-й группы, у 1 (5,0%) – 2-й группы и у 1 (5,0%) пациентки 3-й
группы, что также подтверждало диагноз бактериального вагиноза у обследованных женщин.
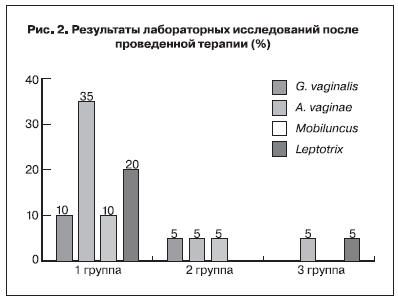
При качественной оценке вагинальной микрофлоры было показано, что A. vaginae был идентифицирован в вагинальном отделяемом у 7 (35,0%) пациенток 1-й группы, у 1 (5,0%) – 2-й группы и у 1 (5,0%) пациентки 3-й группы. Другие микроорганизмы, ассоциированные с бактериальным вагинозом, у пациенток 1-й группы выявлялись реже (в 10,0–20,0% наблюдений), что, однако превышало показатели 2-й и 3-й групп (5,0%) (рис. 2).
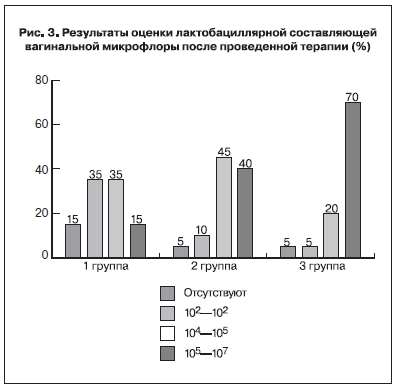
Оценка лактобациллярной составляющей вагинальной микрофлоры после проведенной
терапии продемонстрировала, что нормализация показателей (число лактобацилл на уровне
105–107 КОЕ/мл) была достигнута у 3 (15,0%) пациенток 1-й группы, у 8 (40,0%) – 2-й группы
и у большинства (70,0%) пациенток 3-й группы. Также обращало на себя внимание, что у 15,0% пациенток 1-й группы представители семейства Lactobacillaceae не определялись, в других группах этот показатель был равен 5,0% (рис. 3).
При оценке нежелательных лекарственных явлений было продемонстрировано, что на фоне
лечения у 2 (10,0%) пациенток 1-й группы и у 1 (5,0%) пациентки 2-й группы развился кандидозный вульвовагинит, что было подтверждено результатами лабораторных исследований.
При мониторинге показателей жизненных функций клинически значимых отклонений не было
выявлено ни у одной из обследованных.
Таким образом, при контрольном обследовании клиническая эффективность терапии была
достигнута у 80,0% пациенток 1-й группы, у 95,0% пациенток 2-й группы и у 95,0% пациенток 3-й
группы. Лабораторные показатели, свидетельствующие об отсутствии признаков бактериального
вагиноза, были зарегистрированы также у 80,0% пациенток 1-й группы, у 95,0% пациенток 2-й
группы и у 95,0% пациенток 3-й группы, при этом эрадикация A. vaginae наблюдалась у 65,0% пациенток 1-й группы, у 95,0% пациенток 2-й группы и у 95,0% пациенток 3-й группы. Нормализация показателей лактобацилярной микрофлоры была достигнута у 70,0% пациенток 3-й группы, что значительно превышало показатели других групп.
Побочные лекарственные явления (развитие кандидозного вульвовагинита) были зарегистрированы только у пациенток 1-й и 2-й групп.
Выводы
1. Клинико-лабораторная эффективность терапии бактериального вагиноза, ассоциированного
с A. vaginae, вагинальными суппозиториями гексикон составляет 95,0%, является сопоставимой с
препаратом выбора – клиндамицином (95,0%) и превышает таковую при использовании метронидазола (80,0%).
2. Эрадикация A. vaginae при терапии вагинальными суппозиториями гексикон является сопоставимой с клиндамицином (95,0 и 95,0% соответственно) и значительно превышает таковую при использовании метронидазола (95 и 65%).
3. Нормальные показатели лактобациллярной составляющей вагинального микроценоза после
терапии вагинальными суппозиториями гексикон наблюдались у 70,0% пациенток, после терапии
клиндамицином – у 40,0%, после терапии метронидазолом – у 15,0% пациенток.
4. Препарат гексикон обладает высокими показателями безопасности и переносимости.



