В структуре акушерско-гинекологической заболеваемости воспалительные процессы нижних отделов генитального тракта занимают одно из ведущих мест, являясь причиной различных патологических состояний репродуктивной системы [1, 2]. В последние годы исследования многих авторов свидетельствуют о возросшей роли различных микроорганизмов и их ассоциаций в развитии воспалительных заболеваний органов нижнего отдела половых путей. Известно, что причиной вульвовагинитов и цервицитов могут быть не только абсолютные патогены (Chlamydia trachomatis, Neisseria gonorrhoeae, Trichomonas vaginalis и др.), но и условно-патогенные микроорганизмы (E. coli, Corynebacterium, Enterococcus spp., Streptococcus spp., Staphylococcus spp., Candida spp. и др.), встречающиеся в норме во влагалище здоровой женщины. По данным А.С. Анкирской каждая пятая пациентка гинекологической практики обращается в связи с неспецифическим вагинитом, а среди пациенток с патологическими белями частота его выявления возрастает в 4 раза [3]. В этой связи пристальное внимание исследователей обращено к изучению различных аспектов вышеуказанных патологических состояний.
В значительной степени развитие инфекционного процесса определяется состоянием мукозального иммунитета и зависит от иммунологической реактивности макроорганизма. В возникновении заболевания микробный фактор играет такую же роль, как и состояние макроорганизма и те обстоятельства, которые изменяют его иммунобиологические свойства [4]. К факторам, которым отводится существенная роль в поддержании вагинальной экосистемы, можно отнести функционирование иммунокомпетентных клеток и продукцию ими биологически активных соединений, таких как дефензины, иммуноглобулины и цитокины. Цитокины, как медиаторы взаимодействия клеток, служат основными регуляторами иммунных реакций и отражают состояние локального иммунитета. В настоящее время накоплены многочисленные данные о зависимости экспрессии цитокинов не только от патогенных факторов, но и от генетической вариабельности кодирующих их генов.
В частности накоплены данные об ассоциациях отдельных полиморфизмов генов цитокинов с такими нозологическими формами как вульвовагинальный кандидоз [5] и бактериальный вагиноз [6–10]. В данной работе различные нозологические формы вагинитов были исследованы в совокупности, включая случаи воспаления неустановленной этиологии. Использование такого подхода обосновано тем, что зачастую воспалительная реакция является неспецифической в отношении инициирующего патологического агента, поскольку в иммунном ответе в первую очередь задействованы механизмы врожденного иммунитета.
Цель работы: установить распределение аллельных вариантов генов иммунного ответа, ассоциированных с предрасположенностью к развитию вагинитов у женщин репродуктивного возраста.
Материал и методы исследования
Проведено комплексное клинико-лабораторное обследование 156 пациенток в возрасте от 19 до 45 лет (средний возраст 29,8±5,2 года), обратившихся в научно-поликлиническое отделение ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России в период с июня 2012 по июль 2013 г., которое включало: сбор анамнестических данных, жалоб пациентки, осмотр слизистой вульвы, влагалища и шейки матки, бимануальное гинекологическое исследование, а также микроскопию мазков, окрашенных по Граму, исследование микрофлоры влагалища методом количественной полимеразной цепной реакции (ПЦР) в режиме реального времени. Критерии исключения из исследования – наличие патогенов: C. trachomatis, T. vaginalis, N. gonorrhoea, M. genitalium, T. pallidum. На основании полученных данных сформированы следующие группы пациенток:
- I группа сравнения – условно здоровые женщины без признаков воспалительных заболеваний половых путей (n=60).
- II группа – женщины с признаками вагинита (n=96). Вагинит был ассоциирован с вульвовагинальным кандидозом в 26,1% случаев, с наличием аэробных бактерий в 7,3%, анаэробных бактерий в 13,5%, с сочетанными формами аэробных и анаэробных бактерий в 8,3%, с сочетанными формами грибов и бактерий в 22,9%, с Ureaplasma spp. в количестве более 4lg ГЭ/мл в 3,1%, вагинит неясной этиологии имел место в 18,8% случаев.
Материалом для исследования аллельного полиморфизма генов были образцы периферической крови пациенток с добавленным в качестве консерванта раствором ЭДТА. Для определения полиморфизмов (замены одиночных нуклеотидов, single-nucleotide polymorphism – SNP) ДНК выделяли из ядер лимфоцитов по методу Higuchi [11] с модификацией. Метод основан на разрушении лимфоцитов с помощью лизирующего буфера, не влияющего на целостность мембран ядер лимфоцитов. ДНК из ядер выделяли с использованием наборов «Проба ГС» (ДНК-Технология, Россия). Для определения замен одиночных нуклеотидов использована ПЦР с плавлением продуктов реакции в присутствии «примыкающих» олигонуклеотидов (вариант метода adjacent probes, kissing probes) на реагентах и оборудовании производства ООО «НПО ДНК-Технология» (Москва). Особенностью реагентов данного производителя является получение кривых плавления по двум каналам флуоресценции (FAM и HEX), что повышает достоверность полученных результатов.
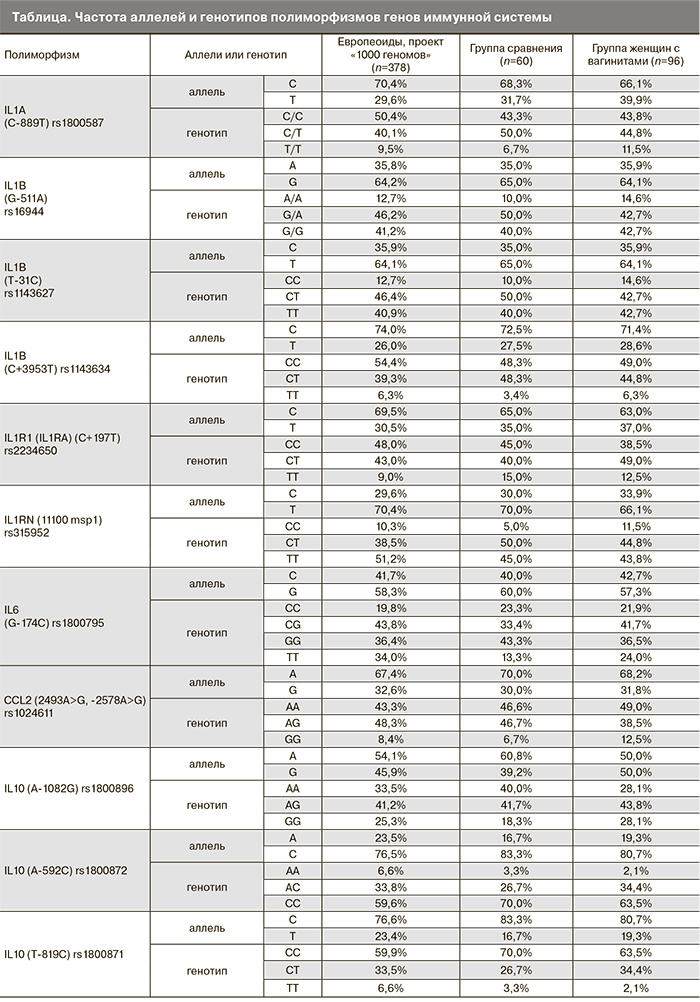
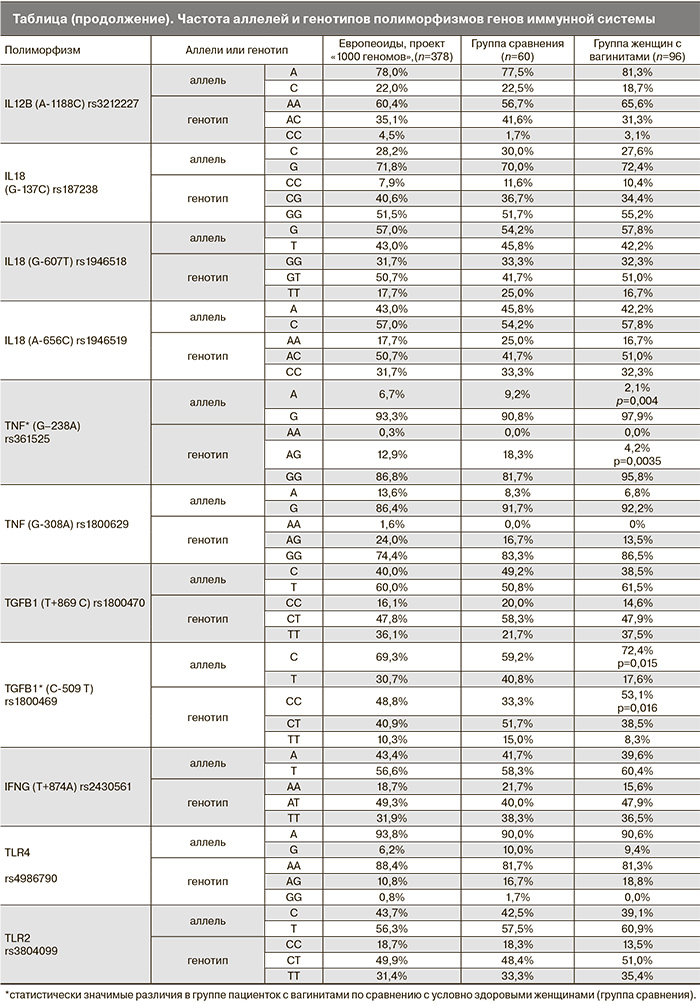
Исследованы следующие полиморфизмы: IL1A (rs1800587), IL1B (rs1143627, rs1143634, rs16944), IL1R1или IL1RA (rs2234650), IL1RN (rs315952), IL6 (rs1800795), IL10 (rs1800871, rs1800872, rs1800896), IL12B (rs3212227), IL18 (rs187238, rs1946518, rs1946519), INFG (rs2430561), TNF(rs1800629, rs361525) и TGFB1 (rs1800469, rs1982073=rs1800470), TLR2 (rs4986790), TLR4 (rs3804099), CCL2 (rs1024611).
Статистическую обработку данных проводили с помощью свободно распространяемого продукта WINPEPI версия 9.7 и SPSS 17.0 для Windows. Оценку соответствия выявленных частот генотипов закону Харди–Вайнберга проводили по критерию χ2-квадрат в сравнении с ожидаемыми частотами генотипов равновесного распределения. При попарном сравнении частот генотипов и аллелей между собой использовали точный критерий Фишера.
Статистическую ошибку распределения частот аллелей вычисляли по формуле: sp=sqrt(p*(1–p)/2N) (формула 1), где р – частота аллеля, N – число индивидов в выборке.
Для оценки ассоциаций рассчитывали отношение шансов (OR) по формуле: OR=ad/bc (формула 2), где а — число лиц с наличием анализируемого маркера среди больных; b — его отсутствие среди больных; c и d — число лиц соответственно с наличием и отсутствием маркера в контрольной группе.
Величина ОR=1 указывает на отсутствие ассоциации, ОR>1 – имеет место при положительной ассоциации (фактор риска) и ОR<1 – отрицательная ассоциация аллеля (или генотипа) с заболеванием (протективный фактор).
Отношение шансов (OR) приведено с 95% доверительным интервалом (CI).
Результаты исследования
Распределение частот генотипов для всех полиморфизмов группы сравнения соответствовало ожидаемым частотам генотипов равновесного распределения по закону Харди–Вайнберга. При сравнении результатов исследования в группе сравнения с данными литературы наилучшее соответствие получено для распределения аллелей в европейской популяции. Полученные данные о частотах встречаемости аллелей однонуклеотидных полиморфизмов в генах, продукты которых обеспечивают иммунный ответ, в группах исследования представлены в таблице. Помимо этого в таблице представлены данные о частотах аллелей и генотипов в европейской популяции.
Полученные нами данные о частотах встречаемости аллелей однонуклеотидных полиморфизмов в генах иммунной системы, в группе сравнения соответствуют данным по Европе за исключением локуса TGFB1–509 C>T. Частота аллеля С локуса TGFB1–509 C>T в 1,2 раза ниже в исследуемой группе сравнения, чем в популяции европеоидов (OR=0,54 (СI:0,36-0,8), р=0,028).
Частоты встречаемости аллелей при вагинитах сопоставлены с частотами встречаемости в группе сравнения. В группе женщин с вагинитами выявлены достоверные различия для аллеля А локуса TNF –238 G>A(OR=0,21 (CI: 0,07-0,68), p=0,004) и аллеля С локусаTGFB1 –509 C>T (OR=1,8 (CI: 1,1-2,9), p=0,015) (табл. 1).
Выявлена положительная ассоциация аллеля С локуса TGFB1 -509 C>T (OR=1,8 (CI: 1,1-2,9), p=0,015) с вагинитом (рис. 1). В группе женщин с вагинитами достоверно чаще отмечен гомозиготный генотип СC (OR=2,3 (CI: 1,2-4,4), p=0,016) по сравнению с условно здоровыми женщинами основной группы сравнения (аутосомно-рецессивная модель).

Помимо этого выявлена отрицательная ассоциация редкого аллеля А локуса TNF–238 G>A(OR=0,21 (CI: 0,07-0,68), p=0,004) с вагинитом (рис. 2). В группе женщин с вагинитами достоверно реже отмечен редкий гетерозиготный генотип GA (OR=0,19 (CI: 0,06-0,64, p=0,0035) по сравнению условно здоровыми женщинами основной группы сравнения (аутосомно-доминантная модель).
По остальным локусам достоверных отличий частот аллелей и генотипов в группе женщин с вагинитами по сравнению с группой сравнения не выявлено. Данные приведены в таблице.
Обсуждение
Полученные нами данные о частотах встречаемости аллелей однонуклеотидных полиморфизмов в генах иммунной системы, в группе сравнения соответствуют данным по Европе за исключением полиморфизма TGFB1 (rs1800469). Частота определения аллеля С локуса TGFB1 -509 C>T в 1,2 раза ниже в исследуемой группе сравнения, чем в популяции европеоидов. Вероятно, полученные расхождения связаны со спецификой смешанной русской популяции и спецификой выборки исследуемой группы сравнения (отсутствие строгого отбора по признаку воспалительных заболеваний половых путей в европейской популяции). Примечательно, что данные по европейской популяции и группе сравнения получены с помощью различных методик: полногеномного секвенирования ДНК и ПЦР соответственно. Косвенным показателем достоверности получаемых результатов может служить оценка соответствия распределения частот генотипов полиморфизма ожидаемым частотам генотипов равновесного распределения по закону Харди–Вайнберга, которое подтверждено в нашем исследовании. Данные по европейской популяции получены по опубликованным результатам Проекта «1000 геномов» [12, 13]. Цель данного проекта состояла в обнаружении, генотипировании и обеспечении точной информацию по гаплотипам полиморфизмов генома человека в различных популяциях: Европа, Восточная Азия, Южная Азия, Западная Африка и Америка. В проекте использованы высокопроизводительные технологии секвенирования «нового поколения». Учитывая объем исследования, описываются не только варианты аллелей, частота встречаемости которых в популяции составляет не менее 1% (классическое определение полиморфизма), но и варианты генов с частотой встречаемости от 0,1%. Участие в проекте принимают 9 Центров, используется 3 технологии секвенирования ДНК: 454 Sequencing (Roche), Solexa/Illumina (Illumina), SOLiD (AppliedBiosystems). В ходе реализации проекта исследуется расположение, частота аллелей и локальная структура гаплотипов около 15 млн. SNP и 1млн. вставок и делеций. Официальные данные по реализации данного проекта представлены на сайте: http://www.ensembl.org/index.html.
При сопоставлении результатов в группе сравнения и в группе женщин с вагинитами достоверные различия получены для полиморфизмов TNF (rs361525) и TGFB1 (rs1800469).
Ген TNF-α картирован на хромосоме 6p21.3, имеет размер 2762 п.н. и содержит 4 экзона. Известны более 30 полиморфных вариантов гена, но только около половины из них влияют на экспрессию TNF-α in vitro. Два полиморфизма в промоторной области гена –238 G>A (rs361525) и –308 G>A (rs1800629) по отношению к сайту начала транскрипции содержат замену гуанина на аденин. В исследованиях этих полиморфизмов in vitro показано увеличение продукции TNF-α в ответ на стимуляцию липополисахаридами [14, 15].
В проведенном нами исследовании установлено, что аллельный вариант A локуса TNF–238 G>A (rs361525) является протективным и встречается реже в группе женщин с вагинитами, чем в группе сравнения. По-видимому, высокая экспрессия TNF в ответ на стимуляцию паттернами условно-патогенных микроорганизмов эффективно стимулирует иммунокомпетентные клетки и способствует своевременной элиминации возбудителя на ранних стадиях заболевания.
Ген TGFB1 картирован на хромосоме 19q13.1, имеет размер 23403 п.н. и содержит 7 экзонов. Продукт этого гена регулирует клеточные процессы пролиферации, дифференцировки, адгезии, апоптоза, миграции, воспаления, фиброза, заживления ран и ангиогенеза [16]. Рецепторы к TGFB1 расположены на многих клетках, поэтому данный пептид является одним из основных регуляторов экспрессии других ростовых факторов, выступая в роли как стимулирующего, так и ингибирующего фактора. По отношению к иммунным клеткам ведет себя, как иммуносупрессорный фактор. Полиморфный вариант Т локуса TGFB1 -509С>T (rs1800469) содержит замену цитозина на тионин и приводит к повышению уровня экспрессии этого цитокина [17]. По-видимому, высокая экспрессия TGF-ß1 способствует своевременной остановке воспалительного процесса и не дает ему перейти в разряд патологических на поздних стадиях заболевания.
Полученные нами данные позволяют рассматривать генетическую предрасположенность к пониженной экспрессии TNF и TGFB1 как факторы риска развития вагинита. Факторы риска развития вагинитов ассоциированы с “дикими” и более распространенными в популяции аллелями, что возможно и обуславливает широкое распространение данной гинекологической патологии.
Таким образом, при вагинитах установлена положительная ассоциация аллеля С локуса TGFB1 -509 C>T (OR=1,8 (CI: 1,1-2,9) по аутосомно-рецессивному типу. Аллель А локуса TNF –238 G>A является протективным в отношении вагинитов по аутосомно-доминантному типу (OR=0,21 (CI: 0,07-0,68)).



