В норме у женщин репродуктивного возраста в составе микрофлоры влагалища доминируют лактобактерии (90–95%). Сдвиг баланса в сторону условно-патогенных микроорганизмов (УПМ) приводит к дисбиотическим состояниям. Дисбиозы могут протекать как без видимых клинических проявлений, так и сопровождаться рядом симптомов, в частности, зудом, жжением, диспареунией, обильными выделениями и неприятным запахом из половых путей. В настоящее время среди дисбиотических состояний принято выделять бактериальный вагиноз (БВ) и неспецифический вагинит (НВ), принципиальной разницей между которыми является наличие воспалительной реакции влагалища и шейки матки.
НВ обусловлены УПМ, такими как грибы, стрептококки, стафилококки, кишечная палочка и др. В последние годы все чаще появляются публикации, в которых БВ рассматривается как одна из причин вагинитов [7, 10, 12]. По данным M.R Anderson, в 30% случаев причина воспаления слизистой оболочки влагалища остается невыясненной [5]. Поэтому идентификация инфекционных агентов при дисбиотических процессах в микробиоценозе влагалища является актуальной задачей клинической лабораторной диагностики.
Тем не менее отсутствие однозначной ассоциации определенных групп УПМ с вагинитом или БВ, позволяет предположить, что существенную роль в развитии того или иного патологического процесса играют особенности локального иммунитета пациентки.
Цель исследования: изучение профиля экспрессии мРНК генов цитокинов в отделяемом влагалища у пациенток с НВ и БВ.
Материал и методы исследования
Проведено клинико-лабораторное обследование 126 женщин в возрасте от 19 до 45 лет (медиана – Ме=29 [25–33]). Методом полимеразной цепной реакции (ПЦР) исключали наличие абсолютных патогенов (Chlamydia trachomatis, Neisseria gonorrhoeae, Trichomonas vaginalis). Пациентки были разделены на группы по следующим критериям:
БВ (n=14): снижение доли лактобактерий менее 80% и увеличение доли облигатно-анаэробных
микроорганизмов свыше 20% по результатам исследования методом «Фемофлор»; выявление
ключевых клеток при микроскопии окрашенного мазка; число лейкоцитов в мазке менее 10 в поле зрения; отсутствие выраженных признаков воспаления слизистой оболочки влагалища и шейки матки при влагалищном исследовании; обильные выделения из половых путей.
НВ (n=86): число лейкоцитов в мазке более 10 в поле зрения; воспалительная реакция со стороны слизистой оболочки влагалища и шейки матки при влагалищном исследовании; наличие хотя бы одной из следующих жалоб: обильные выделения из половых путей, зуд, жжение во влагалище, диспареуния, дизурические расстройства.
Среди пациенток с НВ дополнительно выделяли подгруппы по наиболее вероятной этиологии вагинита: ассоциированный с облигатноанаэробным дисбиозом (n=10); с грибами рода Candida более 103,5 геном-эквивалент – гэ/мл (n=29); смешанной этиологии (облигатно-анаэробный дисбиоз и наличие грибов рода Candida в количестве более 103,5 гэ/мл, (n=18); с факультативно-анаэробным дисбиозом (n=9); без дисбиотических нарушений (n=20).
Группу контроля составили практически здоровые женщины, не предъявлявшие жалоб и не имевшие клинических признаков дисбиотических процессов во влагалище (n=26). Всем пациенткам проводили микроскопию вагинальных мазков, окрашенных по Граму. Взятие биологического материала для ПЦР
(соскобы с заднебоковых стенок влагалища) осуществляли в пробирки с физиологическим раствором. Для исследования состава микробиоты влагалища использовали наборы «Проба ГС» и «Фемофлор» (ДНК-Технология, Россия) согласно инструкции. При количественной оценке биоценоза влагалища учитывали общую бактериальную массу, массу Lactobacillus spp. и 14 основных групп микроорганизмов, представляющих условно-патогенную флору.
Профиль мРНК генов цитокинов в вагинальных мазках исследовали методом ОТ-ПЦР (IL-1b, TNF, IL-8, IL-18, IL-12a, IL-10, IFNG, TGFB1, LIF, а также общий лейкоцитарный антиген CD45). В работе использовались реактивы «Проба НК» и Наборы для обратной транскрипции и амплификации генов цитокинов методом ПЦР в режиме реального времени (ДНК-Технология, Россия) согласно инструкции. Нормировка осуществялась по пяти референсным генам HPRT1, TBP, B2M, GUSB, ABL методом сравнения индикаторных циклов (метод ΔΔCq). За единицу было принято значение Ме в контрольной группе.
При статистической обработке данных в качестве меры центральной тенденции количественных признаков выбрана медиана (Me), а в качестве интервальной оценки – верхний (H) и нижний (L) квартили. Для оценки значимости межгрупповых различий применялся U-критерий Манна-Уитни. Помимо описательной статистики был выполнен дискриминантный анализ с использованием пакета программ Statistica 8.0. Для оценка эффективности классификации и качества модели был проведен ROC-анализ. Критерием выбора порога отсечения выбрано требование максимальной суммарной
чувствительности и специфичности модели.
Результаты исследованияи обсуждение
В структуре жалоб чаще всего встречались обильные выделения (83,3% при НВ и 72,7% при БВ). На втором месте по частоте встречаемости жалоб при НВ отмечалось жжение и диспареуния (47,2 и 14,3% соответственно), тогда как при БВ эти симптомы встречались существенно реже (9,1 и 0% соответственно), хотя из-за малой численности выборки различия не достигали статистической значимости.
Значения и профиль экспрессии мРНК генов цитокинов и СD45 в исследуемых группах представлены на рисунке 1. Было выявлено, что при БВ повышены уровни экспрессии мРНК генов IL-6 более чем в 40 раз (p=6,4 10-5), LIF в 15 раз (p=9,6 10-4), а также IL-8 и IL-10 (соответственно в 2,9 раза, p=0,046 и в 2,5 раза, p=0,001) по сравнению с контрольной группой; а уровень экспрессии мРНК IL-12a и IL-18 был ниже в 10 раз, чем в контроле (p=2,5 10-5 и p=3,5 10-6 соответственно). 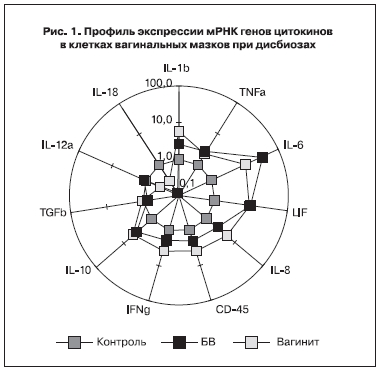
При сравнении пациенток с БВ и НВ, были определены достоверные различия по экспрессии мРНК IL-1β (p=0,0027), IL-8 (p=0,023), TNF (p=0,0028), СD45 (p=6,9 10-4), IFNG (p=0,047). В группе с НВ медианы значений данных цитокинов были 2–3 раза выше, чем у пациенток с БВ (соответственно в 2,1; 1,9; 2,3; 2,9; 2,6). 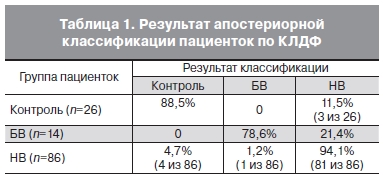
При выполнении пошагового дискриминантного анализа в качестве статистически значимых переменных для дискриминации между группами пациенток (БВ, НВ и контроль) были определены
уровни экспрессии мРНК генов IL-18 (p=1,1x10-7), CD45 (p=2,0 10-4), TGFB1 (p=9,3 10-4), IL-12a
(p=8,6 10-3). Наибольший вклад в дискриминацию совокупностей внесли в первую функцию IL-18 (нормированный коэффициент k=0,78), TGFB1 (k=-0,57), IL-12a (k=0,41), CD45 (k=-0,28); во вторую функцию СD45 (k=-0,94), далее IL-12a (k=-0,65), TGFB1 (k=0,21). Первая функция дискриминирует группу контроля и объединенные группы НВ и БВ, а вторая функция – НВ и БВ (рис. 2 см на вклейке).
Результаты апостериорной классификации рассматриваемых групп пациенток приведены в таблице 1. По результатам классификации по КЛДФ 115 (91,3%) из 126 пациенток были определены правильно.
Для оценки возможности диагностики дисбиотических нарушений с помощью измерения отношения уровня экспрессии мРНК генов IL-10 и IL-18 был использован ROC-анализ. Площадь под ROC-кривой составила 0,945 (0,910–0,980), p=9,9 10-13. Данное значение, согласно экспертной шкале, позволило оценить предложенную модель как отличную.
В качестве порогового значения (точка cut-off) отношения IL-10/IL-18 выбрано значение, соответствующее максимальной сумме чувствительности и специфичности. Пороговое значение
отношения IL-10/IL-18=0,075. Чувствительность и специфичность предложенной модели в области
порогового значения составила 88,0 и 92,3% соответственно. Значения отношения уровней экспрессии выше cut-off классифицировались как маркер дисбиотических процессов микробиоценоза влагалища. По результатам классификации по соотношению IL-10/IL-18 из 126 пациенток 112 (88,9%) были определены правильно (табл. 2). При анализе уровня экспрессии мРНК генов цитокинов у женщин с НВ различной этиоло-
В качестве порогового значения (точка cut-off) отношения IL-10/IL-18 выбрано значение, соответствующее максимальной сумме чувствительности и специфичности. Пороговое значение
отношения IL-10/IL-18=0,075. Чувствительность и специфичность предложенной модели в области
порогового значения составила 88,0 и 92,3% соответственно. Значения отношения уровней экспрессии выше cut-off классифицировались как маркер дисбиотических процессов микробиоценоза влагалища. По результатам классификации по соотношению IL-10/IL-18 из 126 пациенток 112 (88,9%) были определены правильно (табл. 2). При анализе уровня экспрессии мРНК генов цитокинов у женщин с НВ различной этиологии (табл. 3) отмечено достоверное повышение экспрессии мРНК IL-1b, IL-6, IL-8, IL-10, СD45 и достоверное снижение уровня экспрессии мРНК IL-12a и IL-18 во всех подгруппах по сравнению с контрольной группой. Помимо этого в некоторых подгруппах пациенток с НВ было отмечено достоверное повышение экспрессии мРНК TNF, IFNG, LIF.
Таблица 3. Профиль экспрессии мРНК генов цитокинов в клетках вагинальных соскобов.
Локальный уровень цитокинов регулируется как на транскрипционном, так и на трансляционном и посттрансляционном уровнях. Как правило, уровень мРНК цитокина хорошо коррелирует с концентрацией белка и его биологической активностью. В данной работе показано влияние состава микрофлоры на профиль экспрессии генов цитокинов на уровне транскрипции мРНК: При НВ повышается уровень экспрессии мРНК генов провоспалительных цитокинов IL-1b, TNF, IL-6, IL-8, LIF, а также общего лейкоцитарного антигена CD45. Повышение экспрессии мРНК CD45, вероятно, связано с увеличением числа лейкоцитов в вагинальных мазках. Повышение уровня провоспалительных цитокинов (IL-1b, TNF, IL-8) при воспалении, обусловленном УПМ, свидетельствует о ключевой роли врожденного иммунитета и согласуется с концепцией о паттерн-ассоциированых механизмах распознавания чужеродных микроорганизмов [8], согласно которой первоначально распознаются
не индивидуальные антигены, а повторяющиеся структурные компоненты клеточной стенки микроорганизмов (паттерны): пептидогликаны, тейхоевые и липотейхоевые кислоты, зимозан, липополисахариды, липоарабиноманнан и другие, а также фрагменты ДНК. Распознавание образов патогенности осуществляется через паттерн-распознающие рецепторы, взаимодействие с которыми приводит к активации клеток, что отражается на спектре синтезируемых клеткой цитокинов. При классическом пути активации возрастает экспрессия провоспалительных цитокинов: TNF-α, IL-1, IL-6, IL-12, что приводит к повышению бактерицидной активности фагоцитирующих клеток. Активация по II типу приводит к повышению IL-10, TGF-ß и снижению провоспалительных TNF-α, IL-1, IL-6, IL-12 [4].
Вероятно, при дисбалансе влагалищной микрофлоры активация происходит как по классическому провоспалительному пути, так и по II иммуносупрессорному типу. Об этом свидетельствует повышение экспрессии мРНК генов как провоспалительных цитокинов (IL-1b, TNF, IL-6), так и противовоспалительного IL-10.
Согласно современным взглядам, представление антигенов чужеродных микроорганизмов дендритными клетками, стимуляция Th0-лимфоцитов, их дифференцировка и клональная пролиферация по типу Th1-ответа осуществляется в присутствии IL-12 и IL-18 [9]. Принимая во внимание наблюдаемую нами активацию клеток через Toll-like рецептор по классическому пути, ожидалось, что уровни экспрессии мРНК генов IL-12a и IL-18 будут повышены. Однако при БВ и НВ отмечено достоверное снижение
уровней экспрессии мРНК этих генов по сравнению с контрольной группой. Вероятно, это связано со сложными механизмами конечного синтеза IL-12. Помимо того, что концентрация белка IL-12 регулируется на транскрипционном, трансляционном и посттрансляционном уровнях, она также
зависит и от концентрации второй субъединицы IL-12b/p40, являющейся общей с IL-23. Функциональную активность IL-12 связывают с субъединицей IL-12b/p40. Однако количество гетеродимера IL-12, секретируемого клеткой, ограничено субъединицей IL-12α/p35 [4]. Описаны и транскрипционныефакторы, регулирующие транскрипцию двух субъединиц по прин ципу обратной связи [11]. Механизмы регуляции конечного синтеза белка IL-12 могут быть очень сложными, полученные результаты заслуживают внимания и требуют дальнейших исследований.
Помимо этого, при НВ увеличивается экспрессия мРНК гена IFNG, что, по-видимому, связано с активацией Th1-хелперов при кандидозной и бактериальных инфекциях. Однако в общем, уровень экспрессии мРНК гена IFNG в вагинальных мазках даже при НВ невысокий, что может свидетельствовать о том, что роль адаптивного иммунитета в защите от УПМ не является настолько значимой, как предполагалось ранее.
Вероятно, что проблема частых рецидивов НВ и БВ у некоторой категории женщин может быть
связана со спецификой иммунного ответа при данных состояниях. Поскольку ключевая роль принадлежит механизмам врожденного, а не адаптивного иммунитета, иммунологическая память и стойкий иммунный ответ к определенным антигенам УПМ не формируется.
Относительно экспрессии IL-10 в вагинальных мазках в литературе представлены противоречивые мнения. Одни исследователи отмечают понижение уровня данного цитокина при влагалищных дисбиозах [6], другие – повышение [14], третьи различий не видят [13]. В данном исследовании показано достоверно повышение уровня экспрессии мРНК гена IL-10 при БВ и НВ. IL-10 может способствовать увеличению продукции антител, в первую очередь, секреторного IgA. Помимо этого IL-10 обладает свойствами иммуносупрессора и, по-видимому, участвует в регуляции защитных реакций, связанных с контролем гиперактивации воспаления при НВ.
БВ рассматривается как заболевание без признаков воспаления. Некоторые исследователи расценивают его не как инфекционно-воспалительное заболевание, а как синдром и даже как
вариант нормы. Этот взгляд на проблему первоначально был основан на том, что БВ не вызывает такого мощного воспалительного ответа, как трихомониаз или кандидоз. Однако доминирование УПМ приводит к разрушению слизистого слоя (муцина), который является естественным барьером на поверхности эпителия влагалища. При разрушении слизистого слоя обнажается эпителий, что дает возможность УПМ паразитировать на его поверхности. Согласно современным представлениям о дисбиозах, выделяют несколько этапов в развитии инфекционного процесса [1, 2, 3]. Первый этап – это адгезия микробов на эпителиальных клетках. Второй этап – это усиленное размножение микроорганизмов, которое приводит к вагинальному дисбиозу. Если происходит колонизация влагалища преимущественно облигатно-анаэробными бактериями, то речь идет о бактериальном вагинозе. Третий этап – поражение эпителиальных клеток, проникновение УПМ в подлежащие ткани,
индукция местной воспалительной реакции, что клинически манифестируется как вагинит.
Таким образом, БВ является общим невоспалительным синдромом, связанным с дисбиозом. Однако при преодолении УПМ защитных барьеров влагалища возникает местная иммуновоспалительная реакция, именуемая вагинитом. Исходя из этого, мы предполагаем, что оценка уровня экспрессии мРНК генов цитокинов может помочь в постановке более точного диагноза, т.е. дифференцировать БВ от вагинита. По результатам проведенного исследования было показано, что наиболее информативен для дифференциальной диагностики вагинита от БВ показатель уровня экспрессии мРНК гена CD45.
Профили экспрессии мРНК генов цитокинов при БВ и НВ похожи, с более выраженным повышением уровня провоспалительных маркеров при НВ (IL-1b, IL-8, TNF). Это может свидетельствовать о сходных механизмах формирования локального иммунитета на УПМ. Вероятно, БВ не является таким безобидным синдромом, как полагали ранее. Клиническая манифестация дисбиоза, обусловленного облигатно-анаэробными бактериями, может выражаться в виде вагинитов.
Таким образом, дисбиотические процессы во влагалище сопровождаются изменением профиля экспрессии генов цитокинов в клетках влагалищного отделяемого. При дисбиозе наблюдается повышение экспрессии мРНК генов IL-1b, IL-6, IL-8, TNF и LIF, а также CD45 и IFNG, которые являются маркерами воспаления и активации Th1-ответа у данных пациенток. Помимо этого при дисбиотических процессах выявлено повышение уровня экспрессии мРНК гена IL-10 и достоверное снижение уровня
экспрессии мРНК генов IL-12а и IL-18, которые могут быть связаны с иммуносупрессорным действием УПМ на иммунную систему хозяина на транскрипционном уровне. Величина отношения уровня экспрессии мРНК генов IL-10 и IL-18 является значимым диагностическим критерием дисбиотических процессов. В то же время, несмотря на наличие некоторых различий в профилях экспрессии генов цитокинов при дисбиотических состояниях различной этиологии, надежных лабораторных критериев, позволяющих разделить БВ и НВ, найдено не было, что может свидетельствовать об общих патогенетических путях развития дисбиотических процессов во влагалище.



