Истинные аневризмы пуповинных сосудов являются одними из наиболее редких поражений пуповины и поверхностных сосудов плаценты [1, 2]. Частота аневризмы пуповинной вены колеблется от 0,4 до 1,1% на 1000 плацент [3], составляя около 4% всех аномалий развития пуповинной вены [4, 5].
Выявление аневризмы пуповинной вены происходит, как правило, при ультразвуковом исследовании беременной. Однако в связи с малым количеством наблюдений единая тактика ведения беременности и родов до настоящего времени, к сожалению, отсутствует, что определяет необходимость анализа имеющихся данных литературы и представление собственного опыта.
Описание клинического наблюдения
Беременная Х., 29 лет, поступила на сроке беременности 37 недель 5 дней для обследования и определения тактики последующего ведения беременности.
В анамнезе одна беременность, которая завершилась неосложненными родами после родовозбуждения на сроке 41 неделя. Родился живой доношенный мальчик массой 3670 г, рост 54 см в удовлетворительном состоянии.
Данная беременность – вторая, наступила самопроизвольно. I и II триместры протекали без осложнений, пренатальный скрининг – норма. При ультразвуковом исследовании в 32 недели беременности обнаружено, что анатомическое строение и размеры плода соответствуют гестационному сроку. Пуповина в интраамниальной части без особенностей, содержит три сосуда. Плацента толщиной 3,4 см, расположена по задней правой боковой стенке. По краю плаценты в субамниотической области визуализируется образование солидной структуры с четкими контурами размерами 10,0х8,6х12,1 см, пролабирующее в амниотическую полость (рис.1). При цветовом допплеровском картировании в пределах образования обнаружен «мозаичный» кровоток. Питающий образование сосуд имел низкое сосудистое сопротивление (пульсационный индекс 0,4). Признаков нарушения функционального состояния плода по данным кардиотокографического исследования в этом сроке не было. Диагноз дифференцировался между сосудистой аномалией пуповины и гемангиомой плаценты.
В 34 недели отмечено присоединение многоводия (при ультразвуковом исследовании минимальный карман вод составлял 9,8 см). В связи с предполагавшейся инфекционной природой многоводия пациентка амбулаторно прошла курс антибактериальной терапии препаратом цефалоспоринового ряда.
При кардиотокографическом исследовании в 34–35 недель беременности выявлены признаки нарушения состояния плода, которые проявлялись снижением вариабельности сердечного ритма.
В 35 недель проведен перинатальный консилиум и, учитывая нарастающее многоводие и нарушение состояния плода, дальнейшее пролонгирование беременности признано нецелесообразным.
Учитывая большие размеры выявленной сосудистой аномалии пуповины, прогресирующее нарушение состояния плода и, следовательно, высокий риск анте-интранатальной потери плода, методом родоразрешения выбрана операция кесарева сечения, которая была проведена после получения информированного согласия пациентки. Родился живой доношенный мальчик без видимых пороков развития и травм, массой 3090 г и длиной тела 50 см. Оценка по шкале Апгар на 1-й минуте – 8 баллов, через 5 минут – 9 баллов. Новорожденный передан в отделение новорожденных, откуда был выписан в удовлетворительном состоянии на 5-е сутки.
Во время операции кесарева сечения послед был бережно рожден осторожным потягиванием за пуповину. При визуальном осмотре последа: оболочки без особенностей, материнская поверхность цела, на плодной поверхности в краевой области – объемное выбухающее образование. Послед направлен на морфологическое исследование.
Перед морфологическим исследованием для определения особенностей строения и кровоснабжения плаценты и выявленного объемного образования нами было проведено компьютерное томографическое (КТ) исследование с двухэтапным селективным контрастным усилением вены пуповины на компьютерном томографе Toshiba Aquilion 320 по программе объемного сканирования с толщиной среза 1,0 мм. Анализ данных и трехмерная обработка КТ-изображений выполнены с использованием специализированного программного обеспечения Myrian Expert, Intrasense, Франция.
Вес плаценты с пуповиной перед исследованием составил 737 г. Приготовлен раствор для контрастирования из расчета 67% рентгенконтрастного вещества Optiray 300 мг йода/мл и 33% воды. На первом этапе вена пуповины катетеризирована на расстоянии 3,2 см от прикрепления пуповины к плаценте и введен раствор для контрастирования в объеме 24 мл, проведено КТ сканирование плаценты.
Через сутки был проведен второй этап КТ исследования. Плацента промыта и осушена. Катетеризован пальпаторно и визуально определяемый сосуд на плодной поверхности плаценты, исходящий (перегибом) под углом от вены пуповины в области прикрепления пуповины. В сосуд введен контрастный раствор в объеме 12 мл. Проведено КТ сканирование плаценты.
На полученных томограммах плацента неправильной округлой формы с наличием выбухающего объемного образования по краю общими размерами 22,4х16,3 см и толщиной от 2,2 см до 4 см. Прикрепление пуповины эксцентричное, краевое. Длина пуповинного остатка 33 см, диаметр 1,2–1,5 см. Количество сосудов пуповины – 3. В месте прикрепления пуповины и по близлежащей к ней краевой поверхности определяется объемное образование размерами 7,9х6,1 см без наличия плацентарной ткани и представленное петлей расширенного сосуда.
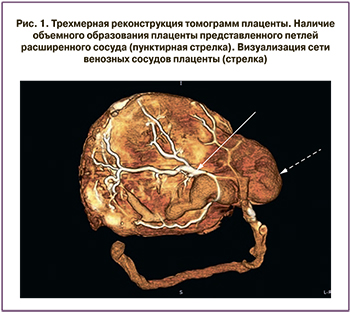 При анализе томограмм, полученных после первого этапа контрастирования, плацента имеет центральный тип распределения венозных сосудов (рис. 1). Область патологически расширенного сосуда не заполнена контрастным раствором.
При анализе томограмм, полученных после первого этапа контрастирования, плацента имеет центральный тип распределения венозных сосудов (рис. 1). Область патологически расширенного сосуда не заполнена контрастным раствором.
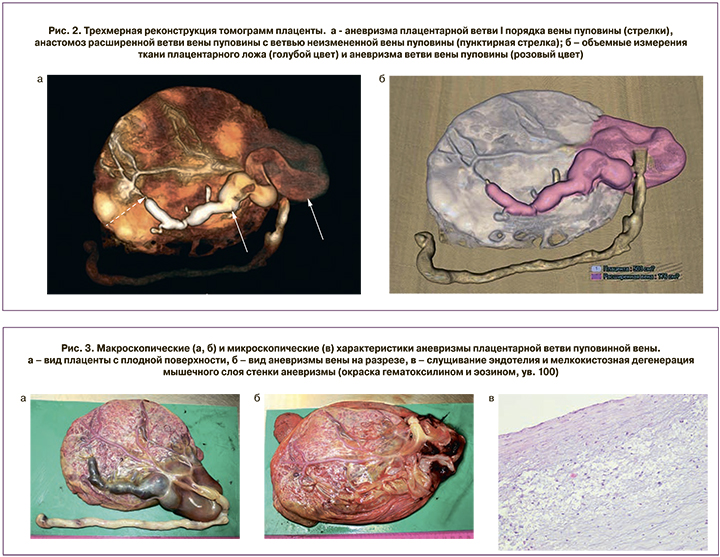
При анализе томограмм, полученных после второго этапа контрастирования, выявлена аневризматически расширенная плацентарная ветвь I порядка вены пуповины, берущая свое начало от ствола вены пуповины в области прикрепления пупочного канатика, имеющая дугообразный изгиб в краевой области плаценты и продолжающаяся на плодную поверхность плаценты. В области отхождения имеет диаметр 8 мм, далее расширяется, диаметр в части наибольшего расширения 3,14 см. Аневризматически расширенная ветвь вены пуповины имеет анастомоз с ветвью неизмененной вены пуповины (рис. 2а). Рассчитанный объем плаценты составил 503 см³, объем аневризмы ветви вены пуповины – 176 см³.
Заключение: аневризма плацентарной ветви I порядка вены пуповины.
При последующем морфологическом исследовании последа плодные оболочки блестящие серовато-розоватого цвета с единичными мелкими желтоватыми наложениями. Пуповина длиной 36 см и диаметром 1,3–1,5 см с наличием 4 витков влево и 2 ложных узлов, на разрезе правильного строения. Плацентарный диск размерами 18,5×16×2,5 см. Материнская поверхность красновато-синюшного цвета. В месте прикрепления пуповины (по краю плаценты) отмечается объемное образование размером 8×7×3 см, продолжающееся под амниотической оболочкой в виде расширенного сосуда длиной 13 см и диаметром 1,2–2 см (рис. 3а). При вскрытии данного образования внутренняя поверхность гладкая блестящая белесоватая (рис. 3б), в дистальном отделе сообщается с плацентарной ветвью пуповинной вены.
При микроскопическом исследовании плодные оболочки с наличием отека, без признаков воспаления. В ткани плаценты наблюдается преобладание ветвящихся терминальных ворсин с многочисленными синцитиальными узелками (выраженный признак Тенни–Паркер) и спавшимися пустыми капиллярами. Незрелые промежуточные ворсины не определяются. Большинство стволовых ворсин с признаками фиброза, трофобласт местами замещен межворсинковым фибриноидом. Отмечется умеренно выраженная десквамация синцитиотрофобласта, мелкие участки обызвествления, очаговые некрозы базальной пластинки и множественные мелкие инфаркты ворсинкового дерева. Пуповина с наличием трех сосудов: артерии спавшиеся, вена несколько расширена. Стенка аневризмы ветви вены с признаками повреждения и мелкокистозной дегенерации мышечного слоя. Пуповина правильного строения: артерии спавшиеся, просвет вены расширен. В области аневризмы вены эндотелий местами слущен, в мышечном слое признаки повреждения и мелкокистозной дегенерации.
Заключение: аневризма плацентарной ветви пуповинной вены, в ткани плаценты отмечается преобладание ангиогенеза с ветвлением сосудов, большим количество синцитиальных почек и множественными мелкими инфарктами.
Согласно данным K. Benirschke [6], аневризмы в пуповинной вене развиваются несколько чаще, чем в пуповинных артериях. При этом более часто аневризмы локализуются во внебрюшной части пуповины, по сравнению с внутрибрюшной частью [7].
При внебрюшной локализации они в основном располагаются вблизи прикрепления пуповины.
Следует отметить, что, по мнению ряда исследователей [8, 9], диагноз аневризмы пуповинной вены правомочен при выявлении локального расширения пуповинной вены, диаметр которого более 9 мм, или если диаметр в области расширения более чем на 50% превышает диаметр непораженных участков. Именно данные признаки и лежат в основе дифференциальной диагностики аневризмы и варикозного расширения вены [10]. Кроме того, согласно русскоязычной версии официального международного издания Terminologia Embryologica [11], где наряду с латинскими и английскими терминами приведены их русские эквиваленты, правильнее говорить о непарной пуповинной вене (unpaired umbilical vein, E6.0.2.2.0.0.3).
Точные причины развития аневризмы пуповинной вены, к сожалению, не установлены. В литературе имеются указания на следующие заболевания и состояния как вероятные причины их развития: сифилис, желтуха, различные дегенеративные изменения, а также врожденные аномалии развития сосудистой стенки [12, 13]. По мнению N.M.A. Vandevijver с соавт. [14], в большинстве наблюдений причиной развития аневризмы пуповинной вены являются именно врожденное истончение средней оболочки и расщепление эластических волокон, приводящие к уменьшению толщины стенки вены. Наиболее тонкая и соответственно более слабая стенка отмечается во внепеченочном участке внутрибрюшной части пуповинной вены. Следовательно, любое состояние, приводящее к повышению внутрисосудистого венозного давления, может явиться причиной развития аневризмы пуповинной вены [15].
На основании морфологического изучения 1000 последов H. Lemtis [16] установил, что аневризмы сосудов пуповины существенно чаще сочетаются с задержкой роста плода, атипичным прикреплением пуповины к плаценте, наличием одной пуповинной артерии и другими аномалиями плаценты. На основании чего автор отнес аневризмы к истинным порокам развития. Действительно, выявленные нами признаки дегенерации в мышечном слое пуповинной вены согласуются с данными литературы о своеобразной аномалии строения сосудистой стенки [14] и свидетельствуют о своеобразной врожденной венозной мальформации [17].
Следует также добавить, что аневризмы пуповинной вены сочетаются и с хромосомными аномалиями. Так, аномалии кариотипа выявлялись в 6–12% наблюдений аневризмы пуповинной вены, чаще всего отмечалась трисомия 21 [15].
Бóльшая часть аневризм пуповинной вены выявляется при ультразвуковом исследовании беременной женщины на сроке беременности 27–30 недель [18].
Для подтверждения диагноза рекомендуется проведение допплерографии [19].
Использование допплерографии позволяет подтвердить сосудистую природу выявленного образования и тем самым провести дифференциальную диагностику с различными кистами (урахуса, аллантоидного, пупочно-брыжеечного протока, вартонова студня) [20], а также определить точную (внутрибрюшную или внебрюшную) локализацию аневризмы [21]. Наличие аневризмы внебрюшной части пуповины характеризуется большей частотой развития осложнений, в том числе гибели плода [22].
Кроме того, ультразвуковое исследование с допплером позволяет оценить характер и скорость кровотока, а также наличие тромбов в пуповинных сосудах [23]. В 28–50% наблюдений аневризм пуповинной вены отмечалось наличие турбулентного или двунаправленного кровотока [24].
Вместе с тем следует учитывать, что диаметр пуповинной вены зависит от срока гестации. В нормальных условиях увеличение срока гестации сопровождается увеличением ее диаметра. По данным Mahony [25] диаметр пуповинной вены равен 3 мм при сроке гестации 15 недель и 8 мм – в конце беременности. В номограммах A. Weissman с соавт. [26] средний диаметр пуповинной вены составляет 2 мм в 14–15 недель гестации и 7–8 мм к моменту срочных родов. Именно поэтому критериями развития аневризмы пуповинной вены считаются увеличение ее диаметра более 9 мм [27] или увеличение диаметра более 50% по сравнению с непораженными участками [8].
При анализе данных литературы о течении беременности и развитии плода при выявленной аневризме пуповинной вены отмечаются неоднозначные результаты. Действительно, в литературе описаны явления регресса, стагнации или увеличения размеров аневризмы [28]. Прогноз течения беременности и развития плода при аневризме пуповинной вены зависит, главным образом, от развития осложнений. Неосложненные аневризмы малых размеров не влияют, как правило, на развитие и рождение плода.
Среди осложнений аневризмы пуповинной вены выделяют тромбоз в области аневризмы, разрыв аневризмы, а также механическое сжатие соседних пуповинных артерий [28, 29]. N.M.A. Vandevijver с соавт. [14] приводят описание наблюдения аневризмы пуповинной вены, явившейся причиной внутриутробной гибели плода на 41 неделе гестации. При анализе последа авторы выявили наличие расширения до 4 см диаметра пуповины в 10 см от места прикрепления к плаценте. При микроскопическом изучении препаратов было установлено наличие аневризмы пуповинной вены и пристеночный тромбоз одной из пуповинных артерий. При этом отсутствовали признаки васкулита, фунизита, виллита и повреждения меконием. Непосредственной причиной смерти плода, по мнению авторов [14], явилась гипоксия.
Частота внутриутробной гибели плода при наличии аневризмы пуповинной вены достигает 4–5%, что существенно выше показателей (0,7%) при нормальном течении беременности [30]. Однако в исследовании B.S. Mahony с соавт. [25] частота внутриутробной гибели плода достигала 44%.
По данным F. Prefumo [31], гибель плода при аневризме пуповинной вены происходит в основном между 27 и 30 неделями гестации вследствие увеличения притока крови к плоду, а также тромбоза и повышенного риска разрыва аневризмы. В пользу развития декомпенсированной сердечной недостаточности свидетельствуют наблюдения кардиомегалии, гидроперикарда, отеков и водянки плода при варикозе пуповинной вены [19, 23]. В то же время у плодов с множественными аномалиями развития прогноз зависит, прежде всего, от конкретного вида порока, а не аневризмы пуповинной вены [31].
По мнению E. Leinzinger с соавт. [32], риск разрыва аневризмы пуповинной вены существенно повышается во время родов вследствие сокращений матки. На основании изучения 17 последов с наличием аневризмы пуповинной вены или артерии P. Wentworth [33] установил, что для развития разрыва аневризмы необходимо давление крови в 500 мм рт. ст. Подобные цифры значительно превышают цифры нормального давления в сосудах пуповины. При разрыве аневризмы кровь попадает в амниотическую полость и вызывает малокровие плода, в ряде случаев кровь не выходит за пределы пуповины, приводя лишь к развитию гематомы ее стенки.
Развитие тромбоза сосудов пуповины приводит, по данным H. Schrocksnadel c соавт. [34], к гибели плода в 82% случаев. В этой связи мы полностью солидарны с утверждениями о необходимости тщательного морфологического исследования пуповины и плаценты во всех случаях мертворождения и ранней неонатальной смерти [14, 35]. В качестве подтверждения можно привести данные Росстата за 2010 г., свидетельствующие, что в целом по Российской Федерации патология пуповины обусловила гибель плода в 8,2% от всех случаев внутриутробной гипоксии [36]. Следует также добавить, что при микроскопическом исследовании плаценты в приведенном нами наблюдении установлены признаки разветвленного ангиогенеза и большое количество синцитиальных узелков в ворсинах, что свидетельствует о снижении маточно-плацентарного кровотока и развитии предплацентарной гипоксии [37, 38].
Примечательно, что при варикозе пуповинной вены больше частота развития задержки роста плода (от 4 до 10%) по сравнению со средними показателями в популяции (3%) [3]. Предполагается, что в основе задержки роста плода лежит тромбоз в области расширения сосуда с последующим развитием микротромбоэмболий, попадающих через открытое овальное окно в головной мозг и приводящих соответственно к микроинфарктам различных его отделов [39].
Необходимо добавить, что кровоток по пуповинным сосудам возрастает по мере увеличения срока гестации плода. Следовательно, риск нарушений такого кровотока, связанных с развитием аневризмы, возрастает с увеличением гестационного возраста плода. Именно это позволяет объяснить, почему большинство случаев внутриутробной гибели плода, обусловленных аневризмой пупочного сосуда, происходит в конце беременности [4, 40].
К сожалению, в связи с относительной редкостью патологии тактика ведения беременных с аневризмой пуповинной вены на сегодняшний день разработана явно недостаточно. Тем не менее, все беременные с выявленной аневризмой пуповинной вены должны быть направлены для проведения детальной эхографии всего плода с целью исключения сопутствующих аномалий развития. В случае выявления пороков развития показано проведение амниоцентеза [27].
По мнению A. Weissmann-Brenner с соавт. [41] беременные с выявленной аневризмой пуповинной вены должны проходить еженедельное обследование до 28 недель беременности и два раза в неделю после 28 недель. D. Mankuta с соавт [9] считают, что ультразвуковое исследование необходимо проводить каждые 2 недели. При наличии признаков турбулентного кровотока в сосудах пуповины или задержки роста плода наблюдение следует начинать с 32 недель беременности.
По поводу сроков родоразрешения существуют различные мнения. Одни [5, 41] рекомендуют проводить его на сроках 36–38,7 недель гестации. Другие [42] считают возможным проведение срочных родов (в 39–40 недель) при отсутствии сочетанной патологии. При выявлении водянки плода или развитии тромбоза пуповинных сосудов родоразрешение следует проводить в 34–36 недель беременности [18, 43].
Заключение
Таким образом, нами представлено наблюдение аневризмы пуповинной вены. Данное наблюдение представляет, на наш взгляд, интерес в связи с редкостью и малой изученностью подобной патологии пуповины в отношении ее значения для развития плода и возможных осложнений беременности. Наиболее важными моментами являются определение тактики ведения беременной, а также выбор оптимального способа родоразрешения, зависящие главным образом от развития осложнений аневризмы, сопутствующих поражений плода и срока беременности.



