Соединения фолиевой кислоты (фолаты, витамин В9) являются незаменимыми микронутриентами как для развития плода и ребенка, так и для жизнедеятельности организма в целом. Название «фолаты» происходит от латинского folium (лист) по первому месту их обнаружения – в листьях шпината. К настоящему времени известно более 150 соединений фолатов, которые относятся к водорастворимым витаминам и могут поступать в организм в виде фолилполиглютаматов, фолиевой кислоты и ее дериватов, включая 5-метилтетрагидрофолат (5-МТГФ) – метафолин) [1–3].
Метаболизм природных фолатов
Фолилполиглютаматы представляют собой основную природную форму витамина В9. Они содержатся во многих продуктах питания. Наиболее высок уровень фолатов в бобовых, зеленых овощах, зелени, печени животных, орехах, семенах подсолнечника. Цельнозерновые продукты являются лучшим источником фолатов, в сравнении с рафинированной мукой. Концентрация фолатов увеличивается в процессе прорастания зерен, а также при ферментации за счет синтеза фолатов дрожжами или молочнокислыми бактериями. С другой стороны, многие условия приводят к потере фолатов в продуктах (нагревание, измельчение, длительное хранение, воздействие света). Таким образом, обеспеченность организма природными фолатами будет зависеть от многих факторов, включающих диетические, географические и социально-экономические [1, 2, 4]. Фолаты синтезируются некоторыми бактериями кишечника; однако их всасывание в дистальных отделах тонкой кишки и в толстой кишке замедлено и не может компенсировать дефицит их поступления. [5]
Недостаток фолатов может развиваться при диете, обедненной фолатсодержащими продуктами, синдроме мальабсорбции (в т.ч. после резекции желудка для коррекции массы тела), алкоголизме, курении, сахарном диабете, гипотиреозе, а также при приеме ряда лекарственных средств (антиконвульсанты, сульфаниламиды, метотрексат, комбинированные гормональные контрацептивы). Наибольшему риску недостаточности фолатов подвержены определенные группы населения: беременные женщины и маленькие дети, особенно родившиеся недоношенными [2, 4, 6, 7].
В настоящее время критерием для определения фолат-дефицита является концентрация фолатов в сыворотке крови или в эритроцитах, ниже которой имеется риск развития мегалобластной анемии или гипергомоцистеинемии. Однако для снижения риска пороков развития нервной трубки у плода, чтобы обеспечивать быстро делящиеся клетки во время эмбрионального развития, требуются значительно более высокие концентрации фолатов в крови. В связи с этим был принят термин «недостаточность фолатов», определяющийся по уровню фолатов в эритроцитах у женщин репродуктивного возраста, ниже которого увеличивается риск развития пороков нервной трубки у плода [7-9]. В настоящее время четкое представление о распространенности фолат-дефицита и фолат-недостаточности среди населения и его групп отсутствует в связи с ограниченным числом данных, использованием различных методов определения фолатов в сыворотке и эритроцитах и различной их интерпретацией. Некоторое общее представление о фолатном статусе женщин репродуктивного возраста дано в обзоре Rogers L. et al. [7]. Дефицит фолатов определен у более 20% женщин в странах с низким уровнем доходов и у менее 5% – в странах с высоким уровнем доходов; в то же время недостаточность фолатов имела место более чем у 40% женщин в большинстве стран.
Биодоступность природных фолатов вариабельна; в смешанном питании она в среднем составляет около 50%, по одним данным [3], или 30–98% от биодоступности синтетической фолиевой кислоты – по другим [4]. Чтобы абсорбироваться, фолилполиглютаматы пищи гидролизуются в проксимальных отделах тонкой кишки до моноглутаматов, а затем в энтероцитах образуется 5-МТГФ – основная циркулирующая форма витамина В9 [1, 2, 5, 10]. Из кровяного русла внутрь клеток 5-МТГФ проникает с помощью фолат-транспортеров и деметилируется там в тетрагидрофолат (ТГФ) при участии В12-зависимого фермента метионинсинтазы; при этом метильная группа включается в цикл преобразования гомоцистеина в метионин. ТГФ становится звеном в биосинтезе предшественников ДНК (пуринов и пиримидинов), а также метаболизируется обратно в 5-МТГФ с помощью метилентетрагидрофолатредуктазы (МТГФР) (рисунок).
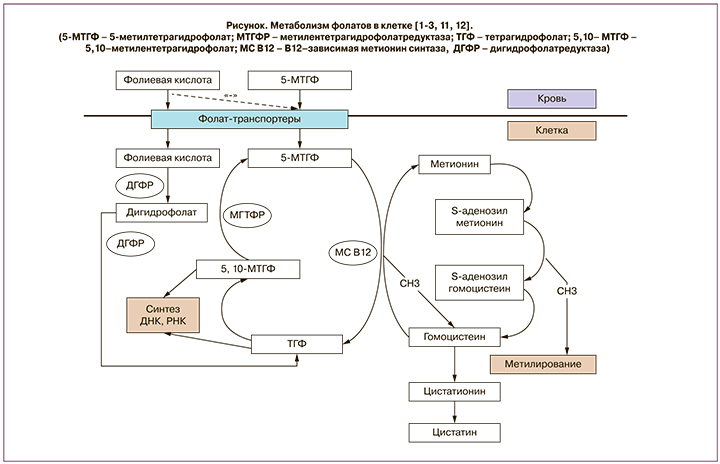
Фолаты имеют важнейшее значение для удаления избытка гомоцистеина. Дефицит фолатов ведет к повышению в плазме гомоцистеина, который обладает цитотоксическими свойствами. Снижение его концентрации в клетках обеспечивается двумя способами: с помощью фолат-зависимого реметилирования до метионина и путем транссульфирования с образованием цистатионина и затем – цистеина. Образовавшийся с участием фолатов метионин вновь через ряд превращений преобразуется в гомоцистеин, а освободившаяся метильная группа вступает в реакции метилирования ДНК, ядерных белков – гистонов и других компонентов обмена (рисунок)
Метаболизм фолиевой кислоты и метафолина
Фолиевая кислота (птероилмоноглутаминовая кислота), синтетическая форма витамина В9, не встречается в природе, но ее широко используют для добавок и фортификации продуктов. Фолиевая кислота, в отличие от природных форм фолатов, не разрушается при нагревании и воздействии ультрафиолетового света и обладает гораздо большей биодоступностью. Однако ее метаболизм отличается от обмена природных фолатов. В отличие от природных фолатов, для включения в метаболические процессы фолиевая кислота должна сначала восстановиться до дигидрофолата, затем до ТГФ с помощью фермента дигидрофолатредуктазы (ДГФР); в последующем из ТГФ образуется 5,10-метилентетрагидрофолат (5,10-МТГФ), и далее он восстанавливается до 5-метилтетрагидрофолат (5-МТГФ) с участием фермента метилентетрагидрофолатредуктазы(МТГФР). Биотрансформация и всасывание фолиевой кислоты в форме 5-МТГФ – насыщаемый процесс, и выше определенных пороговых доз (200–400 мкг) фолиевая кислота начинает всасываться в неизмененном виде, что ведет к появлению неметаболизированной фолиевой кислоты в кровотоке, которая захватывается клетками и изменяет течение обменных процессов (рисунок) [11, 13]
Наличие неметаболизированной фолиевой кислоты в кровообращении почти повсеместно встречается в районах, где введена фортификация продуктов фолиевой кислотой [14]. Она поступает в клетки через взаимодействие с фолат-транспортерами мембраны, которые имеют более высокое сродство к синтетической фолиевой кислоте, чем к 5-МГТФ. Вследствие этого избыток фолиевой кислоты будет ингибировать транспорт в клетки 5-МГТФ и провоцировать его функциональный дефицит. Внутри клетки фолиевая кислота должна пройти два последовательных этапа восстановления до ТГФ с участием ДГФР (рисунок). Активность ДГФР у человека относительно низкая, что может вести к накоплению дигидрофолата. In vitro дигидрофолат способен подавлять активность МТГФР и еще одного фермента – тимидилатсинтазы, которая катализирует образование пиримидинов из 5,10-МТГФ. Таким образом, избыток фолиевой кислоты ведет к частичному блокированию метаболизма эндогенных фолатов в клетке [1, 2, 11, 14].
На цикл обмена фолатов в организме влияет степень активности ферментов фолатного цикла. Основным ферментом фолатного цикла, связывающим реакции синтеза нуклеотидов и цикл метилирования, является МТГФР. Между тем известна высокая распространенность генетического полиморфизма гена МТГФР среди населения: гомозиготный полиморфизм встречается в 15–20% случаев, гетерозиготный – в 40–60%. В результате генетического полиморфизма функция данного фермента снижается, при гомозиготной форме – на 70–75% исходной, при гетерозиготной – на 30–35%, что ведет к уменьшению образования 5-МГТФ, развитию дефицита фолатов, гипергомоцистеинемии, повышенному риску осложнений беременности, спонтанных абортов, пороков нервной трубки у плода. При этом эффективность от дотации фолиевой кислоты в этих группах будет более низкой [2, 3, 10].
Метафолин (кальциевая соль 5-МТГФ) — еще одно синтетическое производное витамина В9, которое все чаще используется для дотации в связи с рядом его преимуществ по сравнению с фолиевой кислотой. Метафолин в организме диссоциирует на ионы кальция и 5-МТГФ; 5-МТГФ всасывается в кровь без участия ферментативных систем кишечника, непосредственно захватывается клетками и используется в обменных процессах. С ним не связаны нарушения физиологического метаболизма фолатов в организме, поэтому именно эту форму в настоящее время рекомендуют для дотации. Кроме того, высокая распространенность генетического полиморфизма МТГФР среди населения, создает преимущество для применения этой формы фолата [2, 10, 15].
Физиологическая роль фолатов
Фолаты – необходимые компоненты для синтеза нуклеотидов, без них невозможны деление и нормальный рост всех клеток. Фолаты принимают участие в реакциях метилирования гормонов, липидов, нейромедиаторов и других компонентов обмена веществ. Одним из важнейших субстратов для метилирования является ДНК. Метилирование ДНК обеспечивает функционирование клеточного генома, регуляцию онтогенеза, клеточную дифференцировку, эпигенетические процессы. Дефицит фолатов в первую очередь отражается на быстро пролиферирующих клетках – кроветворных, эпителиальных, а также тканях зародыша, хориона и плода. Дефицит фолатов нарушает гемопоэз с развитием мегалобластного типа кроветворения, анемии, тромбоцитопении и лейкопении. Нарушение деления эпителиальных клеток приводит к ухудшению регенерации кожи и слизистых оболочек, повышению риска злокачественных заболеваний. Расстройство работы генома эмбриональных клеток ведет к дизэмбриогенезу и формированию пороков развития у плода [2, 4, 10].
Фолаты крайне необходимы для нейрогенеза. Хорошо известна профилактическая роль приема фолатов во время беременности для снижения риска пороков развития плода, особенно дефектов нервной трубки. Нарушение цикла метилирования в результате недостатка фолатов также способствует повреждению оболочки нервных окончаний и расстройству проведения нервных импульсов [1, 2, 16, 17].
Недостаточность фолатов нарушает пролиферацию ворсин хориона и формирование плаценты, что ведет к осложненному течению беременности: повышается риск невынашивания, плацентарной недостаточности, преэклампсии, задержки роста плода, отслойки плаценты. Риск данных осложнений еще более возрастает при высоком уровне гомоцистеина, обмен которого напрямую связан с обменом фолатов. Гипергомоцистеинемия усиливает тромбообразование в зоне плацентации, вследствие чего может нарушаться кровообращение в плаценте, формироваться ее отслойки, инфаркты и плацентарная недостаточность [1, 3, 10]. Также гипергомоцистеинемия является фактором риска сердечно-сосудистых заболеваний (ССЗ), так как вызывает повреждение эндотелия сосудов, что активирует тромбообразование и формирование атеросклеротических бляшек [2].
Фолатный статус матери во время беременности имеет важное значение для последующего развития ребенка. С низким потреблением фолатов во время беременности ассоциированы риски нарушений нервно-психического развития, когнитивных расстройств, аутизма и шизофрении [2, 10, 18].
К настоящему времени многие исследования подтвердили необходимость дополнительного приема фолатов во время беременности для предотвращения их недостаточности у матери и обеспечения нормального развития плода, причем отмечается необходимость начала профилактики за 2–3 месяца до зачатия [3, 17, 19]. В России прием 400 мкг фолиевой кислоты во время беременности регламентирован Приказом от 01.11.2012 № 572 «Об утверждении порядка оказания медицинской помощи по профилю “акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий)”».
Возможные неблагоприятные эффекты повышенных доз фолиевой кислоты
В литературе обсуждаются вопросы, связанные с эффективными и безопасными дозами дотации синтетической фолиевой кислоты. Возможные неблагопрятные эффекты избытка неметаболизированной фолиевой кислоты в настоящее время являются предметом исследований. Неметаболизированная фолиевая кислота, поступая в клетки, блокирует рецепторы и ферменты, с которыми взаимодействуют эндогенные восстановленные фолаты, и, несмотря на избыточный прием фолиевой кислоты, может возникнуть функциональный фолат-дефицит [1–3, 11]
Назначение высоких доз фолиевой кислоты опасно при недостаточности витамина В12, так как происходит маскировка симптомов анемии, но в то же время прогрессируют неврологические нарушения, развивается нарушение метилирования миелина и расстройство проводимости нервных импульсов. Данный эффект является следствием того, что с витамином В12 связана активность фермента метионинсинтазы, отвечающего за перенос метильной группы 5-МГТФ в цикле метилирования. [1, 10, 13, 18]
Существуют серьезные опасения в отношении возможности стимуляции опухолевых процессов при избыточном уровне фолиевой кислоты [11, 18, 20].
Фолаты поступают к плоду через плаценту. Плацента не является препятствием для прохождения неметаболизированной фолиевой кислоты, которая обнаруживается в пуповинной крови [18]. Избыток синтетической фолиевой кислоты может менять метилирование ДНК и экспрессию генов у плода и иметь неблагоприятные последствия для плода и ребенка. В экспериментальных работах показано, что высокие дозы фолиевой кислоты во время беременности приводят к повышенным эмбриональным потерям, задержке развития плода, а также изменяют экспрессию ряда генов в полушариях головного мозга плодов, в том числе генов, ответственных за регуляцию нервно-психического развития. Дискутируется вопрос о вовлечении генов, возможно связанных с развитием аутизма и интеллектуальной недостаточности у потомства. Влияние высоких доз фолиевой кислоты приводило к формированию гипервозбудимых нейронных сетей, гиперактивности и повышенной тревожности у новорожденных, а также к возможному повышению риска эпилепсии [11, 19, 21–23]. Имеются экспериментальные данные неблагоприятного влияния избытка фолиевой кислоты на мужские половые клетки, что происходит в результате изменения паттерна метилирования ДНК и эпигенома сперматозоидов, причем эти изменения могут передаваться потомству [24].
В ряде клинических исследований обнаруживалась корреляция повышенного уровня фолатов во время беременности с уменьшением размеров эмбрионов, повышением риска атопического дерматита, инсулинорезистентности и ожирения у детей [2, 10, 11, 13, 21, 25-27]. Однако эти результаты противоречивы и требуют дальнейшего подтверждения [19, 20].
Кроме того, существует предположение, что раннее воздействие на плод избыточной синтетической фолиевой кислоты может способствовать генетическому отбору генотипа MTHFR 677T, который связан с развитием ряда дегенеративных состояний, включая ССЗ и болезнь Альцгеймера [18].
Фолаты активно транспортируются в грудное молоко, что создает минимальную зависимость их концентрации в молоке от фолат-статуса матери (за исключение случаев глубокого фолат-дефицита). Природные фолаты в грудном молоке представлены в большей степени 5-МТГФ и в меньшей – редуцированными фолилполиглютаматами. Дотация матери фолиевой кислоты приводит к небольшому, но достоверному повышению общего содержания фолатов в молоке [14]; однако при этом у большинства (96%) женщин в молоке обнаруживается неметаболизированная фолиевая кислота [14, 28]. В одном из исследований показано, что повышение уровня фолатов в молоке происходит диспропорционально, за счет увеличения неметаболизированной фолиевой кислоты и снижения содержания 5-МТГФ. Так, доля неметаболизированной фолиевой кислоты в молоке женщин, употреблявших до 400 мкг фолиевой кислоты в сутки, составила 26%, а у женщин с дозой 400–1000 мкг – 47%. Одним из объяснений данной диспропорции является существование большего сродства эпителиального рецептора молочной железы, а также фолат-связывающего белка молока к фолиевой кислоте, чем к 5-МТГФ. Хотя точные последствия этого для здоровья матери и ребенка неизвестны, однако можно предположить, что появление неметаболизированной фолиевой кислоты в грудном молоке является показателем ее избыточного поступления, которого следует избегать [14].
Неблагоприятное влияние высоких добавок
фолиевой кислоты может зависеть от индивидуальных генетических особенностей. Так, группы населения с гомозиготной делецией в 19 bp гена DHFR (составляют 20% в США) более чувствительны в неблагоприятному влиянию избытка неметаболизированной фолиевой кислоты [11].
Таким образом, для организма становится опасен не только недостаток фолатов, но и избыток синтетической фолиевой кислоты.
В настоящее время определены следующие профилактические дозы фолиевой кислоты: для взрослых – 400 мкг/сут, беременных и кормящих женщин – 400–800 мкг/сут, верхним допустимым уровнем считается 1000 мкг/сут [1, 28].
Ввиду того, что неметаболизированная фолиевая кислота может индуцировать неблагоприятные эффекты и потенциальное эпигенетическое воздействие на геном плода и ребенка, необходимо избегать нерегулируемых добавок с высоким содержанием фолиевой кислоты.
Оценка обеспеченности фолатами организма
Определение достаточности и дефицита фолатов основывается на лабораторных методах оценки уровня фолатов в сыворотке крови и эритроцитах. Концентрация фолатов в сыворотке быстро реагирует на их поступление в организм и отражает краткосрочные и преходящие их колебания. Содержание фолатов в эритроцитах – показатель долгосрочного фолатного статуса за 3–4 месяца (120 дней жизни эритроцита), и он тесно коррелирует с уровнем запасов фолатов в печени. Уровень фолатов можно определять биохимическими, иммунологическими, хроматографическими, а также микробиологическими методами с использованием тест-организмов, для которых фолиевая кислота является незаменимым ростовым фактором [7–9]. Высокоэффективная жидкостная хроматография, особенно в сочетании с масс-спектрометрией, является высокоточным, но нечасто используемым методом в рутинной практике клинических лабораторий. В настоящее время наиболее распространены микробиологические и иммунохимические методы определения фолатов. Среди иммунохимических методов чаще применяются автоматизированные иммунохимические методы с хемилюминесцентной или с электрохемилюминесцентной детекцией. Различные иммунохимические тесты отличаются по их способам разделения свободной и связанной фракции фолатов, а также по выбору метода предварительной обработки образцов.
В связи с использованием различных методов определения содержания фолатов в организме, различных референсных значений, интерпретация и сравнение результатов исследований затруднены. Некоторые референсные значения в зависимости от использованных методов были представлены Pfeiffer C. et al. [9]. Так, фолат-дефицит, определенный микробиологическим методом со штаммом дикого типа Lactobacillus rhamnosus и калибратором по фолиевой кислоте, диагностируется, если концентрация фолатов в сыворотке менее 7 нмоль/л или в эритроцитах – менее 305 нмоль/л. С другой стороны, фолат-дефицит, основанный на росте гомоцистеина и применении микробиологического метода с хлорамфениколрезистентным штаммом и 5-МТГФ калибратором, определяется при уровне фолатов сыворотки менее 14 нмоль/л или в эритроцитах – менее 624 нмоль/л; недостаточность фолата (граница риска пороков нервной трубки у плода) этим же методом диагностируется при уровне фолатов в эритроцитах менее 748 нмоль/л. В то же время во многих работах по изучению фолат-статуса недоношенных детей используются иммунохимические методы, при этом нижним пределом содержания фолатов в сыворотке считается 7 нмоль/л, фолатов в эритроцитах – 317 нмоль/л, нормальным уровнем содержания фолатов в эритроцитах – 340–1360 нмоль/л [6, 29–33].
Обеспеченность фолатами недоношенных детей
В ряде работ, посвященных исследованию уровня фолатов у новорожденных детей, было показано, что у недоношенных детей отмечаются более низкие концентрации фолиевой кислоты в эритроцитах, чем у доношенных, вероятно, за счет более активной передачи фолиевой кислоты плоду в последние недели беременности. Однако как доношенные, так и недоношенные дети рождаются с более высокими концентрациями фолатов в сыворотке и эритроцитах, значительно превышающими таковые у их матерей и средние значения у взрослых [31, 32, 34].
В 1970–1980-х гг. вопросам профилактики и лечения анемии у недоношенных детей были посвящены различные исследования, в том числе было обнаружено, что в течение первых 2–3 месяцев жизни у недоношенных детей происходит снижение уровня сывороточных фолатов. В связи с этим распространились рекомендации о необходимости дотации фолиевой кислоты недоношенным детям в диапазоне 20–200 мкг в сутки [31, 34, 35]. Однако эти результаты были получены до наступления эры современных концепций вскармливания недоношенных детей. И, несмотря на изменение питания недоношенных детей: появление специализированных питательных формул, обогатителей грудного молока, витаминов для парентерального питания, которые содержат фолиевую кислоту, рутинное дополнительное назначение фолиевой кислоты сохраняется [30–32]. При этом необходимо отметить, что во многих странах, в том числе и в России, зарегистрированы только таблетированные формы фолиевой кислоты, которые по отношению к новорожденным и недоношенным относятся к группе «off label».
Суточная потребность в фолатах у недоношенных детей составляет 35–100 мкг/кг при энтеральном питании и 56 мкг/кг – при парентеральном. Если недоношенный ребенок получает эритропоэтин с целью профилактики анемии недоношенных, рекомендуется 100 мкг/кг фолиевой кислоты в сутки [36–38]. Содержание фолатов в грудном молоке, по данным разных авторов, значительно варьирует – от 0,4 до 28 мкг/100 мл, в среднем составляя 3,3–14 мкг/100 мл [6, 28, 32, 34, 37, 38], что может быть недостаточным для недоношенных детей. Однако обогащение грудного молока или вскармливание специализированной смесью для недоношенных обеспечит поступление 50–100 мкг/кг фолатов в сутки. С другой стороны, уровень фолатов на первом месяце жизни недоношенных зависит от потребления фолатов матерью во время беременности. Дотация фолиевой кислоты во время беременности обеспечивает более высокую концентрацию фолатов в крови матери, ее новорожденного ребенка, а также в грудном молоке [6, 30, 32].
В работах 2007–2016 гг. было показано, что нет риска дефицита фолатов у недоношенных детей, если их матери получали добавки фолиевой кислоты во время беременности, а дети получали оптимальное парентеральное и энтеральное питание [6, 30–32]. Ни у одного ребенка не выявлено снижения уровня фолатов в эритроцитах или сыворотке и не обнаружено повышения уровня гомоцистеина как маркера дефицита фолатов. Хотя не было точного учета уровня потребления матерью фолатов во время беременности, в данных работах показано, что содержание фолатов в крови недоношенных детей в первые недели жизни достаточно высокое; средняя концентрация в эритроцитах составила 1457–2691 нмоль/мл, в сыворотке – 48–75 нмоль/л. Уровень фолатов в возрасте 1–2 месяцев жизни у недоношенных зависел от типа питания и дотации фолиевой кислоты. При вскармливании фортифицированным грудным молоком или специализированной молочной смесью уровень фолатов оставался на высоком уровне: в эритроцитах, в среднем, 2152 нмоль/л [31], в сыворотке – 87–96 нмоль/л [30]. В одной работе отмечено, что даже вскармливание глубоконедоношенных детей необогащенным грудным молоком не привело к дефициту фолатов к 36-й неделе постконцептуального возраста, средний уровень фолатов в сыворотке составил 59 нмоль/л [30].
Между тем заслуживают внимания факты чрезмерно высоких концентраций фолатов в крови недоношенных детей. Так, при дополнительном назначении 75–100 мкг/сутки фолиевой кислоты средние уровни фолатов в эритроцитах составили 2690–3838 нмоль/л, в сыворотке – 80 нмоль/л; при этом максимальная концентрация достигала 12424 и 187 нмоль/л соответственно [6, 32]. В литературе описаны и отдельные случаи чрезмерно высоких концентраций фолатов в крови недоношенных детей с экстремально низкой массой тела при рождении, доходящих до уровня 12498 нмоль/л в эритроцитах, что, по предположению авторов, могло быть связано, в том числе, с гемотрансфузиями [29].
Заключение
Фолаты – незаменимые компоненты питания человека. Безусловно, дефицит и недостаточность фолатов имеют значительное неблагоприятное влияние на развитие плода и ребенка. Однако, учитывая особенности метаболизма синтетической фолиевой кислоты, необходимо иметь в виду, что ее избыточная дотация может иметь отрицательное воздействие на здоровье человека. В настоящее время на фоне применения современных схем вскармливания нет риска дефицита фолатов у недоношенных детей, а бесконтрольное дополнительное назначение фолиевой кислоты может приводить к ее избыточному поступлению и чрезмерным концентрациям в крови недоношенных детей.



