Рак шейки матки (РШМ) занимает третье место в мировой [1] и отечественной [2] структурах онкогинекологической заболеваемости. Его формированию предшествуют дисплазии (цервикальные интраэпителиальные неоплазии – ЦИН) – многоэтапные изменения строения плоского эпителия, каждая последующая степень развития которых занимает не менее 2–3 лет.
В прошлом веке было принято считать, что ЦИН в большинстве случаев необратимы и возникновение слабой дисплазии предопределяет обязательное прогрессирование изменений эпителия в более тяжелые формы и завершается формированием раковой опухоли [3]. Однако в некоторых литературных источниках приведены наблюдения альтернативных исходов дисплазии [4].
Опубликованные в начале XXI века результаты многолетних исследований достоверно подтвердили способность ЦИН к регрессу и позволили по-новому взглянуть на роль этих изменений в формировании РШМ. Так, согласно литературным данным, ЦИН I и II степеней в 60% наблюдений исчезают спонтанно в течение первого года и в 30% случаев – по истечению 24 месяцев. В 10% наблюдений ЦИН I и ЦИН II прогрессируют к ЦИН III и в 1–1,5% случаев – к плоскоклеточному раку [5–7].
В настоящее время ведется поиск соответствующих маркеров, характеризующих с высокой степенью вероятности способность атипичных клеток к регрессу или, наоборот, к нарастанию в них более тяжелых изменений. Наличие критерия прогрессии ЦИН в случае слабой дисплазии послужило бы показанием к оперативному удалению пораженного участка слизистой, не дожидаясь дальнейшего нарастания атипии. Отсутствие этого признака в случаях ЦИН2+ определило бы вместо конизации, используемой в большинстве стран мира как метод профилактики РШМ, консервативное лечение, сохраняющее целостность шейки матки и устраняющее у молодых женщин одну из причин истмико-цервикальной недостаточности [8], способной негативно отразиться на их репродуктивной способности.
Открытие все новых аспектов взаимодействия вируса папилломы человека (ВПЧ) и пораженной им клетки предлагает в качестве маркеров прогноза дисплазии продукцию или, наоборот, отсутствие экспрессии некоторых вирусных и/или клеточных генов. Однако на настоящий момент нет ни общепринятого клинического, ни морфологического, ни молекулярно-генетического критериев [9, 10], позволяющих определить исход дисплазии.
Такие характеристики ВПЧ, как генотип высокого канцерогенного риска [11], наличие интеграции вирусной ДНК [12], экспрессия белков Е2 и/или Е7 [13] и высокие – «клинически значимые» показатели «вирусной нагрузки» [14] не нашли своего применения в качестве факторов прогноза развития интраэпителиальных изменений, так как они были обнаружены не только при неоплазиях, но и при латентной форме папилломавирусной инфекции.
Изменения экспрессии клеточных белков Ki-67 [15, 16], p53 [17], p16(INK4a) [15, 16, 18], Bcl-2 [17] оказались более информативными в качестве дифференциальных признаков дисплазии разной степени тяжести [18, 19]. Их корреляция с тяжестью цитологических и/или гистологических поражений [20] может быть обусловлена механизмом, не связанным с вирусным поражением клетки [21].
Наиболее информативным из всех известных на настоящий момент критериев зарекомендовал себя капсидный белок L1 [7, 9, 22–24] – специфичный для ВПЧ-поражения фактор, связанный с вирусным производством, которое осуществляется только при сохранении неизмененной продукции генов папилломавируса в неизмененном эпителии [7, 9, 24].
Возникающие при репликации повреждения ДНК ВПЧ приводят к нарушению цикла пораженной им клетки, которая становится генетически нестабильной и не способна осуществлять свою программу дифференцирования [25]. При этом вирусный ген L1 функционально инактивируется и утрачивает способность к синтезу капсидного белка, что при ЦИН и РШМ не позволяет сформировать вирусные частицы [7]. Использование с начала нынешнего века этого маркера в Германии позволило применить стратегию выжидания [7, 23] и изучить клинические результаты ЦИН2+.
Еще одним специфичным фактором, отражающим клеточные изменения, ассоциированные с ВПЧ [26], можно считать белок ядерного митотического аппарата – nuclear mitotic apparatus protein (NuMA1). Его экспрессия в G1, S, G2 фазах клеточного цикла характеризует организацию хроматина [26] и продукцию ряда генов, в первую очередь, семейства р53 [27], свидетельствующих о контроле за клеточным циклом.
Целью нашего исследования являлось изучение информативности экспрессии белков L1 и NuMA1 в качестве маркеров прогноза ЦИН, ассоциированных с ВПЧ высокого канцерогенного риска, в том числе у беременных.
Материал и методы исследования
Проведен анализ результатов цитологического, иммуноцитохимического, гистологического и молекулярно-генетического методов исследования биопсий шейки матки 138 женщин 21–56 лет, находившихся на обследовании и/или лечении в Санкт-Петербургском городском клиническом онкологическом диспансере с октября 2014 года по март 2017 года.
Всем пациенткам при первичном обращении осуществляли забор цервикальных биоптатов для цитологического и гистологического исследования. 45 больным проведена электроэксцизия шейки матки.
Цитологические препараты экто- и эндоцервикса готовили методом жидкостной цитологии и окрашивали по методу Папаниколау.
Для гистологического исследования материал щипцовой биопсии и/или электроэксцизии шейки матки фиксировали в 10% растворе формалина, обезвоживали в изопропиловых спиртах, заливали в парафиновые блоки, с помощью микротома готовили срезы толщиной 5–6 мкм, окрашивали гематоксилином и эозином.
Во всех случаях проводили иммуноцитохимические исследования с использованием системы детекции Novolink (Германия) и моноклональных антител к NuMA1 (LS-B7380, 44529), LifeSpanBioSciences Inc (США) и моноклональных антител к белку L1 ВПЧ 16 (33) генотипа – HPV 16 (CAMVIR-1, Mob 394, P333), DBS (США). Положительной реакцию считали при наличии исследуемых белков в не менее чем 5% атипичных клеток.
Заключения результатов цитологических исследований формулировали в соответствии с классификацией «The Bethesda System for reporting cervical cytologic diagnoses» [28], гистологических исследований – в соответствии с последней редакцией гистологической классификации ВОЗ [29], выделяя формы диспластических изменений эпителия и интраэпителиального рака.
Во всех случаях выявление и генотипирование ДНК ВПЧ в соскобе цервикального канала проводили методом мультиплексной полимеразной цепной реакции в режиме реального времени.
Достоверность различий полученных результатов оценивали на основании критерия Фишера.
Результаты исследования и их обсуждение
В результате морфологического исследования у 63 (45,7%) пациенток 21–38 лет диагностирована слабая (ЦИН1, LSIL), у 41 (29,7%) 23–32 лет – умеренная (ЦИН2, HSIL), у 33 (23,9%) 26–56 лет – тяжелая форма дисплазии (ЦИН3, HSIL), у 1 (0,7%) 32 лет – рак in situ (ЦИН3, HSIL). Из них 10 (7,2%) женщин были беременны. Слабая дисплазия плоского эпителия верифицирована у 2 (1,4%) пациенток в первом триместре, умеренная дисплазия – у 2 (1,4%) в первом и у одной (0,7%) – во втором триместре. У 4 (2,8%) женщин тяжелая дисплазия выявлена в сроки 14–15 недель и у 1 (0,7%) – на 30-й неделе беременности.
ВПЧ 16-го генотипа обнаружен в 72 (52,1%) случаях, его сочетания с папилломавирусами филогенетической группы (ФГГ) α9 – в 36 (26,1%) и с ФГГ α7 – в 10 (7,3%) исследованиях. ВПЧ 33 генотипа выявлен у 15 (10,9%) пациенток, его сочетания с ВПЧ 31 и 56 генотипов – у 5 (3,6%) женщин.
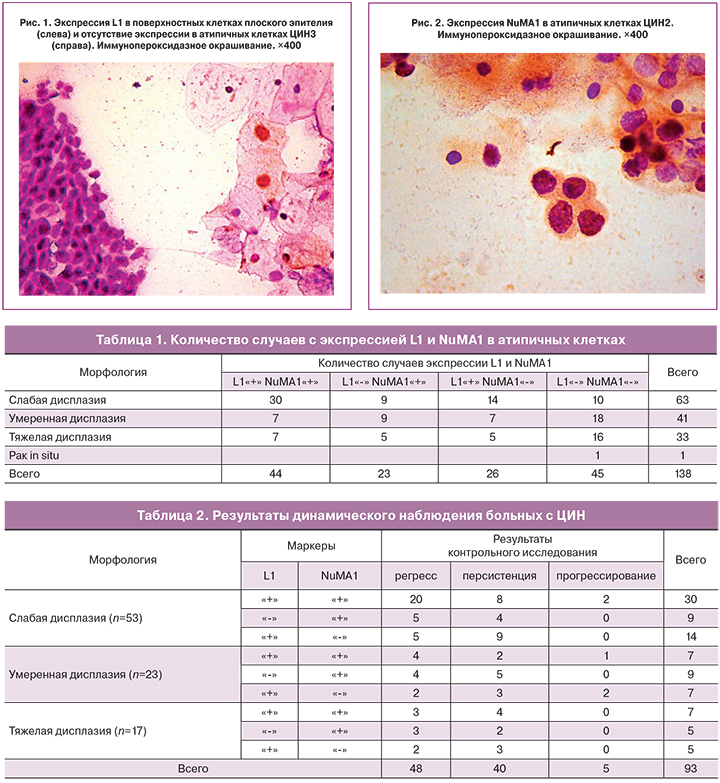
В результате иммуноморфологических исследований экспрессию L1 (рис. 1) и NuMA1 (рис. 2) в атипичных клетках выявили в 44 (31,9%) случаях ЦИН. В 23 (16,7%) наблюдениях дисплазии в ядрах обнаружили только протеин NuMA1, в 26 (18,8%) исследованиях – только капсидный белок L1. Антитела к обоим белкам отсутствовали в биоптатах 45 женщин (32,6%) (табл. 1).
Положительные реакции на L1 и NuMA1 выявили у всех беременных со слабой дисплазией и у 2 женщин с тяжелой дисплазией во втором и третьем триместрах, соответственно. Экспрессию белка NuMA1 отметили у 2 пациенток с умеренной дисплазией в первом и втором триместрах и у 1 – с тяжелой дисплазией во втором триместре. Отрицательные реакции на антитела к обоим белкам обнаружены у 1 женщины в первом триместре с умеренной и у 2 – во втором триместре с тяжелой дисплазией.
44 больным с дисплазиями и 1 пациентке с раком in situ провели электроэксцизию шейки матки. 93 женщины с экспрессией атипичными клетками L1 и NuMA1 или одного из двух белков оставили для динамического наблюдения с контрольными осмотрами и забором материала для морфологического исследования. В эту группу вошли и 3 беременных с отрицательными реакциями на антитела к обоим ядерным протеинам. Из них 26 женщин наблюдали в течение 24 и более месяцев, 28 – 18 месяцев, 27 – 12 месяцев, 10 – 6–8 месяцев и 5 – от 2 до 4 месяцев.
В 27 (61,4%) из 44 исследований ЦИН с ядерной экспрессией L1 и NuMA1 отметили регресс дисплазии (табл. 2). Из них плоский эпителий шейки матки восстановил типичное строение у 20 женщин со слабой и у 3 – с тяжелой дисплазией спустя 12 месяцев, у 4 больных с умеренной дисплазией – через 9 месяцев. В 14 (31,8%) исследованиях ЦИН с экспрессией обоих белков отметили сохранение степени тяжести поражения плоского эпителия. Из них в 8 случаях ЦИН1, в 2 ЦИН2 и в 4 ЦИН3 в течение 12 месяцев наблюдали изменения эпителия, выявленные первично. В 3 (6,8%) случаях ЦИН с продукцией в атипичных клетках обоих протеинов обнаружили прогрессирование дисплазии. Из них в 2 случаях ЦИН1 через 6 месяцев выявили критерии умеренной дисплазии, в 1 случае ЦИН2 через 9 месяцев – тяжелую дисплазию.
В 12 (52,2%) из 23 наблюдений ЦИН с экспрессией только NuMA1 в ядрах атипичных клеток плоский эпителий восстановил типичное строение. Из них отсутствие атипии обнаружили спустя 6 месяцев у 5 больных ЦИН1 и через 12 месяцев у 4 ЦИН2 и у 3 ЦИН3, что характеризовало регресс дисплазии (табл. 2). В остальных 11 (47,8%) исследованиях в сроке от 3 до 24 месяцев явления атипии были сохранены.
В 9 (34,6%) из 26 случаев ЦИН с экспрессией только L1 в ядрах атипичных клеток отметили регресс клеточных поражений (табл. 2). Из них у 5 пациенток с ЦИН1 спустя 12 месяцев обнаружены критерии эктопии, а у 2 больных с умеренной дисплазией и 2 – с тяжелой дисплазией спустя 12 месяцев – критерии ЦИН1. В 15 (57,7%) исследованиях ЦИН с положительной реакцией на антитела к L1 первично выявленные изменения плоского эпителия были сохранены в сроке от 6 до 30 месяцев. В 2 (7,7%) случаях у больных с ЦИН2 через 9 месяцев обнаружены критерии тяжелой дисплазии, что ниже показателей прогрессирования зарубежных исследователей [7].
Всего из 93 случаев ЦИН с ядерной экспрессией L1 и NuMA1 или одного из этих белков регресс дисплазии отметили в 48 (51,6%), персистенцию в 40 (43%), прогрессирование в 5 (5,4%) случаях. Полученные нами данные регресса и персистенции ЦИН сопоставимы с данными зарубежных исследователей, а показатели прогрессирования – в 2,5 раза ниже их [30].
Через 3 месяца наблюдения у всех беременных с ЦИН1 с экспрессией обоих белков отметили восстановление типичного строения плоского эпителия, у 1 с ЦИН3 – признаки эндоцервикальной эктопии. У 1 больной с тяжелой дисплазией с обоими положительными маркерами только после родов отметили восстановление эпителия. Через 3 месяца у беременных с ЦИН2 с экспрессией NuMA1 наблюдали снижение степени атипии до ЦИН1, у беременной с ЦИН3 изменения эпителия присутствовали до родов. У женщин с отрицательными реакциями на оба белка с ЦИН2 и ЦИН3 тяжесть поражения плоского эпителия шейки матки была сохранена на всем протяжении беременности. При контрольных осмотрах после родов наблюдали восстановление типичного строения плоского эпителия.
Выводы
- При продукции атипичными клетками L1 и NuMA1 или одного из этих белков регресс ЦИН определили в 51,6%, персистенцию – в 43%, прогрессирование – в 5,4% исследований.
- Наибольшее количество случаев регресса ЦИН – 61,4% отмечено при экспрессии атипичными клетками L1 и NuMA1, персистенции ЦИН – 57,7% – при экспрессии L1.
- Регресс ЦИН с экспрессией L1 и NuMA1 или одного из этих белков впервые обнаружен спустя 6 месяцев после выявления клеточных изменений.
- В течение беременности в 71,4% случаев ЦИН с положительными реакциями на L1 и NuMA1 или на один из этих белков отметили регресс, а у женщин с отсутствием продукции L1 и NuNA1 – персистенцию клеточной атипии.



