Задержка (замедление) роста плода (ЗРП), как один из «больших акушерских синдромов» [1], является патофизиологическим состоянием, многократно увеличивающим риски перинатальной смертности при данной [2] и даже при последующих беременностях у матери [3]. ЗРП, обусловленная нарушением функции плаценты, является причиной каждого третьего случая антенатальной гибели [4], общее число случаев которой в мире достигает 2,4–3,0 млн в год и не имеет значимой тенденции к снижению [5, 6]. Ретроспективное исследование McEwen et al. (2018) [7] на когорте более 35 000 детей подтвердило, что максимум частоты перинатальной смертности приходится на случаи ЗРП, и дополнительно продемонстрировало, как показатель перинатальной смертности снижался на 4% с каждым процентилем увеличения веса при рождении с минимальными показателями при весе новорожденного между 50 и 93 процентилями.
Актуальность описанных состояний для Российской Федерации подтверждает факт, что в нашей стране в 2018 г. родились мертвыми 8788 детей, из них умерли до начала родовой деятельности 8071 ребенок; из общего числа родившихся живыми замедление роста имели 6,2% (98 262 ребенка), внутриутробную гипоксию и асфиксию в родах – 4,9% (77 348 детей) [8].
В связи с отсутствием доказательно эффективных методов лечения ЗРП [9] только своевременное, нередко досрочное, родоразрешение является профилактикой антенатальной гибели. Однако ятрогенная недоношенность становится причиной развития у ребенка множественных кардиопульмонарных, неврологических, офтальмологических и гастроинтестинальных осложнений как после рождения, так и в последующем [10, 11].
Для максимально возможного снижения частоты ЗРП, необоснованных досрочных родоразрешений и обусловленной обеими причинами перинатальной гибели необходимо внедрение в клиническую практику алгоритмов прогнозирования, профилактики, диагностики и ведения ЗРП, основанных на самых современных доказательных исследованиях.
Профилактика задержки (замедления) роста плода
В популяционном исследовании Gardosi et al. (2013) [2] установлено, что большинство смертельных исходов, связанных с ЗРП, потенциально могут быть предотвращены за счет лучшей оценки факторов риска и усиления контроля за пациентками группы высокого риска. В связи с отсутствием доказательных данных о наличии специфического лечения [9, 12] в мировой литературе большое вниманием уделяется профилактическому назначению низких доз аспирина пациенткам группы высокого риска. К примеру, Roberge et al. (2017) [13] в систематическом обзоре и метаанализе 45 рандомизированных плацебо-контролируемых исследований, включающих в общей сложности 20 909 пациенток, установили, что в случаях начала приема 50–150 мг аспирина в сроки ≤16 недель беременности было выявлено значительное снижение частоты ЗРП (отношение шансов 0,56; ДИ 0,44–0,70). Напротив, при начале приема аспирина после 16 недель беременности был выявлен незначительный эффект либо полное отсутствие влияния на частоту данного осложнения. С учетом всех опубликованных научных данных клинические рекомендации США [14], Великобритании [15], Канады [16], Ирландии [17], Франции [18] и Германии [19] поддерживают идею необходимости раннего выявления пациенток группы высокого риска. Большинство из указанных руководств [15–19], исключая США, рекомендуют профилактическое применение аспирина для пациенток группы высокого риска с обязательным началом лечения до 16 недель беременность
Прогнозирование задержки (замедления) роста плода
Для корректного формирования группы высокого риска необходима тщательная оценка факторов риска развития нарушений функционирования маточно-плацентарной системы: материнских и плацентарных. Болезни плода: хромосомные и генетические аномалии, внутриутробное инфицирование также могут быть причиной задержки роста неплацентарного генеза, описываются в соответствующих тематических публикациях и не будут освещаться в настоящем обзоре [20, 21].
Перечень материнских факторов риска очень значителен, к таковым относятся: неевропейская раса, антропометрические особенности (низкий вес и рост), возраст менее 18 и старше 35–40 лет, никотиновая и алкогольная зависимость, сахарный диабет, системная красная волчанка, хроническая артериальная гипертензия, заболевания почек, антифосфолипидный синдром, первая беременность и беременность, наступившая в результате стимуляции овуляции и ЭКО, короткий или длинный интергенетический период, рождение самой беременной с малым весом, акушерский анамнез, отягощенный рождением маловесного ребенка, антенатальной гибелью [22].
Однако популяционные исследования продемонстрировали низкую эффективность прогнозирования ЗРП на основании исключительно материнских факторов риска [23], что определило необходимость поиска маркеров I триместра, свидетельствующих о нарушении формирования плаценты. К биохимическим маркерам, изучаемым в контексте ЗРП, относятся множественные показатели, определяемые в крови беременных, из которых наиболее изученными являются ассоциированный с беременностью протеин А (PAPP-A), плацентарный фактор роста (PLGF), растворимая fms-подобная тирозинкиназа-1 (sFlt-1). Определение уровня РАРР-А проводится в нашей стране каждой беременной при прохождении скринингового исследования I триместра [24]. По рекомендациям Королевского Колледжа Акушеров-Гинекологов Великобритании [15], снижение РАРР-А <0,415 MoM относится в «большим» факторам риска ЗРП. Данные российских исследований подтвердили достоверность прогнозирования рождения недоношенного маловесного ребенка при снижении уровня РАРР-А <0,5 MoM с площадью под кривой (AUC) 0,738 (0,717–0,757) [25]. Определение уровня PLGF находится на этапе внедрения в нашей стране, однако ранее проведенные зарубежные исследования Vandenberghe et al. [26] установили низкую эффективность данного показателя – AUC 0,593 (0,474–0,712).
На основании данных более чем 400 000 пациенток, Zhong et al. (2015) [27] в систематическом обзоре и метаанализе продемонстрировали, что любой из индивидуальных показателей имеет недостаточную прогностическую ценность в отношении ЗРП и необходимо применение комбинированных моделей. Те же выводы были сделаны в метаанализе результатов обследования более 55 000 пациенток, проведенном Velauthar et al. (2014) [28]. Авторы изучили возможности выявления случаев нарушения плацентации на основании показателей кровотока в маточных артериях в I триместре и определили низкую чувствительность метода в отношении общего числа случаев ЗРП и ее ранней формы, равную 15,4% и 39,2% соответственно. Помимо допплеровского исследования кровотока в маточных артериях, к биофизическим параметрам скрининга относится показатель среднего артериального давления у беременной, которое до настоящего момента не изучалось в качестве изолированного маркера риска ЗРП.
Комбинированные алгоритмы прогнозирования, учитывающие все материнские факторы в сочетании с индивидуальными значениями биохимических и биофизических маркеров, были представлены Crovetto et al. (2014) [29]. Продемонстрированы значимые отличия чувствительности прогнозирования случаев ЗРП, ассоциированных и не ассоциированных с преэклампсией: 90% против 40% для ранней ЗРП; 70% против 32% – для поздней ЗРП. В нашей стране широко применяется алгоритм, предложенный Poon et al. (2013) [30], позволяющий проводить одновременный расчет риска хромосомных аномалий и ЗРП/рождения недоношенного маловесного ребенка, подтвердивший свою эффективность в отношении рождения недоношенного маловесного ребенка на российской популяции – AUC 0,836 (0,819–0,852) [25]. Кроме того, исследования последних лет выявили, что риск ЗРП максимально высок у пациенток с сочетанием ложноположительных рисков хромосомных аномалий и ЗРП по результатам комбинированного скрининга [31, 32].
В отношении поздней ЗРП/рождения доношенного маловесного ребенка алгоритмы I триместра имеют недостаточную эффективность [25, 30], и основным методом прогнозирования является определение предполагаемой массы плода (ПМП) при ультразвуковом исследовании в III триместре беременности. Однако эффективность исследования в 30–34 недели беременности является низкой, составляя 17–22% [33, 34]. Масштабные проспективные [35, 36] и рандомизированные [34] исследования последних лет продемонстрировали необходимость перенесения ультразвукового исследования на более поздние сроки 35–36 недель беременности и включение в группу повышенного риска и дальнейшего динамического наблюдения случаев с ПМП <40 процентиля, что значительно увеличивает (до 80–99%) эффективность выявления случаев задержки роста у доношенного плода [35, 37]. Включение допплеровских параметров кровотока в прогностические алгоритмы III триместра беременности не увеличивает их эффективность [38].
Новые направления в прогнозировании ЗРП открывает изучение микроРНК [39], внеклеточной ДНК [40] и метаболомические [41] исследования, которые в перспективе могут изменить вектор рутинной практики, но в настоящий момент существуют только в качестве экспериментальных моделей.
Оценка размеров и предполагаемой массы плода
Для оценки размеров плода используются следующие эхографические параметры: бипариетальный размер и окружность головки плода, окружность живота и длина бедренной кости плода, которые должны оцениваться в строгом соответствии с практическими руководствами международного общества ультразвука в акушерстве и гинекологии (ISUOG), переведенном на русский язык [42]. Окружность головы и живота следует измерять с использованием эллипса, размещая калиперы на внешних контурах мягких тканей [43]. Существует большое количество формул расчета ПМП и референсных интервалов (процентильных таблиц) соответствия ПМП сроку беременности. Исследование Hammami et al. (2018) [44] проанализировало 70 формул определения ПМП на когорте более 5000 пациенток и установило, что наиболее точные результаты во всех группах плодов: маловесных для гестационного возраста, крупных и соответствующих сроку беременности – были получены при помощи формулы Hadlock et al. [45], учитывающей окружности головы и живота, длину бедра плода.
В выборе референсных интервалов (процентильных таблиц) ISUOG рекомендует использовать международные стандарты, созданные проспективно с соблюдением строгой методологии на большой выборке здоровых пациенток, например, стандарты проекта INTERGROWTH-21st [43]. Консорциум INTERGROWTH-21st является самым крупным в мире, объединившим 5 континентов, проектом в сфере исследования перинатального здоровья. На основании проспективного мультицентрового исследования [46] 4231 здоровых пациенток без сопутствующих заболеваний и социально-экономических факторов созданы референсные интервалы окружности живота и ПМП (табл. 1).

Установление точного срока беременности
При несоответствии фетометрических параметров предполагаемому сроку беременности необходимо уточнение срока. Международным стандартом установления срока беременности является копчико-теменной размер плода в сроки 9+0–13+6 недель [43, 47]. При первом обращении пациентки на УЗИ в 14–26 недель срок беременности устанавливается с учетом окружности головы и длины бедра плода. Включение в установление срока беременности дополнительных параметров (окружности живота, бипариетального и лобно-затылочного размера) не увеличивает точность исследования [48].
Допплерометрическое исследование
В случаях с ПМП <10 процентиля для уточнения клинической ситуации необходимо проведение допплерометрии [15, 19]. Методика корректного проведения допплеровской оценки кровотока в маточных артериях, артериях пуповины, средней мозговой артерии и венозном протоке у плода детально представлена в практических рекомендациях ISUOG «Использование допплерографии в акушерстве», переведенных на русский язык [49]. В случаях ЗРП исследование должно проводиться опытным специалистом с как минимум трехкратной оценкой каждого из параметров [50].
Важно отметить, что в последние годы показатели пульсационного индекса (ПИ) в средней мозговой артерии используются не как самостоятельный показатель состояния плода, а как составляющая церебрально-плацентарного отношения (ЦПО), продемонстрировавшего большую чувствительность в отношении перинатальной гибели, дистресса плода при родах, неонатального ацидоза, низких оценок по шкале Апгар и необходимости в реанимационной и интенсивной терапии новорожденных [51–53]. ЦПО рассчитывалось как отношение ПИ в средней мозговой артерии к ПИ в артериях пуповины.
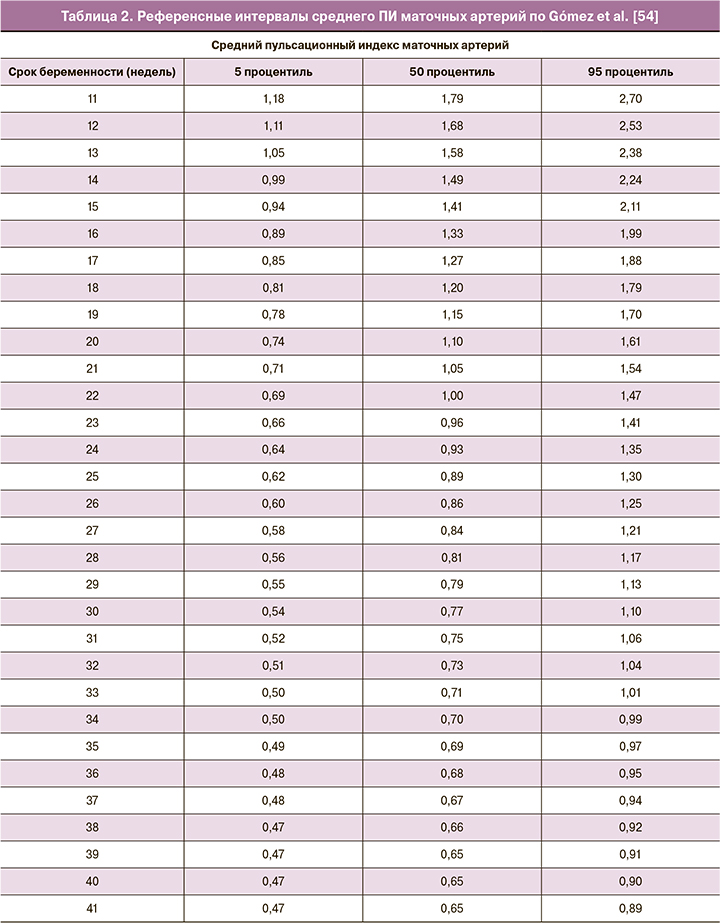
Рядом авторов предложены референсные интервалы для оценки нормальности показателей кровотока, из которых процентильные значения Gómez et al. [54] для маточных артерий в сроки 11–40 недель, представленные в таблице 2, разработанные со строгим соблюдением методологии на когорте 620 беременных, наиболее широко применяются, используются в расчете раннего комбинированного скрининга и интегрированы в программное обеспечение Astraia. Важно отметить, что для оценки кровотока в маточных артериях в международной практике используется средний ПИ – арифметическое среднее между показателями правой и левой маточных артерий.
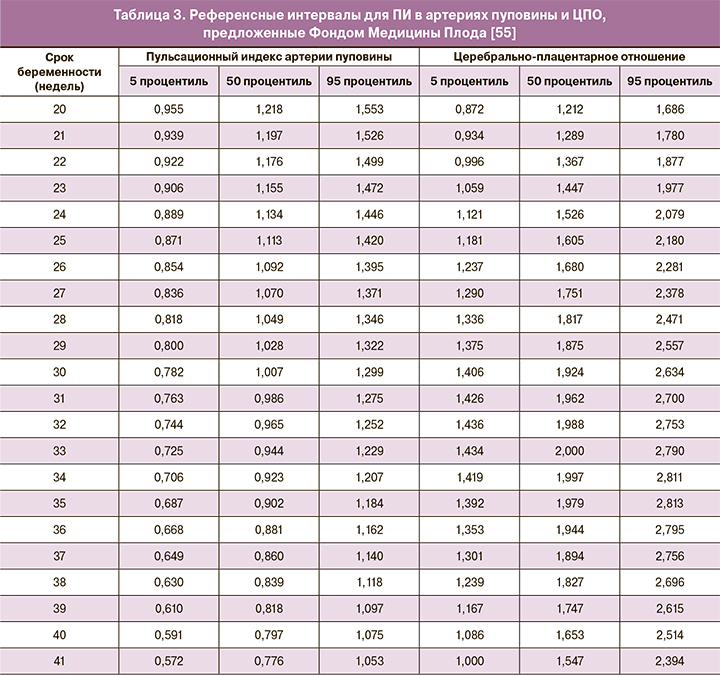
Для оценки кровотока в артериях пуповины и ЦПО в 2019 г. Фондом Медицины Плода [55] были предложены референсные интервалы (табл. 3), полученные в результате анализа данных более 70 000 пациенток с соблюдением максимальной методологической точности, что делает целесообразным их внедрение в ежедневную практику.
Диагностика задержки (замедления) роста плода
В 2016 г. среди нескольких десятков ведущих мировых специалистов был проведен многоэтапный опрос по Дельфийской системе [56], выработавший унифицированные критерии диагностики ЗРП, рекомендованные к всеобщему применению ISUOG (2019) [43]. Согласно данным консенсуса, ЗРП делится на 2 формы: раннюю и позднюю.
Ранняя ЗРП устанавливается впервые на сроке до 32 недель беременности по следующим критериям.
Большие критерии (достаточно одного для диагностики):
- окружность живота <3 процентиля;
- ПМП <3 процентиля;
- нулевой и реверсный диастолический кровоток в артериях пуповины.
Малые критерии (необходимо сочетание как минимум двух критериев):
- окружность живота <10 процентиля;
- ПМП <10 процентиля;
- ПИ в маточных артериях >95 процентиля;
- ПИ в артериях пуповины >95 процентиля.
Поздняя ЗРП устанавливается впервые на сроке ≥32 недель беременности по следующим критериям.
Большие критерии (достаточного одного для диагностики):
- окружность живота <3 процентиля;
- ПМП <3 процентиля.
Малые критерии (необходимо сочетание как минимум двух критериев):
- окружность живота <10 процентиля;
- ПМП <10 процентиля;
- замедление динамики прироста окружности живота и/или ПМП, пересекающих два квартиля (50 процентилей) на графиках роста, – то есть разница показателя ПМП или окружности живота между двумя измерениями более 50 процентилей;
- ПИ в артериях пуповины >95 процентиля;
- ЦПО <5 процентиля.
Важно акцентировать внимание на том, что с момента принятия унифицированных критериев [43, 56] понятие ЗРП связано не только с малыми размерами плода, но и с его функциональным состоянием: например, может быть диагностировано при нарушениях кровотока, замедленной динамике прироста, но нормальных значениях ПМП, что позволяет выделить случаи с высоким риском гипоксии и перинатальной гибели среди немаловесных плодов.
В список диагностических параметров ЗРП не вошли: биохимические показатели РАРР-А, PlGF и sFlt-1 в сыворотке крови беременной, количество околоплодных вод, постнатальное подтверждение патологии плаценты [56].
Термины «симметричная форма», «асимметричная форма» ЗРП не рекомендуются к использованию, поскольку они не предоставляют дополнительной информации относительно этиологии или прогноза состояния [43].
Дополнительные обследования при задержке (замедлении) роста плода
После установления диагноза ЗРП необходимо проведение детального ультразвукового исследования плода для исключения врожденных пороков развития, признаков внутриутробной инфекции и маркеров хромосомных аномалий [20, 21, 57, 58]. Консультация генетика с рассмотрением вопроса о проведении инвазивной генетической диагностики рекомендована при ранней ЗРП и во всех случаях аномалий плода [19–21, 57, 58].
Тактика ведения случаев задержки (замедления) роста плода
Дальнейшая тактика наблюдения за состоянием плода, выбор срока и метода родоразрешения будут зависеть от показателей кровотока, разделенных на стадии [59], отражающие состояние плода и риск его антенатальной гибели, представленные в виде алгоритма на рисунке.
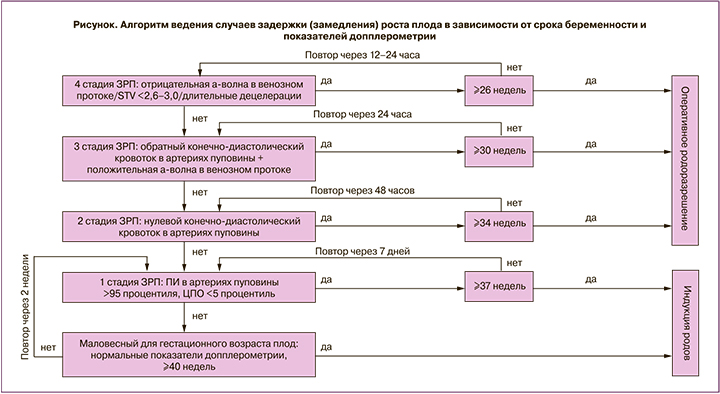
1 стадия
При сохранении положительного кровотока в артериях пуповины рекомендован еженедельный допплерометрический контроль данного показателя и определение ПИ в средней мозговой артерии с расчетом ЦПО после 32 недель беременности. Оценка кровотока в средней мозговой артерии плода на сроках до 32 недель беременности не показала значимости в выборе срока для родоразрешения и прогнозировании неблагоприятных исходов [60]. При сохраняющихся более 12 ч сниженных показателях ЦПО < 5 процентиля рекомендовано родоразрешение в 37 недель [61–63].
Возможно проведение родов через естественные родовые пути, принимая во внимание повышенный риск интранатальной гипоксии у данной группы плодов [64]. При стабильных показателях ЦПО ≥5 процентиля возможно пролонгирование беременности до 38–39 недель беременности при еженедельном допплерометрическом контроле [63–65].
2 стадия
При прогрессировании допплерометрических нарушений и появлении нулевого диастолического кровотока в артериях пуповины (стадия 2) вероятность антенатальной гибели плода возрастает в 3,9 раза [66], в связи с чем оперативное родоразрешение рекомендовано по достижении 32–34 недель беременности [19, 59]. При пролонгировании беременности до данных сроков необходимо проведение оценки кровотока в артериях пуповины каждые 48 ч для исключения появления обратного кровотока (стадии 3).
3 стадия
При появлении обратного диастолического кровотока в артериях пуповины для оценки возможности пролонгирования беременности необходимо исследование кровотока в венозном протоке с оценкой предсердной а-волны и компьютеризированной кардиотокографии с оценкой показателя краткосрочной вариабельности (STV) [50, 66–68]. Нормальными показателями компьютеризированной кардиотокографии являются значения STV ≥2,6 миллисекунд в сроках беременности 26+0–28+6 недель, STV ≥3 миллисекунд в сроках беременности 29+0–31+6 недель при отсутствии спонтанных повторных децелераций [50, 67, 68]. В случаях с положительной а-волной и нормальными показателями компьютеризированной кардиотокографии (стадия 3) вероятность гибели плода возрастает в 7,27 раза [66]; оперативное родоразрешение показано по достижении срока 30 недель беременности [66–68]. При пролонгировании беременности до этого срока необходим ежедневный контроль кровотока в артериях пуповины, в венозном протоке и оценка кардиотокографии [50, 66–68]. Рандомизированные исследования показали, что при ранней ЗРП в сроки 26–32 недели беременности пролонгирование беременности до появления отрицательной а-волны в венозном протоке или до получения патологических результатов компьютеризированной кардиотокографии представляется безопасным и, возможно, ведет к улучшению долгосрочного неврологического прогноза у ребенка [67, 68].
4 стадия
Прогрессирование гипоксии плода и повышение центрального венозного давления приводит к снижению диастолических скоростей в венозном протоке и предсердной а-волны, которая достигает нулевой линии, затем становится отрицательной. Эти изменения являются поздними признаками асфиксии плода и развивающегося ацидоза [66, 69]. При невозможности определения кровотока в венозном протоке вследствие недостаточной подготовки специалиста, проводящего исследования, либо класса диагностического оборудования возможна замена оценки данного показателя на оценку кровотока в вене пуповины. Пульсация вены пуповины, которая может определяться исходно в интраабдоминальном отделе, а затем и в пуповине, также считается поздним, предтерминальным признаком гипоксии/асфиксии плода [69]. При наличии обратного кровотока в артериях пуповины, отрицательной а-волны в венозном протоке вероятность гибели плода возрастает в 11,6 раза [32]; оперативное родоразрешение показано по достижению срока 26 недель беременности [33–39].
Оценка компьютеризированной кардиотокографии позволяет определить возможность краткосрочного пролонгирования беременности для проведения профилактики респираторного дистресс-синдрома [50, 66–68]. При патологических результатах кардиотокографии показано немедленное родоразрешение. Контроль за состоянием плода в таких случаях должен проводиться каждые 12 ч [66–68]. При критическом состоянии плода в сроках до 26 недель беременности родоразрешение должно проводиться по решению перинатального консилиума после разъяснения родителям высокого риска младенческой заболеваемости и смертности [66, 70].
Наблюдение за случаями задержки (замедления) роста плода при развитии преэклампсии у беременной
Динамический контроль за показателями кровотока в маточных артериях рекомендовано проводить после установки диагноза ЗРП каждые 4 недели, а также при развитии у беременной преэклампсии, частота которой при ранней ЗРП очень велика и может достигать 50–73% [50]. Поскольку показатели перинатальной заболеваемости и смертности имеют прямую связь с наличием и степенью гипертензивных осложнений у матери [50], необходимо помнить – на фоне преэклампсии прогрессирование патологических изменений кровотока может происходить значительно быстрее, в связи с чем контроль за состоянием плода следует проводить в 2 раза чаще на каждой из стадий [66].
Наблюдение за случаями маловесного для гестационного возраста плода
В случаях соответствия ПМП значениям 3,0–9,9 процентиля при нормальных показателях кровотока, включая ЦПО, рекомендовано пролонгирование беременности до 40 недель при допплерометрическом и фетометрическом контроле за состоянием плода каждые 2 недели [16, 66]. При выявлении диагностических критериев ЗРП [43, 56] дальнейшее ведение проводится, исходя из срока беременности и стадии нарушения допплерометрических параметров, описанных выше.
Оценка количества околоплодных вод
Количество околоплодных вод – показатель, который нередко снижается при ЗРП и на настоящий момент не входит в критерии диагностики [43, 56] и не учитывается при выборе сроков родоразрешения [50, 66]. Важно не допустить гипердиагностики маловодия, которая возникает при оценке индекса амниотической жидкости и может приводить к увеличению частоты родовозбуждения без улучшения перинатальных исходов [71, 72]. На основании результатов доказательных исследований наилучшим методом оценки является измерение глубины максимального вертикального кармана жидкости с использованием порогового значения 2 см [71, 72].
Заключение
Внедрение в ежедневную клиническую практику современных алгоритмов прогнозирования, методов эффективной профилактики, унифицированных критериев диагностики и принципов ведения случаев ЗРП, базирующихся на результатах исследований с высоким уровнем достоверности доказательств, будет являться базой для значительного снижения уровня перинатальной заболеваемости и смертности.



