I.M. Sechenov First Moscow State Medical University (Sechenov University), Ministry of Health of Russia, Moscow, Russia
Placenta accreta spectrum refers to a form of abnormal placentation and its severity depends on the depth of trophoblast invasion. This abnormality leads to a partial or complete delay in the separation of the placenta in the third stage of labor. The incidence of placental attachment disorders has increased by more than 9 times over the past 20 years. The etiological factors of the abnormality include placenta previa, the presence of postoperative uterine scar, the history of intrauterine interventions, pelvic inflammatory diseases, etc. Placenta previa and uterine scar after cesarean section (CS) are the most common causes of placenta accreta; moreover, the risk of placenta accreta after one CS increases by 7 times, and it increases by 56 times after two or more CS.
Currently, the main theory on the pathogenesis of placenta accreta consists in an impaired decidualization of the endometrium, which leads to uncontrolled invasion of the trophoblast. It is the decidua basalis that regulates proper invasion of the trophoblast by producing pro- and anti-invasive factors. This review presents the evolution of placenta accreta classifications. The main methods of antenatal diagnosis of placenta accreta are ultrasound assessment and magnetic resonance imaging, but none of them has 100% sensitivity and specificity; therefore, laboratory studies are currently conducted to search for biomarkers associated with the depth of trophoblast invasion.
Conclusion: The tactics of managing patients with placenta accreta depends on the depth of invasion, the amount of blood loss and the experience of surgeons, as well as the woman’s desire to preserve her fertility. There are conservative or organ-preserving methods of surgical treatment and non-conservative ones which include hysterectomy. The conservative methods include leaving the placenta in situ, one-stage surgical management, and the Triple-P procedure. The traditional technique involving CS followed by hysterectomy is characterized by a high maternal morbidity due to the development of intra- and postoperative complications.
Authors’ contributions: Ignatko I.V., Bogomazova I.M. – developing the concept and design of the study; Samara A.B.,
Fedyunina I.A. – collecting and processing the material; Gutsu V., Kardanova M.A. – statistical data processing; Samara A.B., Bogomazova I.M. – writing the text; Ignatko I.V., Timokhina E.V., Belousova V.S. – editing the article.
Conflicts of interest: Authors declare lack of the possible conflicts of interests.
Funding: The study was conducted without sponsorship.
For citation: Ignatko I.V., Bogomazova I.M., Timokhina E.V., Belousova V.S., Fedyunina I.A.,
Kardanova M.A., Samara A.B., Gutsu V. Placenta accreta: a modern view on etiopathogenesis and obstetric tactics.
Akusherstvo i Ginekologiya/Obstetrics and Gynecology. 2024; (1): 5-11 (in Russian)
https://dx.doi.org/10.18565/aig.2023.251
placenta accreta
placenta increta
placenta percreta
PAS
etiology of placenta accreta
classification of placenta accreta
diagnosis of placenta accreta
conservative treatment of placenta accreta
Врастание плаценты (Placenta Accreta Spectrum) относится к форме аномальной плацентации по глубине инвазии трофобласта, что приводит к частичной или полной задержке отделения плаценты в третьем периоде родов [1]. В настоящее время частота случаев патологического прикрепления плаценты неуклонно растет, и за последние 20 лет увеличилась в 9,2 раза – с 1 на 2510 пациенток в 1994 г. до 1 на 272 пациенток в 2016 г. [2]. К этиологическим факторам врастания плаценты относят предлежание плаценты, наличие послеоперационных рубцов на матке, перенесенные в анамнезе внутриматочные вмешательства (в том числе, лечебно-диагностические выскабливания и гистерорезектоскопия), аномалии строения матки, инфекционно-воспалительные заболевания органов малого таза, а также старший репродуктивный возраст (>35–40 лет), использование вспомогательных репродуктивных технологий и многоплодную беременность [3]. Из представленных факторов риска в литературе наиболее часто фигурируют предлежание плаценты и рубец на матке после кесарева сечения (КС) [4–6]. По данным Всемирной Организации Здравоохранения (ВОЗ) за последние 30 лет, согласно средним мировым показателям, частота КС увеличилась втрое – с 7% в 1990 г. до 21% в 2020 г. При этом данный показатель имеет выраженные региональные различия: от 0,1–5,0% – в государствах Африки к югу от Сахары, до 43% – в странах Латинской Америки. А в пяти странах мира – Доминиканской Республике, Бразилии, Кипре, Египте и Турции число КС превышает показатель родов через естественные родовые пути [7]. Установлено, что риск врастания плаценты после одного КС увеличивается в 7 раз, а после двух и более – в 56 раз [8, 9]! Тем не менее, по данным когортного исследования, опубликованного в 2016 г., в 49% наблюдений у пациенток с врастанием плаценты наблюдалось именно предлежание плаценты [10]. Однако статистически значимое повышение риска врастания плаценты при ее предлежании, согласно данным крупного систематического обзора, наблюдалось у женщин с перенесенными двумя и более операциями КС (50–67%) по сравнению с пациентками без предшествующих операций КС (3,3–4%) [11]. Также случаи врастания плаценты были описаны у первородящих женщин без предшествующих хирургических вмешательств, но с наличием аномалий строения матки (например, двурогой матки), а также с такими заболеваниями, как аденомиоз, подслизистая миома матки или миотоническая дистрофия. Данные наблюдения предполагают тот факт, что к нарушению инвазии трофобласта в виде плотного прикрепления или врастания плаценты могут привести, в том числе, и микроскопические дефекты эндометрия, а также нарушение его нормальных биологических характеристик [12]. В настоящее время основной патогенетической теорией врастания плаценты является нарушение децидуализации эндометрия, что позволяет якорным ворсинам проникать сквозь базальную мембрану в миометрий [13, 14]. В норме отделение плаценты от стенки матки происходит в децидуальной оболочке (decidua basalis) между сокращающимся миометрием и слоем Нитабуха. Именно децидуальная оболочка, осуществляя выработку как про-, так и антиинвазивных факторов, к которым относятся децидуальные естественные киллеры (dNK), регулирует адекватную инвазию трофобласта [15, 16]. Клетки dNK, низкий уровень которых ассоциирован с увеличением частоты случаев врастания плаценты, имеют уникальный профиль микро-РНК и отличаются от естественных киллеров периферической крови как фенотипически, так и функционально [17, 18]. Таким образом, нарушение строения децидуальной оболочки и недостаточное развитие слоя Нитабуха могут привести к нарушению отделения плаценты [19]. Что касается особенностей патогенеза врастания плаценты у пациенток с рубцом на матке после КС, то в соединительной ткани рубца зафиксировано увеличение экспрессии белков – интегрина β3 и фактора, ингибирующего лейкемию, повышающих восприимчивость эндометрия к имплантации, что в совокупности с нарушением перфузии прооперированной стенки матки приводит к увеличению инвазивной способности клеток вневорсинчатого трофобласта и, как следствие, более глубокому проникновению ворсин плаценты [20–24].
Общепринятая классификация врастания плаценты (Placenta Accreta Spectrum, PAS) основана на глубине инвазии ворсин хориона [5, 13]:
- placenta accreta – инвазия ворсин хориона (плаценты) в поверхностный слой миометрия на границе с эндометрием при отсутствии децидуальной ткани;
- placenta increta – глубокая инвазия ворсин хориона (плаценты) в слой миометрия;
- placenta percreta – прорастание ворсинами хориона (плаценты) всего слоя миометрия с нарушением целостности серозной оболочки и (в ряде случаев) соседних органов.
Согласно рекомендациям FIGO, опубликованным в 2018 г., выделяют 6 стадий инвазии ворсин хориона (плаценты) [5]:
- 1 стадия – прикрепление ворсин в функциональный слой эндометрия, предполагающее полное самостоятельное отделение плаценты в третьем периоде родов;
- 2 стадия – ворсины частично или полностью прорастают базальный слой эндометрия; в третьем периоде родов при использовании утеротоников и контролируемых тракций за пуповину не наблюдается отделения плаценты или наблюдается неполное ее отделение, требующее проведения ручного отделения;
- 3 стадия – ворсины врастают в миометрий, но не прорастают стенку матки насквозь; в третьем периоде родов при использовании утеротоников и контролируемых тракций за пуповину отделение плаценты не происходит; при ручном отделении плаценту отделить не удается;
- 4 стадия – ворсины прорастают мышечную и серозную оболочки матки, но между мочевым пузырем и маткой можно определить четкую хирургическую плоскость, позволяющую интраоперационно отделить стенку мочевого пузыря от стенки матки;
- 5 стадия – ворсины прорастают сквозь серозную оболочку матки и стенку мочевого пузыря, интраоперационно отделить стенку мочевого пузыря от стенки матки не представляется возможным;
- 6 стадия – ворсины прорастают серозную оболочку матки и инфильтрируют параметрий, а также любой другой орган, кроме мочевого пузыря.
По данным FIGO, опубликованным в 2019 г., была также предложена классификация PAS, включающая в себя 3 степени аномальной инвазии трофобласта (плаценты) [25]:
- 1 степень (PAS 1) – плотное прикрепление плаценты или прирастание ее к поверхностному слою миометрия (placenta adherense or acreta);
- 2 степень (PAS 2) – врастание плаценты в слой миометрия без прорастания серозной оболочки матки (placenta increta), поверхностная инвазия;
- 3 степень (PAS 3) – прорастание плацентой всех слоев матки (placenta percreta), глубокая инвазия:
- 3a – прорастание ограничено серозной оболочкой матки;
- 3b – прорастание всех слоев матки с инвазией в стенку мочевого пузыря;
- 3c – прорастание всех слоев матки с инвазией в соседние ткани или органы малого таза.
Топографическая классификация врастания плаценты подразумевает 4 типа инвазии [26]:
- 1 тип – прорастание серозной оболочки матки с врастанием в заднюю стенку мочевого пузыря и вовлечением верхних мочепузырных и маточных артерий;
- 2 тип – врастание в параметрий с вовлечением маточных, мочеточниковых и запирательных артерий;
- 3 тип – врастание в шейку матки и стенку влагалища с вовлечением влагалищных и нисходящих ветвей маточных артерий;
- 4 тип – врастание в шейку матки и стенку влагалища с фиброзными изменениями между маткой и мочевым пузырем.
Основным методом диагностики врастания плаценты во время беременности является ультразвуковое исследование (УЗИ). Метаанализ, основанный на результатах обследования 5307 пациенток (54 исследования), показал высокую эффективность УЗИ в диагностике врастания плаценты с чувствительностью 87,03% и специфичностью 86,34%. При этом наилучшей диагностической и прогностической ценностью обладает цветная допплерография, продемонстрировавшая чувствительность 90,74% и специфичность 87,68% [27–29]. Однако, к сожалению, не все случаи врастания плаценты диагностируются до родоразрешения при помощи УЗИ. Так, по данным мультицентрового исследования из 158 пациенток с врастанием плаценты, только у 53% данный диагноз был установлен антенатально [30]. Также следует отметить, что УЗИ имеет низкую диагностическую ценность при локализации плаценты по задней стенке матки [31]. В качестве дополнительного инструментального метода исследования, позволяющего детализировать топографию ворсин и глубину их проникновения, применяют магнитно-резонансную томографию (МРТ), чувствительность и специфичность которой, по данным систематического обзора, составила 86,5 и 96,8% соответственно при placenta percreta, 94,4 и 98,8% – при placenta accreta, 100 и 97,3% – при placenta increta [32, 33]. Тем не менее ряд авторов полагают, что для МРТ характерно достаточное количество как ложноположительных, так и ложноотрицательных результатов [34].
Поскольку на сегодняшний день отсутствуют инструментальные методы исследования, позволяющие со 100% чувствительностью и специфичностью установить диагноз врастания плаценты антенатально, широко проводятся лабораторные исследования, направленные на поиск биомаркеров, ассоциированных с глубиной инвазии трофобласта. Среди последних следует отметить β-хорионический гонадотропин, плазменный протеин, ассоциированный с беременностью (PAPP)-A, ангиогенные факторы (сосудисто-эндотелиальный фактор роста (VEGF), ангиопоэтин (Ang)-2, растворимую fms-подобную тирозинкиназу (sFlt)-1, рецептор VEGF (VEGFR-2), внеклеточную фетальную ДНК (cffDNA), а также специфичные для плаценты микро-РНК и м-РНК плацентарного лактогена человека – hPL. Однако необходимо понимать, что изменения концентрации данных маркеров могут наблюдаться и при других осложнениях беременности, таких как преэклампсия, задержка роста плода и преждевременные роды [2, 35, 36].
В 2015 г. был рассчитан индекс – Placenta Accreta Index (PAI) – для прогнозирования врастания плаценты у пациенток, входящих в группу высокого риска. Данный показатель учитывает клинические (перенесенные хирургические вмешательства на матке, их характер и количество) и ультразвуковые критерии (локализацию плаценты, количество и размер сосудистых лакун, толщину миометрия в области нижнего сегмента матки) и рассчитывается по 9-балльной шкале, где 0 баллов соответствует порядка 2% вероятности врастания, а 9 баллов – 96% вероятности [3, 37].
Тактика ведения пациенток с аномальным прикреплением плаценты зависит от глубины инвазии ворсин, объема предшествующей кровопотери, квалификации хирургов, а также желания женщины сохранить репродуктивную функцию. Различают органосохраняющие (консервативные) методы хирургического лечения и органоуносящие (радикальные), к которым относится гистерэктомия [38]. Среди консервативных методов следует выделить [39]:
- ручное отделение плаценты (так называемая экстирпативная техника);
- оставление плаценты in situ с последующей выжидательной тактикой;
- одноэтапную консервативную хирургическую тактику;
- процедуру Triple-P.
В настоящее время не существует единого мнения относительно оптимального ведения пациенток с врастанием плаценты. Традиционная тактика, предполагающая КС с последующей гистерэктомией, характеризуется высокой материнской заболеваемостью вследствие развития интра- и послеоперационных осложнений – повреждения мочевыводящих путей, кишечника и тазовых нервов, а также нарушения репродуктивной функции и снижения качества жизни. Ручное отделение плаценты при наличии врастания часто приводит к массивному кровотечению, поэтому его следует применять только в случае низкой вероятности врастания (PAI=0 баллов) – при частичном или полном плотном прикреплении плаценты. Инновационные подходы, направленные на сохранение матки с оставлением вросшей плаценты in situ, в том числе в сочетании с приемом метотрексата и/или с последующим удалением плацентарной ткани методом гистерорезектоскопии, позволяют сохранить фертильность, а также способствуют минимизации кровопотери и повреждения соседних органов. В ряде случаев оставление плаценты in situ целесообразно в тех ситуациях, когда необходима транспортировка пациентки в стационар 3-й группы. Применение данной тактики основывается на ожидаемом прогрессирующем снижении кровоснабжения матки и плаценты, что приводит к вторичному некрозу ворсин и постепенному самостоятельному отделению плаценты от стенки матки и соседних органов малого таза. Однако нужно учитывать, что данный метод сопряжен с возникновением позднего послеродового кровотечения и септических осложнений. Кроме того, при использовании данного метода желательно нахождение пациентки в условиях стационара [39, 40]. Так, по данным ретроспективного исследования, проведенного de Marcillac F.D. et al. в 2016 г., в которое были включены пациентки (n=15) с врастанием плаценты и оставлением ее in situ, консервативное лечение было успешным в 80% наблюдений. Случаев материнской летальности не было. Позднее послеродовое кровотечение произошло у 4 пациенток (33,3%) и потребовало проведения в одном наблюдении эмболизации маточных артерий, а в трех других – гистерэктомии. У 4 пациенток через 2,6±0,5 месяца после родов развился эндометрит. Средняя продолжительность времени, через которое наступило самопроизвольное рождение плаценты, составила 23,0±7,2 недели [41]. Одноэтапная консервативная хирургическая тактика заключается в резекции миометрия в области врастания плаценты с последующей немедленной реконструкцией стенки матки и, при необходимости, укреплением мочевого пузыря. При этом извлечение плода происходит либо через поперечный разрез на матке выше верхней границы врастания плаценты, либо посредством донного кесарева сечения. Затем осуществляют деваскуляризацию органов малого таза при помощи управляемой баллонной окклюзии общих подвздошных артерий или брюшного отдела аорты [42]. При невозможности использования эндоваскулярных методик выполняется иссечение маточной аневризмы в условиях наложения турникетов выше и ниже уровня врастания плаценты (рисунок А). Далее производится иссечение маточной грыжи вместе с плацентой без предварительных попыток ее отделения с последующей реконструкцией дефекта миометрия (метропластикой) (рисунок Б).[*]
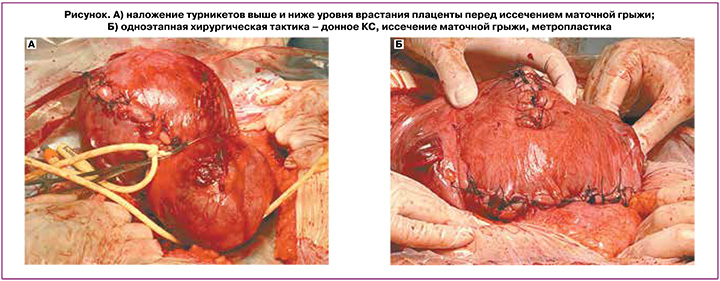
При последующем развитии гипотонии нижнего маточного сегмента целесообразно применить наложение компрессионных швов или выполнить баллонную тампонаду матки в сочетании с введением утеротоников. В качестве проведения естественной тампонады, по данным Allen L. et al. (2018), может использоваться также и шейка матки, которую следует ввернуть в полость матки с последующим подшиванием передней губы к передней стенке нижнего сегмента матки, а также, при необходимости, задней губы к задней стенке нижнего сегмента [43].
Недавно была предложена новая консервативная методика, называемая «процедурой Triple-P», позволяющая не только минимизировать объем интраоперационной кровопотери, но также сохранить структуру матки и соседних органов (мочевого пузыря). Ее цель состоит в отсутствии рассечения сосудисто-плацентарных венозных синусов, иссечения миометрия и восстановления дефекта матки во время операции КС. Основные этапы этой процедуры включают: трансабдоминальное УЗИ с определением локализации верхнего края плаценты, проведение КС с рассечением матки выше уровня плаценты, извлечение плода, ушивание разреза на матке, деваскуляризацию органов малого таза за счет установки внутриартериальных баллонных катетеров в передний отдел внутренних подвздошных артерий (или лигирования внутренних подвздошных артерий). На этом операция завершается; попыток удалить всю плаценту с иссечением миометрия и восстановлением дефекта стенки матки не производится. Если имеет место врастание плаценты в заднюю стенку мочевого пузыря, то плацентарную ткань, проникающую в мочевой пузырь, оставляют на месте, чтобы избежать цистотомии. Дальнейшее ведение пациентки производится согласно протоколу «оставление плаценты in situ» [44].
Заключение
Таким образом, врастание плаценты является сложной мультидисциплинарной проблемой. Частота встречаемости данной патологии неуклонно растет, в том числе из-за повышения частоты абдоминального родоразрешения и применения вспомогательных репродуктивных технологий, что позволяет рассматривать данную ситуацию в качестве ятрогенного осложнения. Антенатальная диагностика врастания плаценты является непростой задачей, поскольку ни один из предложенных инструментальных методов исследования на сегодняшний день не обладает 100% чувствительностью и специфичностью. Общепринятым и доступным методом диагностики врастания плаценты является УЗИ в сочетании с цветной допплерографией, однако отсутствие эхографических маркеров инвазии ворсин плаценты в миометрий не позволяет исключить данный диагноз. Исходы родоразрешения во многом зависят от квалификации специалистов и технических возможностей стационара, поэтому пациентки группы высокого риска по врастанию плаценты должны быть направлены для родоразрешения в стационары 3-го уровня, оснащенные современным оборудованием для оказания высокотехнологичной медицинской помощи.
____________________
* Авторы статьи «Врастание плаценты: современный взгляд на вопросы этиопатогенеза и акушерской тактики» (Игнатко И.В., Богомазова И.М., Тимохина Е.В., Белоусова В.С., Федюнина И.А., Карданова М.А., Самара А.Б. и Гуцу В. Врастание плаценты: современный взгляд на вопросы этиопатогенеза и акушерской тактики. Акушерство и гинекология. 2024; 1: 5-11) сообщают о том, что на рисунке А (стр. 9) представлен метод дистального компрессионного гемостаза с применением турникетов без баллонной тампонады влагалища, запатентованный Куликовым Ильясом Александровичем (номер патентного изобретения – 2708369, авторы: Куликов Ильяс Александрович (RU), Белоусова Тамара Николаевна (RU), Соваев Николай Иванович (RU), Плахотина Елена Николаевна (RU), Милютина Екатерина Романовна (RU), Павлютина Карина Михайловна (RU), Латышев Роман Вячеславович (RU); патентообладатель – Куликов Ильяс Александрович (RU)) и описанный в статье: Куликов И.А., Шмаков Р.Г., Белоусова Т.Н., Плахотина Е.Н., Низяева Н.В., Гейлис И.А., Искаков Д.Д., Милютина Е.Р., Вдовиченко Е.А., Прочаковский Д.В. Эффективность метода дистального компрессионного гемостаза с применением турникетов в сочетании с баллонной тампонадой влагалища вагинальным катетером Жуковского при родоразрешении беременных с врастанием плаценты. Акушерство и гинекология. 2022; 10: 58-66. https://dx.doi.org/10.18565/aig.2022.10.58-66 (2-я группа (сравнения) – 31 пациентка, которым проводился дистальный компрессионный гемостаз с применением турникетов без баллонной тампонады влагалища).
- Hecht J.L., Baergen R., Ernst L.M., Katzman P.J., Jacques S.M., Jauniaux E. et al. Classification and reporting guidelines for the pathology diagnosis of placenta accreta spectrum (PAS) disorders: recommendations from an expert panel. Mod. Pathol. 2020;33(12):2382-96. https://dx.doi.org/10.1038/s41379-020-0569-1.
- Arakaza A., Zou L., Zhu J. Placenta accrete spectrum diagnosis challenges and controversies in current obstetrics: a review. Int. J. Womens Health. 2023;15:635-54. https://dx.doi.org/10.2147/IJWH.S395271.
- Jauniaux E., Bhide A., Kennedy A., Woodward P., Hubinont C., Collins S.; FIGO Placenta Accreta Diagnosis and Management Expert Consensus Panel. FIGO consensus guidelines on placenta accreta spectrum disorders: Prenatal diagnosis and screening. Int. J. Gynaecol. Obstet. 2018;140(3):274-80.https://dx.doi.org/10.1002/ijgo.12408.
- Berkley E.M., Abuhamad A. Imaging of placenta accreta spectrum. Clin. Obst. Gynecol. 2018;61(4):755-65. https://dx.doi.org/10.1097/GRF.0000000000000407.
- Jauniaux E., Chantraine F., Silver R.M., Langhoff-Roos J.; FIGO Placenta Accreta Diagnosis and Management Expert Consensus Panel. FIGO consensus guidelines on placenta accreta spectrum disorders: Epidemiology. Int. J. Gynaecol. Obstet. 2018;140(3):265-73. https://dx.doi.org/10.1002/ijgo.12407.
- Забелина Т.М., Васильченко О.Н., Каримова Г.Н., Ежова Л.С., Учеваткина П.В., Шмаков Р.Г. Родоразрешение беременных с врастанием плаценты без рубца на матке. Акушерство и гинекология. 2021;4:150-6. [Zabelina T.M., Vasilchenko O.N., Karimova G.N., Ezhova L.S., Uchevatkina P.V., Shmakov R.G. Delivery of pregnant women with placenta increta and no uterine scar. Obstetrics and Gynecology. 2021;(4):150-6. (in Russian)]. https://dx.doi.org/10.18565/aig.2021.4.150-156.
- Организация объединенных наций. Новости ООН, 16 июня 2021. ВОЗ: все больше женщин рожают с помощью кесарева сечения при отсутствии медицинских показаний. Доступно по: http://news.un.org/ru/story/2021/06/1404792. [United Nations. UN News, 2021, June 16. WHO: more and more women are giving birth by caesarean section in the absence of medical indications. Available at: http://news.un.org/ru/story/2021/06/1404792.(in Russian)].
- Betran A.P., Ye J., Moller A.B., Souza J.P., Zhang J. Trends and projections of caesarean section rates: global and regional estimates. BMJ Glob. Health. 2021;6(6):e005671. https://dx.doi.org/10.1136/bmjgh-2021-005671.
- The Lancet. Stemming the global caesarean section epidemic. Lancet. 2018;392(10155):1279. https://dx.doi.org/10.1016/S0140-6736(18)32394-8.
- Thurn L., Lindqvist P.G., Jakobsson M., Colmorn L.B., Klungsoyr K., Bjarnadóttir R.I. et al. Abnormally invasive placenta-prevalence, risk factors and antenatal suspicion: results from a large population-based pregnancy cohort study in the Nordic countries. BJOG. 2016;123(8):1348-55.https://dx.doi.org/10.1111/1471-0528.13547.
- Marshall N.E., Fu R., Guise J.M. Impact of multiple cesarean deliveries on maternal morbidity: a systematic review. Am. J. Obstet. Gynecol. 2011;205(3):262.e1-8. https://dx.doi.org/10.1016/j.ajog.2011.06.035.
- Jauniaux E., Collins S., Burton G.J. Placenta accreta spectrum: pathophysiology and evidence-based anatomy for prenatal ultrasound imaging.Am. J. Obstet. Gynecol. 2018;218(1):75-87. https://dx.doi.org/10.1016/j.ajog.2017.05.067.
- Morlando M., Collins S. Placenta accreta spectrum disorders: challenges, risks, and management strategies. Int. J. Womens Health. 2020;12:1033-45.https://dx.doi.org/10.2147/IJWH.S224191.
- Badr D.A., Al Hassan J., Wehbe G.S., Ramadan M.K. Uterine body placenta accreta spectrum: A detailed literature review. Placenta. 2020;95:44-52.https://dx.doi.org/10.1016/j.placenta.2020.04.005.
- Sharma S., Godbole G., Modi D. Decidual control of trophoblast invasion. Am. J. Reprod. Immunol. 2016;75(3):341-50. https://dx.doi.org/10.1111/aji.12466
- Zhang X., Wei H. Role of decidual natural killer cells in human pregnancy and related pregnancy complications. Front. Immunol. 2021;12:728291.https://dx.doi.org/10.3389/fimmu.2021.728291.
- Laban M., Ibrahim E.A., Elsafty M.S., Hassanin A.S. Placenta accreta is associated with decreased decidual natural killer (dNK) cells population: a comparative pilot study. Eur. J. Obstet. Gynecol. Reprod. Biol. 2014;181:284-8. https://dx.doi.org/10.1016/j.ejogrb.2014.08.015.
- Carlino C., Rippo M.R., Lazzarini R., Monsurrò V., Morrone S., Angelini S. et al. Differential microRNA expression between decidual and peripheral blood natural killer cells in early pregnancy. Hum. Reprod. 2018;33(12):2184-95. https://dx.doi.org/10.1093/humrep/dey323
- Jansen C.H.J.R., Kastelein A.W., Kleinrouweler C.E., van Leeuwen E., De Jong K.H., Pajkrt E., van Noorden C.J.F. Development of placental abnormalities in location and anatomy. Acta Obstet. Gynecol. Scand. 2020;99(8):983-93. https://dx.doi.org/10.1111/aogs.13834
- Qian Z.-D, Weng Y., Wang C.-F., Huang L.-L., Zhu X.-M. Research on the expression of integrin β3 and leukaemia inhibitory factor in the decidua of women with cesarean scar pregnancy. BMC Pregnancy Childbirth. 2017;17(1):84. https://dx.doi.org/10.1186/s12884-017-1270-3.
- Torabi S., Sheikh M., Masrour F.F., Shamshirsaz A.A., Bateni Z.H., Nassr A.A. et al. Uterine artery Doppler ultrasound in second pregnancy with previous elective cesarean section. J. Matern. Fetal Neonatal Med. 2019;32(13):2221-7.https://dx.doi.org/10.1080/14767058.2018.1430132.
- Flo K., Widnes C., Vårtun Å., Acharya G. Blood flow to the scarred gravid uterus at 22–24 weeks of gestation. BJOG. 2014;121(2):210-5.https://dx.doi.org/10.1111/1471-0528.12441.
- Shigemitsu A., Naruse K., Kobayashi H. Hypoxia promotes extravillous trophoblast cell invasion through the hypoxia-inducible factor urokinase-type plasminogen activator receptor pathway. Gynecol. Obstet. Invest.2022;87(3-4):232-41. https://dx.doi.org/10.1159/000525851.
- Zhao H., Wong R.J., Stevenson D.K. The impact of hypoxia in early pregnancy on placental cells. Int. J. Mol. Sci. 2021;22(18):9675. https://dx.doi.org/10.3390/ijms22189675.
- Jauniaux E., Ayres-de-Campos D., Langhoff-Roos J., Fox K.A., Collins S.; FIGO Placenta Accreta Diagnosis and Management Expert Consensus Panel. FIGO classification for the clinical diagnosis of placenta accreta spectrum disorders. Int. J. Gynaecol. Obstet. 2019;146(1):20-4. https://dx.doi.org/10.1002/ijgo.12761.
- Palacios-Jaraquemada J.M., D'Antonio F., Buca D., Fiorillo A., Larraza P. Systematic review on near miss cases of placenta accreta spectrum disorders: correlation with invasion topography, prenatal imaging, and surgical outcome. J. Matern. Fetal Neonatal Med. 2020;33(19):3377-84. https://dx.doi.org/10.1080/14767058.2019.1570494.
- Maged A.M., El-Mazny A., Kamal N., Mahmoud S.I., Fouad M., El-Nassery N. et al. Diagnostic accuracy of ultrasound in the diagnosis of placenta accreta spectrum: systematic review and meta-analysis. BMC Pregnancy Childbirth. 2023;23(1):354. https://dx.doi.org/10.1186/s12884-023-05675-6.
- De Oliveira Carniello M., Oliveira Brito L.G., Sarian L.O., Bennini J.R. Diagnosis of placenta accreta spectrum in high-risk women using ultrasonography or magnetic resonance imaging: systematic review and meta-analysis. Ultrasound Obstet. Gynecol. 2022;59(4):428-36. https://dx.doi.org/10.1002/uog.24861.
- D'Antonio F., Iacovella C., Bhide A. Prenatal identification of invasive placentation using ultrasound: systematic review and meta-analysis. Ultrasound Obstet. Gynecol. 2013;42(5):509-17. https://dx.doi.org/10.1002/uog.13194.
- Bailit J.L., Grobman W.A., Rice M.M., Reddy U.M., Wapner R.J., Varner M.W. et al.; Eunice Kennedy Shriver National Institute of Child Health and Human Development (NICHD) Maternal-Fetal Medicine Units (MFMU) Network. Morbidly adherent placenta treatments and outcomes. Obstet. Gynecol. 2015;125(3):683-9. https://dx.doi.org/10.1097/AOG.0000000000000680.
- Tinari S., Buca D., Cali G., Timor-Tritsch I., Palacios-Jaraquemada J., Rizzo G. et al. Risk factors, histopathology and diagnostic accuracy in posterior placenta accreta spectrum disorders: systematic review and meta-analysis. Ultrasound Obstet. Gynecol. 2021;57(6):903-9. https://dx.doi.org/10.1002/uog.22183
- Morel O., Collins S.L., Uzan-Augui J., Masselli G., Duan J., Chabot-Lecoanet A.C. et al.; International Society for Abnormally Invasive Placenta (IS-AIP). A proposal for standardized magnetic resonance imaging (MRI) descriptors of abnormally invasive placenta (AIP) – from the International Society for AIP. Diagn. Interv. Imaging. 2019;100(6):319-25. https://dx.doi.org/10.1016/j.diii.2019.02.004.
- Familiari A., Liberati M., Lim P., Pagani G., Cali G., Buca D. et al. Diagnostic accuracy of magnetic resonance imaging in detecting the severity of abnormal invasive placenta: a systematic review and meta-analysis. Acta Obstet. Gynecol. Scand. 2018;97(5):507-20. https://dx.doi.org/10.1111/aogs.13258.
- Einerson B.D., Rodriguez C.E., Kennedy A.M., Woodward P.J., Donnelly M.A., Silver R.M. Magnetic resonance imaging is often misleading when used as an adjunct to ultrasound in the management of placenta accreta spectrum disorders. Am. J. Obstet. Gynecol. 2018;218(6):618.e1-618.e7.https://dx.doi.org/10.1016/j.ajog.2018.03.013.
- Zhang T., Wang S. Potential serum biomarkers in prenatal diagnosis of placenta accreta spectrum. Front. Med. (Lausanne). 2022;9:860186.https://dx.doi.org/10.3389/fmed.2022.860186.
- Виницкий А.А., Шмаков Р.Г. Современные представления об этиопатогенезе врастания плаценты и перспективы его прогнозирования молекулярными методами диагностики. Акушерство и гинекология. 2017;2: 5-10. [Vinitskiy A.A., Shmakov R.G. The modern concepts of etiology and pathogenesis placenta accreta and prospects of its prediction by molecular diagnostics. Obstetrics and Gynecology. 2017;(2):5-10. (in Russian)].https://dx.doi.org/10.18565/aig.2017.2.5-10.
- Rac M.W.F., Dashe J.S., Wells C.E., Moschos E., McIntire D.D., Twickler D.M. Ultrasound predictors of placental invasion: the placenta accreta index. Am. J. Obstet. Gynecol. 2015;212(3):343.e1-7. https://dx.doi.org/10.1016/j.ajog.2014.10.022.
- Jauniaux E., Hussein A.M., Fox K.A., Collins S.L. New evidence-based diagnostic and management strategies for placenta accreta spectrum disorders. Best Pract. Res. Clin. Obstet. Gynaecol. 2019;61:75-88. https://dx.doi.org/10.1016/j.bpobgyn.2019.04.006.
- Sentilhes L., Kayem G., Chandraharan E., Palacios-Jaraquemada J., Jauniaux E.; FIGO Placenta Accreta Diagnosis and Management Expert Consensus Panel. FIGO consensus guidelines on placenta accreta spectrum disorders: Conservative management. Int. J. Gynaecol. Obstet. 2018;140(3):291-8.https://dx.doi.org/10.1002/ijgo.12410.
- Sentilhes L., Kayem G., Silver R.M. Conservative management of placenta accreta spectrum. Clin. Obstet. Gynecol. 2018;61(4):783-94.https://dx.doi.org/10.1097/GRF.0000000000000395.
- de Marcillac F.D., Lecointre L., Guillaume A., Sananes N., Fritz G., Viville B. et al. Morbimortalité maternelle associée au traitement conservateur d’un placenta anormalement adhérent (accreta) diagnostiqué en anténatal. À propos d’une série continue de 15 cas [Maternal morbidity and mortality associated with conservative management for placenta morbidly adherent (accreta) diagnosed during pregnancy. Report of 15 cases]. J. Gynecol. Obstet. Biol. Reprod. (Paris). 2016;45(8):849-58. French. https://dx.doi.org/10.1016/j.jgyn.2016.03.012.
- Курцер М.А., Бреслав И.Ю., Латышкевич О.А., Григорьян А.М. Временная баллонная окклюзия общих подвздошных артерий у пациенток с рубцом на матке после кесарева сечения и placenta accreta. Преимущества и возможные осложнения. Акушерство и гинекология. 2016;12: 70-5. [Kurtser M.A., Breslav I.Yu., Latyshkevich O.A., Grigoryan A.M. Temporary balloon occlusion of the common iliac arteries in patients with post-cesarean uterine scar and placenta accreta: Advantages and possible complications. Obstetrics and Gynecology. 2016;(12):70-5. (in Russian)].https://dx.doi.org/10.18565/aig.2016.12.70-5.
- Allen L., Jauniaux E., Hobson S., Papillon-Smith J., Belfort M.A.; FIGO Placenta Accreta Diagnosis and Management Expert Consensus Panel. FIGO consensus guidelines on placenta accreta spectrum disorders: Nonconservative surgical management. Int. J. Gynaecol. Obstet. 2018;140(3):281-90.https://dx.doi.org/10.1002/ijgo.12409.
- Piñas Carrillo A., Chandraharan E. Placenta accreta spectrum: Risk factors, diagnosis and management with special reference to the Triple P procedure. Womens Health (Lond). 2019;15:1745506519878081.https://dx.doi.org/10.1177/1745506519878081.
Received 07.11.2023
Accepted 14.12.2023
Irina V. Ignatko, Dr. Med. Sci., Corresponding Member of the Russian Academy of Sciences, Professor of the Russian Academy of Sciences, Professor, Head of the Department of Obstetrics, Gynecology and Perinatology of the N.V. Sklifosovsky Institute of Clinical Medicine, I.M. Sechenov First Moscow State Medical University, Ministry of Health of the Russian Federation (Sechenov University), 119991, Russia, Moscow, Trubetskaya str., 8-2,
ignatko_i_v@staff.sechenov.ru, https://orcid.org/0000-0002-9945-3848
Irina M. Bogomazova, PhD, Associate Professor, Associate Professor of the Department of Obstetrics, Gynecology and Perinatology of the N.V. Sklifosovsky Institute of Clinical Medicine, I.M. Sechenov First Moscow State Medical University, Ministry of Health of the Russian Federation (Sechenov University), 119991, Russia, Moscow, Trubetskaya str., 8-2, +7(926)305-04-03,
bogomazova_i_m@staff.sechenov.ru, https://orcid.org/0000-0003-1156-7726
Elena V. Timokhina, Dr. Med. Sci., Associate Professor, Professor of the Department of Obstetrics, Gynecology and Perinatology of the N.V. Sklifosovsky Institute of Clinical Medicine, I.M. Sechenov First Moscow State Medical University, Ministry of Health of the Russian Federation (Sechenov University),
119991, Russia, Moscow, Trubetskaya str., 8-2,
timokhina_i_m@staff.sechenov.ru, https://orcid.org/0000-0001-6628-0023
Vera S. Belousova, Dr. Med. Sci., Associate Professor, Professor of the Department of Obstetrics, Gynecology and Perinatology of the N.V. Sklifosovsky Institute of Clinical Medicine, I.M. Sechenov First Moscow State Medical University, Ministry of Health of the Russian Federation (Sechenov University),
119991, Russia, Moscow, Trubetskaya str., 8-2,
belousova_v_s@staff.sechenov.ru, https://orcid.org/0000-0001-8332-7073
Irina A. Fedyunina, PhD, Associate Professor of the Department of Obstetrics, Gynecology and Perinatology of the N.V. Sklifosovsky Institute of Clinical Medicine,
I.M. Sechenov First Moscow State Medical University, Ministry of Health of the Russian Federation (Sechenov University), 119991, Russia, Moscow, Trubetskaya str., 8-2,
fedyunina_i_m@staff.sechenov.ru , https://orcid.org/0000-0002-9661-5338
Madina A. Kardanova, PhD, Assistant of the Department of Obstetrics, Gynecology and Perinatology of the N.V. Sklifosovsky Institute of Clinical Medicine, I.M. Sechenov First Moscow State Medical University, Ministry of Health of the Russian Federation (Sechenov University), 119991, Russia, Moscow, Trubetskaya str., 8-2,
kardanova_i_m@staff.sechenov.ru, https://orcid.org/0000-0002-4315-0717
Alina B. Samara, student of the N.V. Sklifosovsky Institute of Clinical Medicine, I.M. Sechenov First Moscow State Medical University, Ministry of Health of the Russian Federation (Sechenov University), 119991, Russia, Moscow, Trubetskaya str., 8-2,
linaasamaraa@gmail.com, https://orcid.org/0000-0001-8266-6524
Vladimir Gutsu, Resident of the Department of Obstetrics, Gynecology and Perinatology of the N.V. Sklifosovsky Institute of Clinical Medicine, I.M. Sechenov First Moscow State Medical University, Ministry of Health of the Russian Federation (Sechenov University), 119991, Russia, Moscow, Trubetskaya str., 8-2,
gutsu_vladimir@mail.ru,
https://orcid.org/0009-0000-3712-3280
Corresponding author: Irina M. Bogomazova,
bogomazova_i_m@staff.sechenov.ru



