Хронический цервицит (ХЦ) с персистирующей папилломавирусной инфекцией приобретает особое значение из-за высокого риска развития неопластических процессов и рака шейки матки [1–4]. Вирус папилломы человека (ВПЧ) считается самой распространенной из всех инфекций, передаваемых половым путем (ИППП), и выявляется у 82% сексуально активного населения [5, 6]. Ежегодно во всех странах регистрируется более 500 тысяч новых случаев рака шейки матки, свыше 300 тысяч женщин умирают от этого заболевания [7, 8]. При поражении высокоонкогенными типами ВПЧ может иметь место интеграция вирусного генома в геном инфицированной эпителиальной клетки, что приводит к продукции вирусных онкогенов и онкобелков [9].
Один из них – онкобелок Е7, воздействуя на клеточный цикл, вызывает неконтролируемую пролиферацию зараженных ВПЧ клеток и гиперэкспрессию белка р16ink4-α. Гиперэкспрессия онкопротеина р16ink4α и его накопление в цитоплазме позволяют на доклиническом этапе выявить предраковые состояния и самые ранние формы рака шейки матки [10–13].
В настоящее время общепризнано участие метаболитов эстрогенов в развитии неопластических процессов в тканях шейки матки и в повреждении ДНК. У здоровых пациентов концентрация 2-гидрокисэстрона (2-ОНЕ1) должна превышать концентрацию 16α-гидроксиэстрона (16α-ОНЕ1) как минимум в 2 раза [14].
Установлено, что при персистенции ВПЧ в цервикальном эпителии образуется аномально высокое количество 16α-ОНЕ1, который является сильным агонистом эстрадиола и ковалетно связывается с рецепторами эстрогена. При этом блокируется апоптоз, усиливается клеточная пролиферация и стимулируется экспрессия онкогена Е7, ответственного за опухолевую трансформацию клеток. Второй метаболит – 2-ОНЕ1 является слабым агонистом эстрадиола и не оказывает пролиферативного действия, а по некоторым данным даже блокирует пролиферацию. В результате в тканях шейки матки формируется порочный круг, когда агрессивный метаболит 16α-ОНЕ1 создает благоприятные условия для развития опухоли, стимулируя синтез онкобелка Е7. Чрезвычайно важно определение онкогенного потенциала вируса у женщин с хроническим цервицитом и ВПЧ-инфекцией, поскольку именно это позволяет сделать выбор между консервативной или оперативной тактикой лечения.
Целью исследования стало изучение возможности дифференцированного подхода к диагностике и лечению ХЦ у женщин с ВПЧ-инфекцией в зависимости от биомаркеров пролиферации и канцерогенеза эпителия шейки матки – белка р16ink4α и соотношения метаболитов 2-гидроксиэстрона к 16α-гидроксиэстрону.
Материал и методы исследования
Всего в исследовании приняли участие 265 женщин: 245 с хроническим цервицитом и 20 здоровых. Они были распределены в три группы – основную, группу сравнения и контрольную. Основная группа, состоящая из 167 вирус-позитивных пациенток, по характеру течения инфекционного процесса была разделена на две подгруппы: в первую вошли 77 женщин с хронической персистирующей ВПЧ-инфекцией, во вторую – 90 с транзиторной формой ВПЧ-инфекции (в процессе наблюдения произошла элиминация вируса). Группа сравнения состояла из 78 женщин с хроническим цервицитом и отрицательным результатом ВПЧ, контрольная – из 20 здоровых женщин. Пациенткам проводили комплексное клинико-лабораторное обследование, бактериоскопическое и микробиологическое исследование отделяемого цервикального канала. Для обнаружения хламидий, микоплазм, уреаплазм, вируса простого герпеса, цитомегаловируса, высокоонкогенных и низкоонкогенных типов ВПЧ использовали метод полимеразной цепной реакции с генотипированием вирусов ВПЧ. Применяли также цитологические методы: традиционную и жидкостную цитологию мазков из экзо- и эндоцервикса, гистологическое исследование биоптатов шейки, иммуноцитохимическое исследование экспрессии белка p16ink4-α с экзо- и эндоцервикса на основе жидкостной цитологии, количественное определение метаболитов эстрадиола 2-ОНЕ1 и 16α-ОНЕ1 в утренней порции мочи методом иммуноферментного анализа с помощью тест-системы Estramet.
 Статистическую обработку полученных данных проводили с помощью пакета программ Exсel MS Office XP. Для качественных переменных рассчитывались абсолютные и относительные (%) величины. Для оценки достоверности различий в группах применяли непараметрический критерий χ2. Оценку достоверности различия величин исследованных показателей осуществляли по t-критерию Стьюдента для несвязанных совокупностей (достоверность при уровне значимости р<0,05). Сила ассоциаций с риском развития персистенции ВПЧ-инфекции оценивалась в значениях показателя соотношения шансов (odds ratio, OR) по формуле:
Статистическую обработку полученных данных проводили с помощью пакета программ Exсel MS Office XP. Для качественных переменных рассчитывались абсолютные и относительные (%) величины. Для оценки достоверности различий в группах применяли непараметрический критерий χ2. Оценку достоверности различия величин исследованных показателей осуществляли по t-критерию Стьюдента для несвязанных совокупностей (достоверность при уровне значимости р<0,05). Сила ассоциаций с риском развития персистенции ВПЧ-инфекции оценивалась в значениях показателя соотношения шансов (odds ratio, OR) по формуле:
OR=(a*d)/(b*c),
где а – число индивидуумов с наличием данного маркера в исследуемой группе; b – число индивидуумов с отсутствием данного маркера в исследуемой группе; с – число индивидуумов с наличием данного маркера в контрольной группе; d – число индивидуумов с отсутствием данного маркера в контрольной группе. Соотношение шансов указано с 95% доверительным интервалом. Границы доверительного интервала вычисляли по методу Katz. OR=l рассматривали как отсутствие ассоциации, OR>l – как положительную ассоциацию («фактор повышенного риска») и OR
Результаты исследования и их обсуждение
При обследовании 245 женщин репродуктивного возраста с верифицированным хроническим цервицитом (средний возраст – 28,9±0,62 года) выявлены клинические особенности заболевания в зависимости от инфицированности ВПЧ экзо- и эндоцервикса. Анализ генотипирования ВПЧ позволил установить качественную составляющую ВПЧ-тестирования шейки матки. Как в первой, так и во второй подгруппе установлено преобладание ВПЧ 16-го типа (28,6 и 22,2% соответственно, р<0,05). У больных с персистирующим течением наряду с доминированием ВПЧ 16-го типа отмечена высокая частота вирусов 52-го и 45-го типов (16,9 и 15,6% соответственно), в отличие от женщин с транзиторной формой, у которых обнаруживались вирусы 31-го (14,4%), 45-го и 52-го (10%) типов. ВПЧ 6-го типа превалировал у женщин первой подгруппы (32,5%) по сравнению со второй (16,7%).
Сочетанное инфицирование шейки матки различными типами ВПЧ установлено у 40% больных с персистирующим и у 18% с транзиторным течением заболевания, при этом 16-й и 18-й генотипы обнаружены у 7,8% пациенток с персистенцией ВПЧ, тогда как у женщин с транзиторной инфекцией ни одного случая такой ассоциации не выявлено. Достоверно чаще 16-й и 45-й типы наблюдали у 9,1% женщин первой подгруппы и только у 2,2% женщин второй (p<0,05). Сочетание ВПЧ 16-го и 52-го типов регистрировали у 7,8% женщин с хроническим течением инфекции и у 1,1% – с транзиторным.

Проведенные исследования микрофлоры цервикального канала показали, что у пациенток с персистирующей формой ВПЧ-инфекции хронический цервицит протекал на фоне ИППП и условно-патогенных возбудителей достоверно чаще, чем у больных с транзиторным течением. ВПЧ-инфекция сочеталась с хламидиями у 23,4% женщин I подгруппы и лишь у 10% – II подгруппы и у 7,7% – группы сравнения (p<0,05). Наличие хламидийной инфекции коррелировало с 16-м (r=0,42; p<0,05), 45-м (r=0,63; p<0,05) и 33-м (r=0,46; p<0,05) типами ВПЧ. С одинаковой частотой (33,2%) во всех группах обнаруживались уреаплазмы и микоплазмы.
Доминирующим по частоте инфекционным фактором оказались грибы Candida, которые обнаруживались у 33,8% больных хронической ВПЧ-инфекцией и в 2 раза реже при транзиторной форме (p<0,05). Трихомонадная инфекция чаще выявлялась у пациенток I подгруппы (11,7%) по сравнению со II подгруппой (6,7%). Среди ассоциантов ВПЧ в цервикальном биотопе у больных с персистирующим течением превалировали также: ВПГ II типа (14,3%), Gardnerella vaginalis (25,9%), Staphylococcus sарrорhуticus и aureus (33,8 и 14,3% соответственно), Escherichia coli (20,8%), Klebsiella pneumonia (16,9%), Proteus spp. (13%) на фоне снижения Lactobacillus spp. (24,7%) и Bifidobacterium spp. (33,8%).
Анализ данных кольпоскопии у больных с хроническим цервицитом и персистенцией ВПЧ установил частую регистрацию аномальных кольпоскопических признаков (79,3%). Сочетания нескольких аномальных кольпоскопических картин (ацетобелого эпителия, мозаики, пунктации, йоднегативного эпителия) выявлены чаще в I подгруппе (63,6%) по сравнению со II подгруппой (32,2%; p<0,05). Остроконечные кондиломы шейки матки были обнаружены у 7,8% больных I и у 1,1% II подгруппы.
Морфологический раздел исследования включал использование традиционной и жидкостной цитологии цервикальных мазков, иммуноцитохимического исследования экспрессии р16ink4α в эпителии шейки матки и морфологического исследования биоптатов шейки. Оказалось, что у женщин II подгруппы основной группы и группы сравнения определялась только картина воспаления, тогда как у больных I подгруппы с хронической ВПЧ-инфекцией в 39% случаев была выявлена CIN I–III степени (рис. 1).
Сравнительный анализ данных традиционной и жидкостной цитологии мазков с экто- и эндоцервикса показал наличие дисплазии шейки матки I степени в 1,5 раза, II степени – в 1,3 раза и III степени – в 2,5 раза чаще при жидкостной цитологии, по сравнению с традиционной, что подтверждает информативность жидкостной цитологии.

По данным иммуноцитохимического исследования экспрессия р16ink4α в эпителии шейки матки оказалась положительной у 6 женщин из 34 больных с наличием CIN и персистенцией ВПЧ (у 2 – с CIN I, у 2 – с CIN II, у 2 – с CIN III).
Положительные результаты определения р16ink4α коррелировали с сочетанной ВПЧ-инфекцией высокого риска – 16 (r=0,8; p<0,05), 18 (r=0,54; p<0,05), 45 (r=0,65; p<0,05) типов, что определяет прямую связь выявления онкобелка с активностью высокоонкогенных типов ВПЧ. Следует отметить, что у двух р16-позитивных пациенток с персистенцией ВПЧ и CIN I после проведенной электроэксцизии шейки диагноз CIN I был подтвержден, тогда как у другой была обнаружена CIN III. В табл. 1 представлены результаты сопоставления цитологических и морфологических картин у р16-позитивных больных.
Таким образом, наличие белка р16ink4α отражает действительный риск прогрессии поражений шейки матки под действием вируса папилломы человека. Обращает на себя внимание тот факт, что у женщин с транзиторной формой ВПЧ-инфекции гистологически верифицирована CIN I в 9 случаях (16,3%). После стандартного лечения цервицита CIN I не обнаруживалась, то есть стойкие плоскоклеточные интраэпителиальные поражения исключают транзиторную форму ВПЧ-инфекции.
Исследование метаболитов эстрогенов в моче у наблюдаемых женщин показало, что гиперпродукция 16α-ОНЕ1 имеется у 85,7% больных с хроническим цервицитом и персистирующей ВПЧ-инфекцией, при цервиците и отсутствии ВПЧ – у 23,1%, транзиторной ВПЧ инфекции – у 16,7% пациенток и у 10% здоровых женщин (p<0,001) (рис. 2).
 При анализе показателей метаболитов эстрогенов было отмечено, что средние цифры соотношения 2-ОНЕ1/16α-ОНЕ1 у здоровых женщин контрольной группы составили 2,64±0,16. В I подгруппе больных с персистенцией ВПЧ показатель 2-ОНЕ1 оказался равным 17,63±1,85 нг/мл, 16α-ОНЕ1 – 14,52±1,31 нг/мл, что привело к уменьшению соотношения 2-OHЕ1/16α-OHЕ1 до 1,42±0,2 (рис. 3). Уровни соотношений метаболитов у пациенток с транзиторной формой ВПЧ-инфекции и больных с цервицитом без ассоциации с ВПЧ находились в пределах нормальных значений.
При анализе показателей метаболитов эстрогенов было отмечено, что средние цифры соотношения 2-ОНЕ1/16α-ОНЕ1 у здоровых женщин контрольной группы составили 2,64±0,16. В I подгруппе больных с персистенцией ВПЧ показатель 2-ОНЕ1 оказался равным 17,63±1,85 нг/мл, 16α-ОНЕ1 – 14,52±1,31 нг/мл, что привело к уменьшению соотношения 2-OHЕ1/16α-OHЕ1 до 1,42±0,2 (рис. 3). Уровни соотношений метаболитов у пациенток с транзиторной формой ВПЧ-инфекции и больных с цервицитом без ассоциации с ВПЧ находились в пределах нормальных значений.
Соотношение метаболитов эстрогенов, составлявшее менее 1,0, наблюдалось у 19 (24,7%) пациенток I подгруппы, причем у пяти из шести р16-позитивных женщин. При этом была обнаружена связь «экстремально низкого» уровня соотношения метаболитов эстрадиола (0,45±0,18) с положительными результатами экспрессии онкобелка р16ink4α (r=0,49; p<0,05). Следует отметить, что для женщин с указанным уровнем соотношения метаболитов эстрадиола была характерна неудовлетворительная кольпоскопическая картина со значительными поражениями в виде участков плотного ацетобелого эпителия и грубой пунктации. Нередко в этих случаях выявлялась и хламидийная инфекция. Таким образом, показатель соотношения метаболитов 2-ОНЕ1 к 16α-ОНЕ1 в сочетании с грубой аномальной кольпоскопической картиной эпителия шейки матки является объективным маркером прогрессирования неопластических изменений и требует активной тактики лечения таких больных. Детальный анализ показал, что снижение показателя соотношения метаболитов эстрогенов усугубляется рядом факторов: курением, отягощенной наследственностью по раку шейки матки, сопутствующей хламидийной инфекцией, медицинскими абортами, хроническим эндометритом, то есть отмечается у женщин, относящихся к группе риска рака шейки. Установлена достоверная связь этих факторов с низкими показателями соотношения метаболитов эстрогенов. Возможно, нарушение обмена эстрогенов с изменением соотношения метаболитов определяет формирование факторов риска рака шейки матки.
Как было отмечено, 6 женщинам с позитивной реакцией на р16ink4α, независимо от степени CIN, была проведена электроэксцизия шейки матки с целью расширенной биопсии и лечения. Остальным 60 больным проводилось лечение выявленных инфекций в комбинации с противовирусными препаратами и нормализацией биоценоза. Эпигенетическая терапия препаратом промисан дополнила основной курс лечения у 30 женщин, имеющих персистирующую форму вирусной инфекции и нарушенный обмен метаболитов эстрогенов. В состав промисана входит индол-3-карбинол и эпигаллокатехин-3-галлат, минеральный премикс, способные нормализовать обмен метаболитов, оказать противовоспалительный и антипролиферативный эффекты и усилить действие противовирусных препаратов [14].

Для оценки эффективности действия промисана 15 больных с ВПЧ-ассоциированным цервицитом были пролечены комбинацией данного препарата внутрь по 2 капсулы 2 раза в день с панавиром в свечах вагинально в течение 10 дней. Еще 15 больных применяли комбинацию промисана с a2-интерфероном вагинально по рекомендуемым схемам. Для сравнения 15 женщин получали только панавир и 15 – только a2-интерферон. Пациентки были сопоставимы по возрасту, экстрагенитальной патологии, акушерско-гинекологическому анамнезу, характеру воспалительного процесса, результатам ВПЧ-тестирования, кольпоскопического и цитологического методов исследования с вероятностью более 95%. На протяжении всего исследования женщины использовали барьерные методы контрацепции и вели дневник, в котором отмечали побочные эффекты терапии, их выраженность и продолжительность.
Через 6 месяцев лечения анализ результатов кольпоскопического исследования показал, что наиболее значимые позитивные изменения в равной степени наблюдались у женщин, принимавших промисан в сочетании с панавиром или с a2-интерфероном: кольпоскопическая картина отвечала норме у 12 (80,0%) и 11 (73,3%) пациенток соответственно. У больных, получавших только панавир в составе комплексной терапии, нормализации кольпоскопической картины удалось добиться у 4 (26,7%), среди получавших только a2-интерферон – у 5 (33,3%).
Оценка заключений цитологического исследования шейки матки показала, что CIN I и CIN II после проведенного лечения промисаном и панавиром регрессировали у всех пациенток, в то время как после лечения промисаном и a2-интерфероном цитологическая картина нормы наблюдалась у 2 женщин с CIN I (1,3%), а CIN II (р16ink4α негативная), выявленная у одной пациентки, регрессировала до CIN I степени. Из 12 больных с цитологическим диагнозом «воспаление» после лечения комбинацией промисаном с панавиром или с a2-интерфероном физиологическая норма отмечена у 11 (91,7%) и только у 5 (33,3%) не получавших промисан.
 Спустя 6 месяцев после терапии промисаном и панавиром анализ ПЦР на ВПЧ в соскобе цервикального канала выявил элиминацию вирусов у 13 (86,7%) пациенток, что подтверждено клинико-лабораторным выздоровлением. Сочетание 16-го и 58-го типов сохранилось у 2 женщин с цитологической картиной воспаления. ВПЧ-тестирование, проведенное у женщин, получавших комбинацию промисана с a2-интерфероном, выявило элиминацию вирусов у 14 (93,3%) и персистенцию 16-го типа ВПЧ в сочетании с 18-м и 33-м типами у 1 больной.
Спустя 6 месяцев после терапии промисаном и панавиром анализ ПЦР на ВПЧ в соскобе цервикального канала выявил элиминацию вирусов у 13 (86,7%) пациенток, что подтверждено клинико-лабораторным выздоровлением. Сочетание 16-го и 58-го типов сохранилось у 2 женщин с цитологической картиной воспаления. ВПЧ-тестирование, проведенное у женщин, получавших комбинацию промисана с a2-интерфероном, выявило элиминацию вирусов у 14 (93,3%) и персистенцию 16-го типа ВПЧ в сочетании с 18-м и 33-м типами у 1 больной.
Из 15 больных, получавших панавир без комбинации с промисаном, элиминация вируса зафиксирована у 4 (26,7%), при использовании только a2-интерферона – у 5 (33,3%). Лечение комбинацией промисана и повторного курса a2-интерферона было продолжено у всех больных с недостаточной эффективностью проведенной терапии
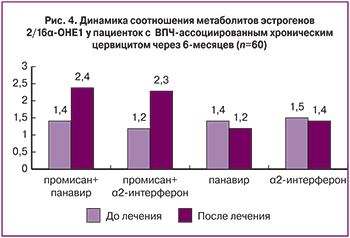
Иммуноферментный анализ, проведенный после 6 месяцев лечения, показал, что нормализации соотношения метаболитов эстрадиола удалось добиться у 13 (86,7%) женщин, получавших промисан с панавиром, и у 14 (93,3%) получавших промисан с a2-интерфероном. Средний индекс соотношения достоверно двукратно увеличился и составил 2,36±0,16 и 2,25±0,18 соответственно (табл. 2).
Необходимо отметить, что у женщин с регрессией дисплазии шейки матки, достигнутой в результате лечения, наблюдалось значительное изменение концентраций метаболитов эстрадиола в сторону резкого снижения агрессивного метаболита 16a-ОНЕ1. В то же время нормализация соотношения метаболитов эстрадиола не выявлена ни у одной женщины, пролеченной панавиром и a2-интерфероном без промисана. У таких пациенток, напротив, установлена тенденция к снижению показателя индекса 2ОНЕ1/16a-ОНЕ1. При использовании промисана частота побочных эффектов составляла около 8%. Сообщалось о тошноте и недомогании у 4,1%, кожных аллергических реакциях – у 1,2%, болях в эпигастрии – у 1,7%, головной боли – у 1% пациенток. Следует отметить, что нежелательные явления были минимальными и не носили стойкий характер.
Таким образом, при использовании комбинации эпигенетического препарата промисан в сочетании с панавиром или α2-интерфероном у пациенток с персистирующей ВПЧ-инфекцией и хроническим цервицитом была обнаружена высокая частота регрессии CIN и воспалительных явлений до цитологической нормы, элиминации ВПЧ и нормализации уровня метаболитов эстрадиола, что свидетельствует о высокой клинической эффективности данной схемы лечения.
Заключение
Клиническая картина персистирующего ВПЧ-ассоциированного цервицита характеризуется проявлениями в виде диспареунии у 10,4% больных, зуда и жжения во влагалище – у 20,8%, наличия остроконечных кондилом шейки матки и влагалища – у 38,9% пациенток. Хронический ВПЧ-индуцированный цервицит связан с медицинским абортом в анамнезе у 38,9%, неразвивающейся беременностью – у 15,6%, хроническим эндометритом – у 18,2%, бесплодием – у 11,7% и миомой тела матки – у 9,1% женщин. Особенностью микрофлоры цервикального канала при ВПЧ-ассоциированном цервиците является преобладание высокоокогенных типов ВПЧ 16, 52, 45, 31 в ассоциации с хламидиями, выявленными у 23,4% женщин, грибами Candida – у 33,8%, вирусом герпеса – у 14,3%, трихомонадами – у 11,7% и бактериальной флорой Staphylococcus sарrорhуticus и aureus – у 48,1%, E. coli – у 20,8% больных.
Белок р16ink4α определяется у 4,6% пациенток с хроническим ВПЧ-ассоциированным цервицитом на фоне цервикальной интраэпителиальной неоплазии, степень тяжести которой может быть различна, при этом аномальная кольпоскопическая картина регистрируется у 79,3% больных. При экспрессии онкобелка р16in кольпоскопические изменения носят характер картины значительного поражения эпителия шейки матки – ацетобелого эпителия, пунктации, мозаики или их сочетаний.
Хронический цервицит с персистирующей ВПЧ-инфекцией сопровождается сниженными показателями соотношения метаболитов эстрогенов 2-ОНЕ1/16α-ОНЕ1 в моче в среднем до 1,42±0,2, что в 2 раза ниже, чем у здоровых женщин. К факторам, усугубляющим снижение показателя соотношения метаболитов эстрогенов наряду с приемом оральных контрацептивов, курением, миомой тела матки относится и сопутствующая ВПЧ-инфекции микрофлора: при ассоциации с хламидиями индекс соотношения метаболитов эстрогенов снижен в 4,4 раза, трихомонадной инфекцией – в 2 раза. Нормализация обмена эстрогенов путем использования комбинации препарата промисан в комплексной терапии получена у 86,7% больных хроническим ВПЧ-ассоциированным цервицитом. Применение препарата промисан привело к повышению эффективности действия неспецифических противовирусных препаратов: регрессии воспалительной реакции и нетяжелых форм CIN до цитологической нормы у 86,7%, элиминации вируса папилломы человека у 93,3% женщин. Полученные данные свидетельствуют о возможности консервативной терапии персистирующих форм ВПЧ-инфекции, обусловленной высокоонкогенными типами ВПЧ, и цервиците у женщин. Результаты проведенного исследования подтвердили эффективность применения препарата промисан для лечения больных с CIN I–II при продолжительности курса лечения 6 месяцев (и более, если эффект недостаточный), что согласуется с имеющимися данными [14, 15]. Применение эпигенетической терапии препаратом промисан, содержащим индол-3-карбинол и эпигаллокатехин-3-галлат, в сочетании с противовирусными средствами патогенетически обосновано для лечения персистирующей ВПЧ-инфекции при хроническом цервиците и имеет перспективы для профилактики и лечения более тяжелых ВПЧ-ассоциированных заболеваний шейки матки.



