В условиях неблагоприятной демографической ситуации, складывающейся на территории Российской Федерации за последние годы, охрана репродуктивного здоровья населения стала одним из приоритетных направлений деятельности органов и учреждений системы здравоохранения.
Так, «грубый» показатель общей заболеваемости злокачественными новообразованиями женского населения России в 2017 г. составил 425,7 на 100 000 человек, прирост за период 2007–2017 гг. – 25,5%. Стандартизованный показатель заболеваемости женского населения России – 229,6 на 100 000 человек. Данный показатель за 10-летний период вырос на 15,4%, что существенно сказывается на показателях рождаемости и смертности [1].
Анализ динамики заболеваемости раком женских половых органов показывает ее неуклонный рост. Наибольший удельный вес в структуре онкологической заболеваемости женского населения имеют злокачественные новообразования органов репродуктивной системы (39,2%), причем заболеваемость раком шейки матки (РШМ) за 2017 г. составила 5,2%, оставаясь в «тройке лидеров» и уступая лишь раку молочной железы (РМЖ) (21,1%) и раку тела матки (7,8%).
Подавляющее большинство всех цервикальных интраэпителиальных дисплазий (CIN), являющихся предшественниками cancer in situ, развивается на фоне вирусной персистенции.
В связи с этим внимание к папилломавирусной инфекции (ПВИ) прибрело острый характер, вызывая множество дискуссий. Разработанные вакцины, профилактические мероприятия не дают полной защищенности от вируса папилломы человека (ВПЧ). Это связано, во-первых, с типовым разнообразием ВПЧ, во-вторых, с ранним дебютом половой жизни подростков и тем самым – поздним выявлением вируса, чаще всего уже на стадии CIN [2].
Многочисленные исследования неоспоримо подтверждают наличие тесной связи между манифестацией ВПЧ и изменениями в иммунной системе. Длительной персистенции ВПЧ служит его способность ускользать от иммунного надзора.
Учитывая тот факт, что внедрение ВПЧ происходит на уровне незрелых клеток эпителия и слизистых базального слоя, тем самым наблюдается пролиферация клеток без репликации вируса, так как пролиферирующие клетки не поддерживают полный жизненный цикл вируса. Так формируется латентная фаза инфекции. После репликации в дифференцированных клетках поверхностного слоя эпителиальных клеток, которым свойственно погибнуть, ВПЧ покидает их, оставаясь без воздействия иммунологических факторов [3]. Установлено, что малигнизация инфицированных ВПЧ эпителиальных клеток обусловлена синтезом двух онкобелков – Е6 и Е7, кодируемых геномом ВПЧ. При этом главная роль в индукции опухолевой трансформации отводится онкобелку Е7.
У пациенток, имеющих подтвержденную генитальную форму ПВИ, отмечаются снижение противовирусной и противоопухолевой активности интерферона α-2 за счет нейтрализации белком Е7, подавление провоспалительного цитокина ИЛ-18, принадлежащего к семейству интерлейкина-1 (ИЛ-1ß), инактивация интерферон-регуляторного транскрипционного фактора IRF, снижение содержания в крови лимфоцитов и изменение факторов местной защиты.
Интерлейкин-18 (IL-18), также известный как IFNγ-индуцирующий фактор (IGIF), первично был охарактеризован как потенциальный индуктор синтеза IFN-γ и натуральных киллеров (НК). Пролиферация и активация НК контролируются, помимо этого, и цитокинами EL-2, IL-15 [4, 5]. ИЛ-18 представляет собой негликозилированный полипептид, который влияет на секрецию IFN-γ и быстро активирует клетки моноцитарно/макрофагальной системы, что ведет к активации множества антибактериальных, антиопухолевых и антивирусных ответных реакций. На поверхности НК находятся рецепторы для активации самих клеток с помощью цитокинов, а также для распознавания лигандов на поверхности опухолевых и инфицированных клеток. Активация НК-клеток приводит к секреции ими молекул перфорина/гранзима Б, осуществляющих лизис поврежденных/измененных клеток и выброс ИФН-γ [6, 7].
Выраженность и характер иммунной реактивности напрямую зависят от степени диспластического процесса. Ввиду чего именно эти механизмы обусловливают необходимость иммунокоррекции вирус-индуцированных CIN.
Цель данного исследования – улучшение качества жизни пациенток с CIN I степени (CIN I), ассоциированными с ПВИ, благодаря применению консервативного метода лечения без деструктивного вмешательства.
Материалы и методы
Проведено обследование 86 женщин репродуктивного возраста с патологией шейки матки CIN I и наличием ВПЧ высокого канцерогенного риска (ВКР), обратившихся в амбулаторно-поликлинические учреждения г. Саранска. Отбор пациенток осуществлялся в соответствии с критериями включения и исключения. Критерии включения: наличие репликации вирусов ВПЧ-ВКР в цервикальном канале, установленное методом полимеразной цепной реакции (ПЦР); CIN I, подтвержденная методом жидкостной онкоцитологии; адекватная контрацепция женщин детородного возраста; письменное информированное добровольное согласие. Критерии исключения: беременность, лактация; CIN III и cancer in situ; наличие декомпенсированных заболеваний или острых состояний, способных существенно повлиять на результат исследования; острая и хроническая почечная и печеночная недостаточность; другая противовирусная и иммуномодулирующая терапия; сопутствующие психические заболевания; симптомы любого инфекционного заболевания; участие в любом другом клиническом испытании за последние 3 месяца.
В возрасте 18–25 лет были 29 (33,72%) женщин, 26–35 лет – 36 (41,86%) женщин, 36–45 лет – 17 (19,77%), 45–49 лет – 4 (4,65%) пациентки.
Все пациентки, вошедшие в исследование, методом рандомизации разделены на 2 группы: 1-я группа (n=43) пациенток с CIN I, вызванной вирусами ВПЧ-ВКР, получали, согласно протоколу исследования, монотерапию препаратом «Аллокин-альфа» по схеме 1 мл подкожно через день, всего 6 инъекций; 2-я группа (n=43) пациенток с CIN I, вызванной ВПЧ-ВКР, лечения не получали. В обеих группах осуществляли динамическое наблюдение в течение 3 и 12 месяцев.
Всем женщинам был проведен лабораторный скрининг на наличие ВПЧ-ВКР. Материал для исследования забирали путем соскоба эпителиальных клеток цервикального канала одноразовыми цитощеточками. Выделение ДНК ВПЧ-ВКР проводили методом ПЦР в режиме «реального времени» с помощью набора реагентов «АмплиСенс ВПЧ ВКР скрин-титр-FL», согласно рекомендациям производителя ФБУН «ЦНИИЭ» Роспотребнадзора (Москва). Данные тесты позволяют определить спектр генотипов, а также концентрацию наиболее распространенных типов ВПЧ. Забор материала проводили в соответствии с методическими рекомендациями «Взятие, транспортировка, хранение клинического материала для ПЦР-диагностики», разработанными Центральным научно-исследовательским институтом эпидемиологии МЗ РФ и утвержденными МЗ РФ (Москва, 2009 г.).
Конечный результат нормированной концентрации ДНК ВПЧ на количество клеток человека рассчитывали по формуле:

Результаты концентрации ДНК ВПЧ выражали в Ig (ВПЧ на 100 000 клеток) и оценивали следующим образом: менее 3 Ig – малозначимая, от 3 Ig до 5 Ig – клинически значимая и более 5 Ig – повышенная вирусная нагрузка.
В качестве стандарта диагностики CIN со слизистой цервикального канала и влагалищной части шейки матки использовали метод жидкостной онкоцитологии [8]. По сравнению с традиционным методом приготовления мазка со слизистой шейки матки применение новой технологии жидкостной цитологии позволяет значительно повысить качество цитологического мазка, снизить количество ложноотрицательных результатов [9]. Минусы традиционного метода связаны с недостаточным количеством эпителиально-клеточного материала в мазке, неравномерным распределением материала на стекле, большим содержанием слизи, элементов воспаления и периферической крови, а также трудной интерпретацией результата ввиду неполного и многослойного прокрашивания клеточного материала при простой онкоцитологии [10].
Специальную щеточку Cervex-Brush аккуратно вводили в наружный зев шейки матки на глубину 0,8–2,5 см. Направляя центральную ее часть по оси цервикального канала, поворачивали по часовой стрелке на 360°, достигая тем самым получения материала из зоны стыка многослойного плоского и цилиндрического эпителия. Далее помещали полученный материал в специализированный контейнер NovaPrep, внутри которого находится фильтр с ячейками 300 микрон, обеспечивающий отделение слизи и клеток крови и воспалительных клеток от диагностически значимых клеток. Отделив кисть от щетки, оставляли ее в стабилизирующем растворе NovaCyt, который предотвращает преждевременное высыхание клеток, что позволяет сохранить образец в оптимальных условиях для дальнейшей его транспортировки в лабораторию.
Критерием обнаружения ВПЧ при цитологическом исследовании является наличие в шеечных мазках койлоцитов – клеток многослойного плоского эпителия (МПЭ) промежуточного типа с увеличенными ядрами, неровной складчатой мембраной и гиперхроматозом. При этом цитоплазма сохраняется только в периферических отделах клетки, образуя перинуклеарное гало (околоядерная зона просветления, сформированная за счет дегенеративных изменений и некроза разрушенных цитоплазматических органелл) [11, 12]. Вторым по специфичности признаком ВПЧ считается наличие дискератоцитов – клеток с увеличенным пикнотическим ядром различной формы и величины и интенсивной эозинофильной цитоплазмой, которые располагаются комплексами в поверхностных ороговевающих слоях МПЭ. Приготовленные препараты оценивали согласно классификации Bethesda (TheBethesda System – TBS 2014).
Забор цервикальной слизи производили на 8–10-й день менструального цикла с помощью туберкулинового шприца. Полученный материал помещали в эппендорф, содержащий 1 мл физиологического раствора. Исследуемый материал суспензировали и доставляли в лабораторию в течение 2–3 ч с момента забора.
Уровень цитокинов определялся в цервикальной слизи у женщин методом иммуноферментного анализа с использованием специфических антител. Для этого были использованы тест-системы ЗАО «Вектор-Бест» (г. Новосибирск). Исследование проводили по методикам и инструкциям данных тест-систем. Анализ полученных величин производили по данным стандартной калибровочной кривой, затем определяли их концентрации. Результаты высчитывали в пг/мл.
Количество IFN-γ, IL-18, ФНО-α определяли через 14 дней и 12 месяцев наблюдения. Также исследовали «фоновое» количество цитокинов, присутствующее в цервикальной слизи пациенток на момент вступления их в исследование.
Результаты и обсуждение
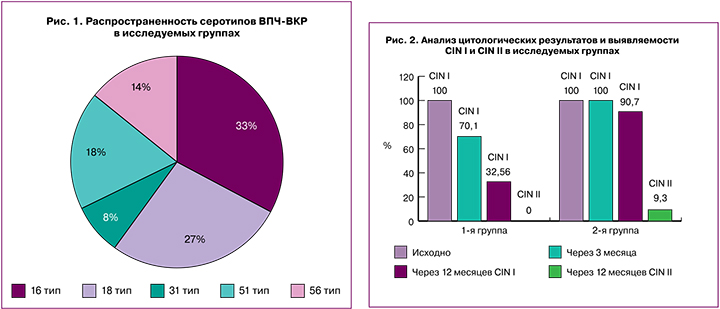
Среди исследуемых женщин амбулаторно-поликлинического приема ДНК ВПЧ-ВКР методом ПЦР выявлена у 100% (n=86). Это являлось критерием отбора данного исследования. Причем, наибольшую распространенность получил 16 тип – 66,3% (n=57). Распределение других серотипов выглядело следующим образом: 18 тип – 54,7% (n=47), 31 тип – 16,3% (n=14), 51 и 56 серотипы – 36% (n=31) и 27,9% (n=24) соответственно (рис. 1). Одновременное инфицирование 16 и 18 типами встретилось у 24,4% (n=21) женщин. Все женщины, по данным цитологического анализа, имели CINI шейки матки. У пациенток имелась исходно клинически значимая концентрация исследуемых типов ВПЧ (16, 18, 31, 51, 53, 56) (в среднем от 4,1±0,1 до 6,2±0,2 lg ВПЧ на 100 000 клеток).
Пациентки были разделены на 2 группы: 1-я группа (n=43) получала терапию препаратом «Аллокин-альфа» по схеме согласно протоколу.
«Аллокин-альфа» – антивирусный и иммуномодулирующий препарат нового поколения, действующее вещество – аллоферон. Противовирусные и иммуномодулирующие свойства препарата «Аллокин-альфа» обусловлены индукцией выработки интерферона в плазме крови и тканях с длительно поддерживающейся концентрацией в крови [13] и активацией Т-лимфоцитов [14]; активацией рецепторов иммунокомпетентных клеток главного комплекса гистосовместимости-II [15]. Каждая пациентка получила всего 6 инъекций препарата (1 мг сухого лиофилизата разводили в 1 мл физиологического раствора) подкожно через день. Контроль осуществлялся через 3 и 12 месяцев, динамическое наблюдение – в течение 3 и 12 месяцев.
Динамическое наблюдение в течение 3 и 12 месяцев проходила и 2-я группа (n=43). Согласно клиническим рекомендациями МЗ РФ от 02.11.2017 г. «Доброкачественные и предраковые заболевания шейки матки с позиции профилактики рака», у пациенток с СIN I выжидательная тактика возможна до 18–24 месяцев, с обязательным цитологическим контролем мазка из шейки матки и цервикального канала.
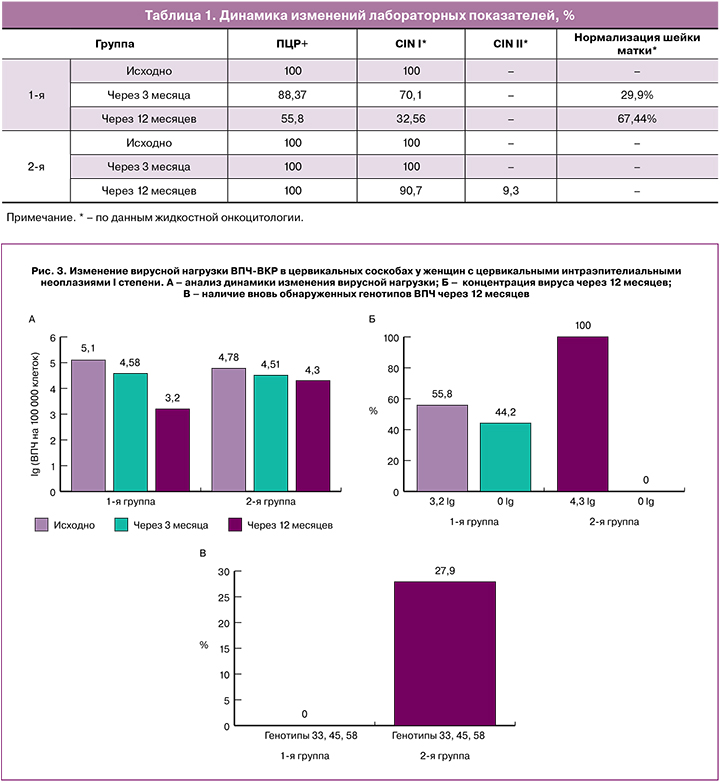
Анализ результатов исследования показал ВПЧ-отрицательную реакцию у пациенток с CIN I, получавших противовирусную и иммуномодулирующую терапию, через 12 месяцев в 44,2% случаев. Стоит отметить, что частота встречаемости ВПЧ после проведенного консервативного лечения достоверно не различалась в разных возрастных группах. Цитологический скрининг спустя 12 месяцев показал, что лишь у 14 (32,56%) женщин данной группы сохранялась слабая дисплазия шейки матки. У остальных 29 (67,44%) пациенток, по данным цитологического обследования, признаков CIN выявлено не было.
Можно предположить, что причиной тому стало восстановление нормальных клеточных и тканевых процессов в шейке матки после элиминации вирус-этиотропного агента.
Наблюдение за пациентками 2-й группы исследуемых дало иной результат. В 9,3% случаев выявилось изменение, соответствующее CIN II. У остальных женщин сохранялся CIN I в мазках, приготовленных методом жидкостной онкоцитологии и взятых через 3 и 12 месяцев соответственно (табл. 1, рис. 2). К тому же были обнаружены другие серотипы ВПЧ-ВКР. Так, типы 33, 45, 58 дополнительно обнаружены у 12 (27,9%) женщин, а частота встречаемости 16 типа увеличилась с 62,7 до 76,7%. Возможно, это связано с новым инфицированием, а также с нарушением функционирования местного и системного иммунитета.
Концентрация ВПЧ-ВКР (рис. 3) значительно менялась в 1-й группе (с 5,1±0,65 до 3,2±0,92 lg, ВПЧ на 100 000 клеток), тогда как в группе пациенток с выжидательной тактикой наблюдалось незначительное снижение (с 4,78±0,55 до 4,3±0,75 lg, ВПЧ на 100 000 клеток) (p<0,05).
Максимальный уровень IL-18 был достигнут в группе, где использовали препарат «Аллокин-альфа» спустя 14 дней после лечения. В группе женщин с динамическим наблюдением IL-18 не имел тенденцию к значимому изменению и оставался в равных значениях с его фоновым показателем.
Так как известно, что ВПЧ подавляет выработку IL-18, то это коррелирует с данными о значимом снижении концентрации ВПЧ в группе с препаратом «Аллокин-альфа» и сохранении высокой концентрации вируса в группе контроля (табл. 2).

 Оценивая содержание IFN-γ в цервикальной слизи у женщин с патологией шейки матки, ассоциированной с ПВИ, учитывали способность IL-18 индуцировать его продукцию. Проводя параллельную взаимосвязь по принципу прямого воздействия, в действительности, его концентрация была достоверно выше в 1-й группе, чем в группе сравнения женщин, не получавших противовирусную терапию (рис. 4).
Оценивая содержание IFN-γ в цервикальной слизи у женщин с патологией шейки матки, ассоциированной с ПВИ, учитывали способность IL-18 индуцировать его продукцию. Проводя параллельную взаимосвязь по принципу прямого воздействия, в действительности, его концентрация была достоверно выше в 1-й группе, чем в группе сравнения женщин, не получавших противовирусную терапию (рис. 4).
Однако спустя 12 месяцев наблюдения концентрация IFN-γ снижается ниже фоновых показателей (с 72,39±0,89 до 42,6±1,3 пг/мл), что, вероятно, связано с подавлением репликации ВПЧ и устранением местного воспалительного процесса в шеечном эпителии.
Полученные результаты цитокинового исследования у женщин во 2-й группе свидетельствуют о нарушении работы клеточных механизмов, что является отражением персистирующего течения ПВИ.
Уровень ФНО-α в цервикальном секрете исходно составил 3,81±0,59 пг/мл и 2,08±0,3 пг/мл в исследуемых группах соответственно. Следует отметить, что его показатели не стремились к увеличению или снижению, а оставались примерно в тех же исходных параметрах [12].
Заключение
В ходе проведенного исследования были установлены закономерности распространенности ВПЧ-ВКР у женщин с CIN I, а также ее зависимости от работы иммунной системы. Так, отчетливо прослеживалась тенденция к снижению выявляемости ВПЧ-ВКР у женщин, получавших иммунопротивовирусную терапию препаратом «Аллокин-альфа», по сравнению с женщинами, проходившими динамическое наблюдение.
Цитокиновый дисбаланс, проявляющийся пониженным содержанием провоспалительных цитокинов в очаге поражения, повышает вероятность персистенции вируса в организме, что, скорее всего, способствует развитию неопластических процессов и более запущенных форм интраэпителиальных поражений. Результаты проведенного лечения в группе, где использовалась терапия препаратом «Аллокин-альфа», обусловлены восстановлением этого баланса.
Установленные в результате проведенных исследований данные позволяют оптимизировать тактику ведения пациенток с ВПЧ-индуцированными CIN I и предупредить его дальнейшее прогрессирование без применения деструктивного вмешательства.



