Миома матки является крайне распространенной доброкачественной опухолью у женщин. По данным разных авторов, она диагностируется у 30–35% всех женщин репродуктивного возраста, а при более углубленной диагностике частота может возрастать до 70% [1–3]. Поэтому при выборе тактики ведения таких пациенток необходимо учитывать потенциальное влияние того или иного метода лечения на репродуктивную функцию пациентки, в особенности показатели овариального резерва, что, с одной стороны, может привести к формированию бесплодия, а с другой – обусловить более раннее наступление менопаузы [4].
Показатели овариального резерва отражают количество и качество ооцитов и в целом – репродуктивную способность. Непосредственная оценка овариального резерва крайне затруднена, поэтому он оценивается посредством измерения биохимических маркеров и при проведении ультразвукового исследования (УЗИ). Наиболее часто применяется анализ фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ), эстрадиола (Е2) и антимюллерова гормона (АМГ); при УЗИ оцениваются объем яичников, количество антральных фолликулов и кровоснабжение яичников [5].
Процедура эмболизации маточных артерий (ЭМА) может приводить к снижению кровоснабжения яичника и матки, что в некоторых случаях будет обусловливать снижение овариального резерва [6]. С другой стороны, проведение лапараскопической миомэктомии также может оказывать влияние на кровоснабжение яичников, при проведении операции ткань яичника также может быть повреждена [7]. При проведении гисторезектоскопической (ГРС) миомэктомии влияние на кровоток в маточной и яичниковой артериях незначительно, соответственно, мы можем ожидать минимального влияния ГРС на показатели овариального резерва [8].
Целью нашего исследования было оценить показатели овариального резерва после проведения различных хирургических методов лечения миомы матки.
Материалы и методы
Обследованы 92 пациентки с диагностированной миомой матки, которые были разделены на 3 группы: 1-ю группу составили 27 пациенток, которым была произведена ГРС-миомэктомия, во 2-ю группу вошли 42 пациентки, которым была проведена лапароскопическая миомэктомия, в 3-ю группу вошли 23 пациентки, которым была проведена ЭМА. Контрольную группу составили 20 здоровых небеременных пациенток.
До оперативного вмешательства, а также через 1, 4 и 6 месяцев после проведения операции были изучены уровни гонадотропных гормонов, Е2, АМГ, проведено УЗИ матки и яичников с допплерометрией у пациенток с миомой матки и в контрольной группе. Определялись максимальные скорости (МС) кровотока в маточных и яичниковых артериях, пульсационный индекс (ПИ), индекс резистентности (ИР) и систоло-диастолическое соотношение (СДО).
Результаты
Продукция изучаемых гормонов достоверно не отличалась от показателей в контрольной группе. Выявленные изменения кровотока были характерны для миомы матки: при субсерозной и субсерозно-интерстициальной локализации узлов имеет место гиперэхогенная, т.е. фиброзная структура при невыраженной васкуляризации. Было выявлено снижение показателя МС на фоне повышения уровня ИР при интерстициальной и интерстициально-субсерозной локализации узлов и, следовательно, снижение кровотока в яичниковой ветви маточной артерии.
Ближайшие результаты влияния ГРС-миомэктомии на овариальный резерв
В группе 27 обследуемых было отмечено, что проведение ГРС-миомэктомии приводит к достоверному снижению продукции АМГ на 28% и Е2 – на 21%, компенсаторному повышению уровней ЛГ на 24% и ФСГ – на 19% в течение первого месяца после операции. Затем в динамике происходит постепенное восстановление маркеров овариального резерва к 4–6 месяцу после операции (рис. 1).

При УЗИ с допплерометрией отмечалось достоверное снижение кровотока в маточных и яичниковых артериях: снижение МС, увеличение ПИ, индекса ИР и СДО. После ГРС-миомэктомии наблюдается достоверное снижение кровотока в органах малого таза пациенток, которое выражается в снижении МС в маточных, яичниковых артериях, артериях стромы яичников. Эти изменения являются результатом травматического воздействия на миометрий во время операции. Кроме того, изменение кровотока в яичниковой артерии является рефлекторным, параллельным снижению кровотока в яичниковых ветвях маточных артерий, который происходит так же, как и в маточных артериях в результате операционной травмы. Вероятнее всего, результатом изменения кровотока в сосудах яичников является нарушение их функции, которое выражается в снижении продукции стероидных гормонов и АМГ и, по механизму обратной связи, повышении продукции гонадотропных гормонов. Обнаруженные изменения кровотока являются обратимыми, восстановление кровотока в маточных и яичниковых артериях было отмечено к 4 месяцу послеоперационного периода.
Ближайшие результаты влияния миомэктомии лапараскопическим доступом на овариальный резерв
После операции миомэктомии, произведенной лапароскопическим доступом 42 женщинам, было отмечено снижение уровней Е2 на 38% и АМГ на 34,2% в течение 1 месяца. В ответ на снижение стероидных гормонов по принципу обратной связи происходит повышение уровня гонадотропных гормонов: продукция ЛГ увеличилась на 36,7%, продукция ФСГ – на 38,6%. Почти все показатели продукции гонадотропных и стероидных гормонов нормализовались к 6 месяцу послеоперационного периода (рис. 2).
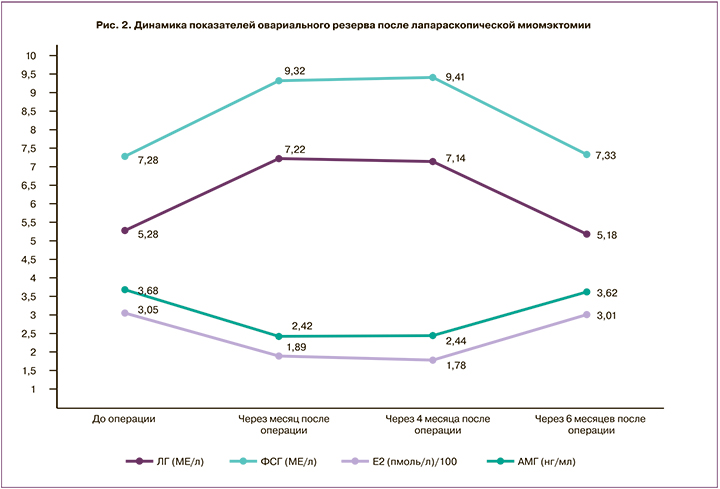
В послеоперационном периоде наблюдались изменения кровообращения матки: снижение МС маточных артерий: в левой – на 21,9% и в правой – на 23,9%. При этом ПИ увеличивается соответственно на 15,8% и на 20,6%, ИР – на 13,1% и на 12,0%, а СДО – на 48,7% и на 50,2%. Также после операции были обнаружены изменения кровотока в яичниковой артерии и в сосудах стромы яичников: снижение МС кровотока в яичниковой артерии на 18,8%, в артериях стромы яичников – на 21,7%; увеличение показателей ПИ на 24,8% в яичниковой артерии и на 21,9% – в артериях стромы яичников; увеличение ИР соответственно на 20,8% и на 23,2% и СДО – на 38,1% и на 36,2% соответственно.
Выявленные изменения гемодинамики матки и яичников являются результатом операционной травмы, наличия послеоперационного шва на матке. Изменения кровотока в яичниковой артерии, которая в ходе операции не затрагивается при любом размере и локализации узла, являются рефлекторной реакцией на изменения в яичниковой ветви маточной артерии, гемодинамика в которой может быть затронута в ходе миомэктомии.
Обнаруженные изменения кровообращения матки и яичника являются обратимыми. В группе обследования обнаруженные изменения кровообращения матки, яичников и функции яичников восстанавливались без гормональной терапии к 6 месяцу послеоперационного периода.
Ближайшие результаты влияния ЭМА на овариальный резерв
В этой группе обследования, состоящей из 23 пациенток, были отмечены следующие изменения в послеоперационном периоде: в течение первого месяца после ЭМА наблюдалось выраженное снижение продукции стероидных гормонов: продукция Е2 снизилась в среднем на 60,5%, АМГ – на 65,8%. При этом продукция гонадотропных гормонов увеличивается: ФСГ – на 58,4%, ЛГ – на 55,5% при неизменном показателе соотношения ЛГ/ФСГ. К 6 месяцу послеоперационного периода происходит достоверное увеличение продукции стероидных гормонов в динамике, но до нормальных, дооперационных, показателей восстановление происходит лишь через 10 месяцев после операции (рис. 3).
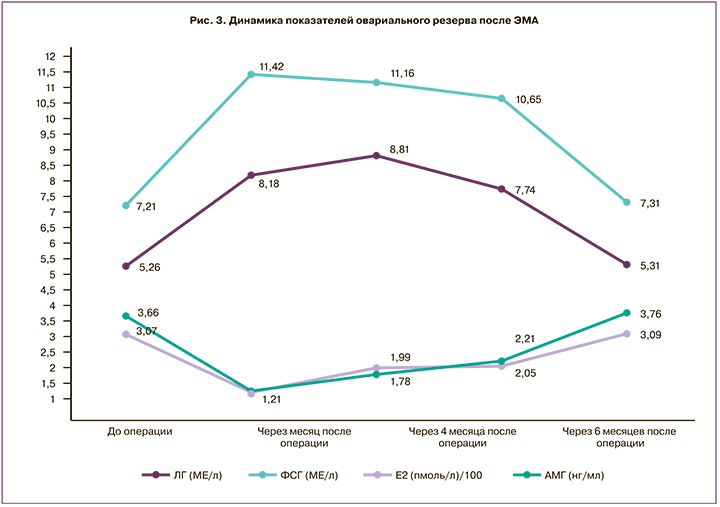
При УЗИ с допплерометрией было выявлено, что кровоток в маточных артериях в течение 1 месяца после ЭМА значительно снижается, о чем свидетельствует снижение МС в обеих маточных артериях на фоне повышения ИР, ПИ и СДО. В то же время МС в левой маточной артерии снижается на 18,0%, в правой маточной артерии – на 22,2%. При этом не было найдено каких-либо изменений в кровотоке яичниковой артерии в динамике послеоперационного периода после ЭМА. Но при этом внутрияичниковый кровоток снижался; об этом свидетельствует снижение показателя МС и увеличение показателей ПИ и ИР. Это объясняется тем, что кровоток в яичниках снижается за счет уменьшения кровоснабжения яичника из яичниковой ветви маточной артерии. Следствием снижения кровоснабжения яичников являются изменения функциональной активности яичников, максимально выраженные в течение 1 месяца послеоперационного периода. Кровоснабжение матки остается сниженным до 10 месяца послеоперационного периода. При этом показатель МС кровотока несколько увеличивается, но эти изменения не являются достоверными и не достигают дооперационного уровня.
Обсуждение
Проблема выбора метода лечения при миоме матки продолжает оставаться актуальной; особенно это относится к пациенткам репродуктивного возраста, которые планируют реализовать свою репродуктивную функцию. При выборе метода операции у обследуемых пациенток мы исходили, помимо клинической картины, из размера опухоли, ее локализации.
При наличии субмукозной миомы матки с соответствующими клиническими проявлениями, требующей оперативного лечения, оптимальным вариантом является операция гистерорезектоскопии. Однако при этом размеры опухоли не должны превышать 5 см в диаметре, так как при резекции опухоли большего размера увеличивается риск развития интраоперационных осложнений, в связи с чем целесообразность данной операции ставится под сомнение [9].
Выявленные нами изменения функционального состояния яичников после операции ГРС являются следствием оперативного вмешательства на матке, травматизации эндометрия и миометрия. В результате снижается скорость кровотока вследствие рефлекторного повышения резистентности сосудов матки и яичниковой артерии. Также отмечены незначительные изменения кровотока в яичниковых ветвях маточных артерий, что приводило к изменениям внутрияичникового кровотока и нарушению функции яичников, которые выразились в снижении продукции Е2 и АМГ. В ответ на это наблюдается активизация выработки гонадотропных гормонов гипофиза. Вследствие достаточно щадящего оперативного вмешательства (диаметр узла до 5 см) показатели приходят к нормальным величинам уже к 4 месяцу послеоперационного периода без какого-либо медикаментозного лечения. С точки зрения сохранения функционального состояния яичников и, следовательно, репродуктивного потенциала пациенток операцию ГРС в применяемом нами объеме можно считать максимально щадящим вариантом хирургического лечения миомы матки. Но в случае, когда речь идет об относительно большом объеме миоматозного узла (диаметром более 5–6 см), субмукозно-интрамуральном расположении его, т.е. в тех случаях, когда ГРС невозможно провести или ее проведение сопряжено с большим риском, одним из вариантов органосохраняющей операции является ЭМА.
При наличии субсерозной или субсерозно-интерстициальной миомы показана операция миомэктомии лапароскопическим доступом [10]. Было выявлено снижение синтеза гормонов после операции: снижение Е2 на 38,0%, АМГ также уменьшился на 34,2%. Одновременно наблюдалось повышение уровней гонадотропных гормонов: ЛГ – на 36,7%, ФСГ – на 38,6%. Все вышеперечисленные показатели приходят в норму к 6 месяцу послеоперационного периода. При изучении допплерометрических показателей после операции миомэктомии нами отмечено снижение МС кровотока в бассейнах левой и правой маточных артерий, а также яичниковой артерии и внутрияичникового кровотока на фоне повышения ИР, ПИ и СДО в соответствующих сосудах. Эти изменения кровотока также наблюдались до 6 месяца послеоперационного периода. Повышение резистентности сосудов и снижение скорости кровотока являются следствием операционной травмы, удаления миоматозных узлов, а именно части органа, наличия послеоперационного шва на матке [11]. Кровоток меняется не только в маточных артериях, но и в артериях стромы яичников в результате снижения кровотока в яичниковых ветвях маточных артерий. Изменения кровотока в яичниковых артериях следует, по-видимому, рассматривать как рефлекторные в ответ на снижение кровотока в яичниковых ветвях маточных сосудов с учетом наличия анастомозов между ветвями маточных артерий и яичниковой артерии.
Методика ЭМА основана на кратковременном уменьшении кровоснабжения всего миометрия и долговременном воздействии на все миоматозные узлы, независимо от их локализации путем окклюзии ветвей маточной артерии [12–14]. Вместе с этим основной задачей является полная окклюзия сосудистого русла матки и миоматозных узлов путем введением эмболизата в маточную артерию. Лечебный эффект обусловлен снижением перфузии миометрия в целом и ткани узлов миомы с последующим развитием в них ишемии, ослаблением воздействия на миометрий половых стероидных гормонов и факторов роста, снижением пролиферативной активности [15–17]. Среди противопоказаний к проведению ЭМА отмечаются субмукозные узлы и субсерозные на тонком основании, в связи с тем, что в первом случае более целесообразным методом является ГРС-миомэктомия, а во втором – не исключен некроз узла [18]. В ряде работ показано, что в течение первого года после вмешательства могут развиваться гипергонадотропная аменорея, гипоэстрогения, что приводит к резкому снижению овариального резерва и соответствует клинической картине преждевременного истощения функции яичников [19].
Выявленные нами изменения показателей Е2 и гонадотропных гормонов показывают выраженные гормональные сдвиги, происходящие в организме пациенток под влиянием ЭМА. При этом у некоторых пациенток нормализация показателей овариального резерва происходила только к 10 месяцу послеоперационного периода. Уровень и длительность гормональных изменений у пациенток с миомой матки после ЭМА зависели от размера миоматозного узла: чем больше размеры узлов, тем более выражены эти изменения и тем дольше они держатся в послеоперационном периоде, что в целом совпадает с данными литературы [20]. Мы выявили значительные изменения кровотока в бассейне обеих маточных артерий, о чем свидетельствует снижение показателя МС на фоне увеличения ИР, ПИ, СДО. Следует отметить, что изменения внутрияичникового кровотока у пациенток этой группы регистрировались более длительно, вплоть до 10 месяца послеоперационного периода; т.е. влияние ЭМА на яичниковый кровоток у пациенток с размерами узла, замещающими около 70% тела матки, являются более выраженными.
Также следует отметить, что указанные показатели после ГРС и ЭМА в абсолютных цифрах достоверно не отличаются, однако изменения, происходящие после ЭМА, регистрируются более продолжительное время.
Изменения функционального состояния яичников, вызванные операцией ЭМА, носят более глубокий и длительный характер по сравнению с изменениями после операции ГРС. Таким образом, для функционального состояния яичников операция ЭМА является менее щадящим вмешательством, чем ГРС. Наши данные в основном совпадают с данными литературы о том, что ЭМА оказывает негативное влияние на овариальный резерв яичников и, следовательно, приводит к снижению фертильности женщин по крайней мере в течение 1 года после операции [21, 22].
Заключение
Проведенное нами изучение влияния на функциональное состояние яичников операций ГРС-миомэктомии, миомэктомии лапароскопическим доступом и ЭМА показало, что наибольшее воздействие на функциональное состояние яичников оказывает ЭМА, после которой изменения гормонального статуса и кровотока матки и яичников остаются в течение 10 месяцев, по сравнению с 6 месяцами после ГРС- и лапароскопической миомэктомии.



