В условиях падения рождаемости и высокого уровня общей смертности проблемы охраны репродуктивного здоровья населения приобретают особую социальную значимость [1]. Нарушения состояния репродуктивной системы считаются одним из интегральных показателей санитарно-эпидемиологического неблагополучия территории и отражают степень агрессивности окружающей среды [2–4]. Репродуктивная система женщины является весьма чувствительной к техногенному загрязнению окружающей среды [5–7].
Технологический прогресс, интенсивное развитие промышленности, использование автомобильного, железнодорожного транспорта, широкое применение полимерных и синтетических материалов в строительстве и в быту привели к загрязнению окружающей и жилой среды человека. С гигиенической точки зрения весьма важным недостатком материалов на основе полимеров является их свойство к выделению в процессе эксплуатации в воздушную среду низкомолекулярных химических веществ. Наиболее распространенными компонентами полимерных материалов являются фенол, стирол и формальдегид. Основным загрязнителем воздуха жилых помещений считается формальдегид, часто превышающий предельно допустимые концентрации во много раз [8].
Во многих исследованиях было доказано, что восприимчивость организма к вредным воздействиям окружающей среды зависит от активности ферментов систем биотрансформации ксенобиотиков, антиоксидантной защиты и фолатного обмена. К так называемым генам детоксикации относят гены семейства глутатион-S-трансферазы (GST: GSTT1, GSTM1, GSTP1) и глутатион пероксидазы (GPX1), супероксид десмутазы (SOD2, SOD3), различные трансферазы (например, N-ацетилтрансфераза 2 – NAT2 и сульфотрансфераза 1А1 – SULT1A1) и гидролазы (например, эпоксид гидролаза1 – EPHX1), цитохромы (например, цитохром Р450 – CYP1A1). Ключевыми генами фолатного цикла являются метилентетрагидрофолат редуктаза – MTHFR, метионин синтетаза – MTR и метионин синтетаза редуктаза – MTRR. Продукты этих генов участвуют в удалении из организма промышленных канцерогенов, ксенобиотиков и инактивации электрофильных органических веществ [9–11]. Перечисленные гены характеризуются значительным популяционным полиморфизмом, приводящим к изменению их активности.
В последние годы большое количество исследований посвящено изучению влияния комплекса факторов окружающей среды на здоровье населения, но остаются недостаточно изученными аспекты комплексного влияния антропогенных химических веществ (АХВ) на развитие плода. Не изучена роль генов детоксикации в накоплении и выведении АХВ из организма беременных женщин и их влияния на развитие осложнений гестационного процесса.
 В связи с этим мы провели исследование, целью которого стало выявление связи между пренатальной экспозицией бенз(а)пирена, стирола, формальдегида, генотипом матери и массой тела детей при рождении.
В связи с этим мы провели исследование, целью которого стало выявление связи между пренатальной экспозицией бенз(а)пирена, стирола, формальдегида, генотипом матери и массой тела детей при рождении.
Материал и методы исследования
В популяционное одномоментное исследование были рекрутированы 166 родильниц, отобранные случайным образом из популяции беременных женщин, поступивших для родоразрешения в родильные дома г. Читы, родившие на сроке более 35 недель гестации. Критериями включения были возраст от 20 до 40 лет и проживание в г. Чите не менее 5 лет. Женщины с пороками развития плода, многоплодием, не включались в исследование. Все пациентки подписали информированное согласие на участие в исследовании.
Обследование пациенток включало анкетирование, забор венозной крови в момент родов и в первые сутки после родов. Обследование новорожденных заключалось в измерении роста и массы тела при рождении и забора пуповинной крови в момент родов. Анкетирование пациенток содержало данные о факторах риска, влияющих на массу тела новорожденных. В качестве возможных факторов риска малой массы тела новорожденных рассматривались возраст, уровень образования, курение и прием алкоголя во время беременности, гинекологические и соматические заболевания, осложнения и заболевания во время настоящей беременности. Информация о весе и росте пациенток в 1-м триместре беременности извлекалась из обменных карт родильниц.
Содержание бенз(а)пирена и формальдегида в сыворотке крови родильниц и пуповинной крови новорожденных детей определяли с использованием метода высокоэффективной жидкостной хроматографии (ВЭЖХ) на высокоэффективном жидкостном хроматографе LC-20 Prominence (Shimadzu, Япония) [12]. Определение содержания стирола в сыворотке крови родильниц и пуповинной крови новорожденных детей проводили методом газовой хроматографии с предварительной экстракцией пентаном с помощью газового хроматографа Кристалл-2000м с пламенно-ионизационным детектором (Хроматек, Россия) [13].
Определение генотипов глутатион S-транферазы M1 (GSTM1), глутатион S-транферазы T1 (GSTT1), глутатион-S-трансферазы P1 (GSTP1), супероксид дисмутазы 2 (SOD2), супероксид дисмутазы 3 (SOD3), N-ацетил трансферазы 2 (NAT2), глутатион пероксидазы 1 (GPX1), эпоксид гидролазы 1 (EPHX1), цитохрома Р450 (CYP1A1), сульфотрансферазы 1А1 (SULT1A1), метионин синтетазы (MTR) и метилентетрагидрофолат редуктазы (MTHFR) проводилось методом полимеразной цепной реакции в реальном времени с анализом кривых плавления с помощью коммерческих тест-систем (ООО «НПО ДНК-Технология», Россия).
Для статистического анализа использовались пакеты статистических программ SAS v.9 (США) и Statistica 10 (США). Первичной конечной точкой явилась коэффициенты регрессии сочетанного влияния АХВ и генотипа системы детоксикации матери на массу тела новорожденных. Вторичными конечными точками были: медианы и перцентили распределения бенз(а)пирена, стирола и формальдегида в крови женщин и их новорожденных детей; отношения между концентрацией бенз(а)пирена, стирола и формальдегида, массой тела новорожденных, генотипом матери и факторами риска, которые были определены с помощью рангового теста Крускала–Уоллиса для сравнения переменных в нескольких группах и теста Манна–Уитни для сравнения переменных в 2 группах. Корреляционный анализ проводился с использованием непараметрического корреляционного критерия Пирсона.
Для оценки влияния уровня бенз(а)пирена, стирола и формальдегида в материнской и пуповинной крови на массу тела новорожденных в зависимости от генотипов генов антиоксидантной системы был применен многофакторный регрессионный анализ. Для оценки совместного влияния генотипа матери и концентрации АХВ на массу тела новорожденных были созданы сочетанные показатели АХВ и генотипов.
Различия между статистическими величинами считали статистически значимыми при уровне достоверности p<0,05. Исследование было одобрено комиссией по этике ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России.
Результаты исследования
В исследование были включены 166 женщин, средний возраст которых составил 26,1±5,6 года. Средняя масса тела новорожденных была 2630,6±518,3 г при среднем гестационном возрасте 38,9±1,7 недели. 83,1% детей родились в срок (после 376 недель). Масса тела детей при рождении увеличивалась при увеличении индекса массы тела (ИМТ) матерей в конце беременности и снижалась при курении и приеме алкоголя во время беременности [2].
У новорожденных уровень АХВ коррелировал с материнским и был ниже, чем у матерей в 2–6 раз. Для бенз(а)пирена r=0,97 (p<0,001), для стирола r=0,66 (p<0,001), для формальдегида r=0,18 (p=0,0180). Также выявлялась значимая обратная корреляционная зависимость между массой тела детей и содержанием бенз(а)пирена, стирола и формальдегида в крови матери, бенз(а)пирена и стирола в крови новорожденного. Между содержанием формальдегида в пуповинной крови и массой тела новорожденных наблюдалась положительная корреляционная зависимость (табл. 1).
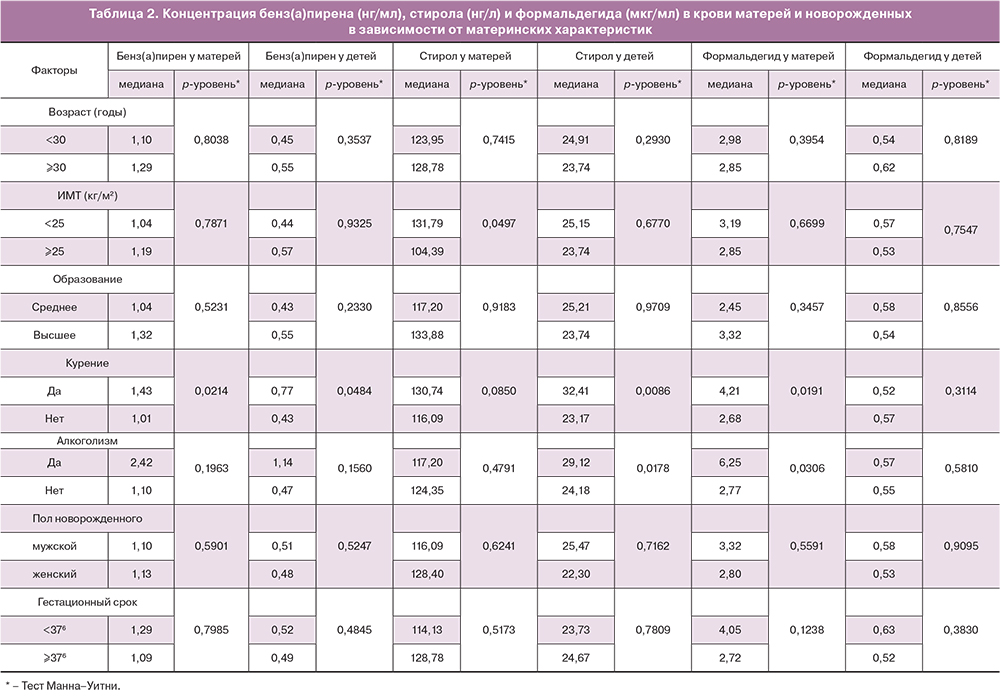
В табл. 2 представлены данные о содержании бенз(а)пирена, стирола и формальдегида в крови матери и пуповинной крови в зависимости от материнских факторов риска. Концентрация исследуемых поллютантов была значимо выше у курящих и потребляющих алкоголь матерей. Другие показатели, такие как возраст матерей, ИМТ, уровень образования, пол новорожденных и гестационный срок при рождении не оказывали влияние на концентрацию поллютантов в крови женщин и пуповинной крови.
Нами была проведена оценка зависимости концентрации изучаемых АХВ от генотипа систем биотрансформации ксенобиотиков, антиоксидантной защиты и фолатного обмена (табл. 3). Было выявлено, что уровень бенз(а)пирена в крови женщин и в пуповинной крови был статистически значимо ниже у женщин с генотипом АА гена GSTP1 c.313 A>G (rs 1695), генотипом ТТ гена EPHX1 c.337 T>C (rs1051740), генотипом СС гена GPX1 c.599C>T (rs1050450), генотипом ТТ гена NAT2 c.341 T>C (rs1801280), генотипом GG гена NAT2 c.857 G>A (rs1799931), генотипом GG гена SULT1A1 c.404G>A (rs9282861), генотипом ТT гена CYP1A1 c.1189T>C (rs4646903), генотипом СC гена MTHFR c.677 C>T (rs1801133) и генотипом AA гена MTR c.2756A>G (rs1805087). Накопление бенз(а)пирена в крови женщин и в пуповинной крови было статистически значимо ассоциировано с генотипом ТТ гена GPX1 c.599C>T (rs1050450).
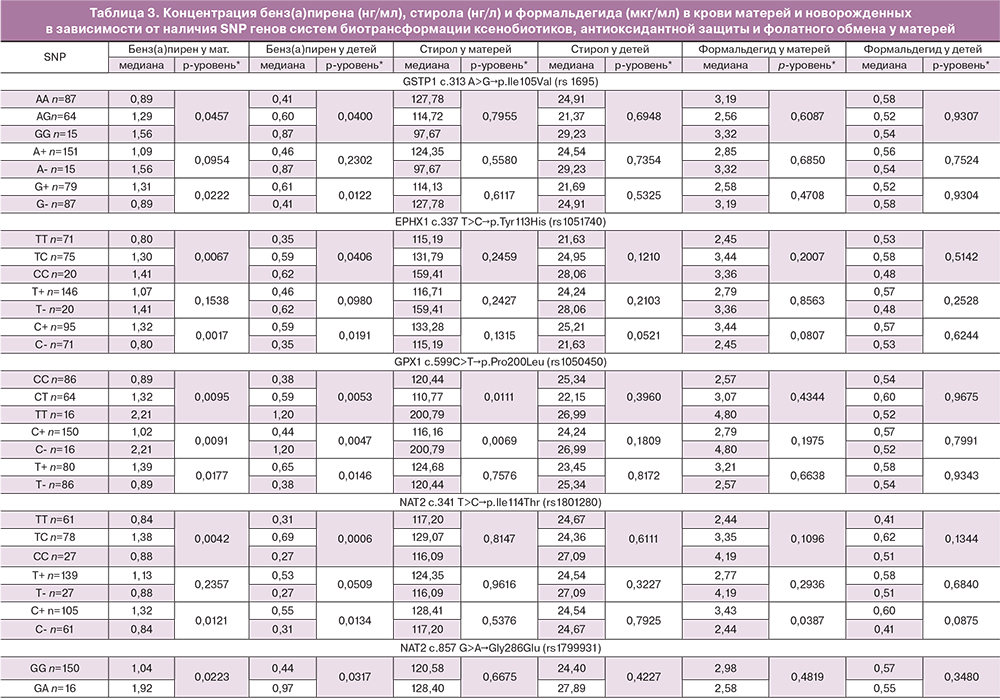
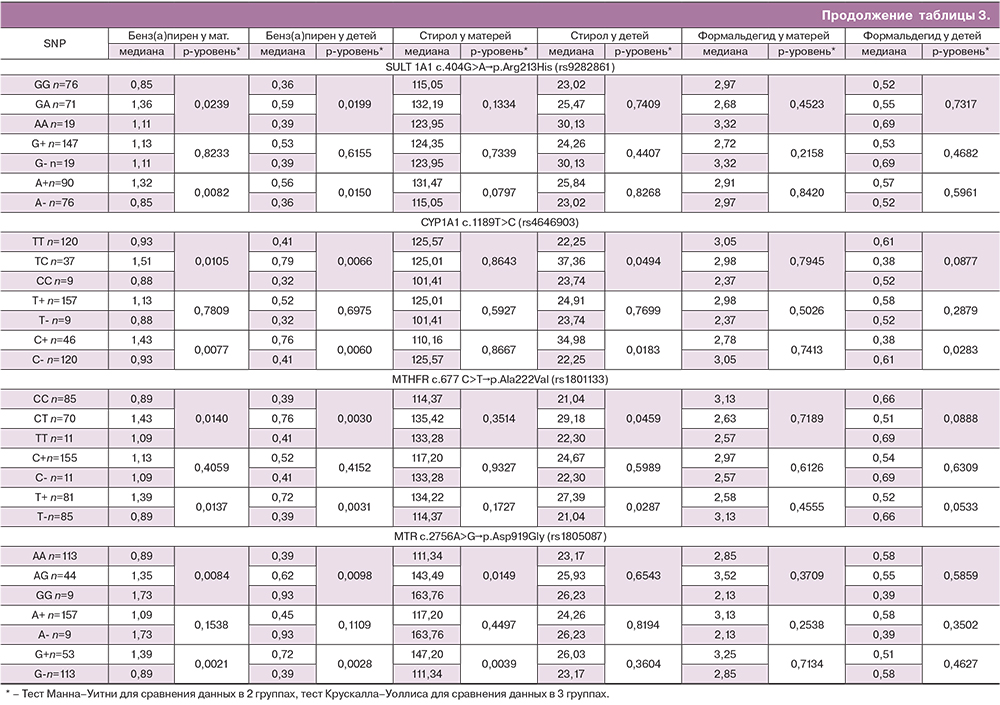
Судя по медианам концентраций бенз(а)пирена, можно предположить, что согласно аутосомно-рецессивному типу наследования наличие аллеля А гена GSTP1 c.313 A>G, аллеля Т гена EPHX1 c.337 T>C, аллеля С гена GPX1 c.599C>T, аллеля Т гена NAT2 c.341 T>C, аллеля G гена SULT1A1 c.404G>A, аллеля Т гена CYP1A1 c.1189T>C, аллеля С гена MTHFR c.677 C>T и аллеля А гена MTR c.2756A>G играет протективную роль, а наличие аллеля Т гена GPX1 c.599C>T – негативную роль в плане накопления бенз(а)пирена в организме как женщины, так и плода.
Повышенный уровень стирола в пуповинной крови был связан с наличием генотипа ТС гена CYP1A1 c.1189T>C (rs4646903) и наличием генотипа СТ гена MTHFR c.677 C>T (rs1801133). Повышенный уровень стирола в материнской крови был ассоциирован с наличием генотипа ТТ гена GPX1 c.599C>T (rs1050450) и генотипов GG/AG гена MTR c.2756A>G (rs1805087). Таким образом, можно предположить, что согласно аутосомно-рецессивному типу наследования наличие аллеля Т гена GPX1 c.599C>T ассоциировано с накоплением стирола в организме матери, а наличие аллеля A гена MTR c.2756A>G играет протективную роль (табл. 3).
Уровень формальдегида в пуповинной крови был значимо повышен при наличии генотипа TT гена CYP1A1 c.1189 T>C (rs4646903). В крови матери уровень формальдегида был повышен при наличии генотипов СС/ТС гена NAT2 c.341 T>C (rs1801280). Таким образом, можно предположить, что согласно аутосомно-доминантному типу наследования наличие аллеля С гена NAT2 c.341 T>C играет негативную роль для накопления формальдегида в организма матери и плода (табл. 3).
Таким образом, наибольшее защитное значение имели широко распространенные аллели гена NAT2 c.341 T>C (аллель Т), CYP1A1 c.1189T>C (аллель Т), гена MTHFR c.677 C>T (аллель С) и гена MTR c.2756A>G (аллель А), предотвращающие накопление 2-х АХВ. Наибольшее негативное влияние имел редкий аллель T гена GPX1 c.599C>T
На следующем этапе мы проанализировали совместное влияние различных генотипов генов системы детоксикации и концентрации АХВ на массу тела новорожденных. Для этого нами были созданы сочетанные показатели изучаемых АХВ и показавших значимость генов (табл. 4). Было выявлено, что масса тела новорожденных была выше при более низком содержании в крови матери и пуповинной крови бенз(а)пирена при условии наличия аллеля А гена GSTP1 c.313 A>G, аллеля G гена SULT1A1 c.404G>A, аллеля Т гена CYP1A1 c.1189T>C и аллеля А гена MTR c.2756A>G. Также масса тела зависела от содержания стирола, и была значимо ниже при наличии аллеля С гена CYP1A1 c.1189T>C, аллеля Т гена MTHFR c.677 C>T и аллеля G гена MTR c.2756A>G. В случае более высокого содержания формальдегида масса тела новорожденных детей была значимо ниже при наличии аллеля С гена NAT2 c.341 T>C.
Обсуждение
Фермент глутатион-S-трансфераза P1 участвует в детоксикации ксенобиотиков, в частности, полициклических ароматических углеводородов [14–16]. Полиморфизмы гена GSTP1 связаны с изменением ферментативной активности, что может приводить к различным заболеваниям на фоне воздействия поллютантов [15]. Ген EPHX1 кодирует аминокислотную последовательность фермента системы детоксикации эпоксид-гидролазы-1 (I фазы биотрансформации). Фермент EPHX1 так же, как и GSTP1, участвует в метаболизме полициклических ароматических углеводородов (в том числе бенз(а)пирена). При этом полиморфизм гена может изменять его функциональную активность, что способствует токсическому действию поллютантов [17, 18]. Одним из наиболее изученных полиморфизмов гена EPHX1 является c.337 T>C (rs1051740).

Ген GPX1 кодирует аминокислотную последовательность фермента глутатион-пероксидазы-1. Глутатион-пероксидаза-1 широко распространена в организме, встречается в клетках различных органов и тканей. Она участвует в детоксикации перекиси водорода: катализирует реакции конъюгации перекиси водорода с восстановленной формой глутатиона, в результате чего образуется вода и глутатион-дисульфид.
Ген NAT2 кодирует аминокислотную последовательность фермента N-ацетилтрансферазы-2 (II фаза биотрансформации). Этот фермент катализирует реакции переноса ацетильной группы на ксенобиотики (ариламины, гидразины) и канцерогены. В зависимости от носительства разных аллельных вариантов гена NAT2 людей можно разделить на быстрых, средних и медленных ацетиляторов. Статус медленного ацетилирования по NAT2 может быть связан с развитием онкологических заболеваний за счет снижения детоксикационных способностей организма по отношению к канцерогенам (например, полициклическим ароматическим углеводородам) [19–21].
Ген SULT1A1 кодирует аминокислотную последовательность фермента сульфотрансферазы-1А1 (II фаза биотрансформации). Представители семейства сульфотрансфераз катализируют реакции сульфирования. Они различаются субстратной специфичностью и локализацией в различных тканях. Сульфотрансфераза-1А1 участвует в биотрансформации стероидных гормонов, катехоламинов, фенолсодержащих лекарственных препаратов, канцерогенов и других веществ. Мутации SULT1A1 могут быть связаны с развитием онкологических заболеваний [22, 23].
Ген CYP1A1 кодирует аминокислотную последовательность фермента цитохрома Р450 1А1 (I фаза биотрансформации). Он относится к суперсемейству ферментов цитохрома Р450. Представители этой большой группы являются монооксигеназами и катализируют реакции метаболизма ксенобиотиков, а также участвуют в синтезе холестерина, стероидов и других липидов. Цитохром Р450 1А1 локализуется в мембране эндоплазматического ретикулума и катализирует реакции метаболизма полициклических ароматических углеводородов (например, бенз(а)пирена) до эпоксидов, при этом могут образовываться промежуточные канцерогенные соединения. Установлено, что CYP1A1 не обнаруживается в интактной ткани, а синтезируется de novo после проникновения в липидный слой клеточных мембран гидрофобных ксенобиотиков и их взаимодействия со специфическим рецептором. Полиморфизм CYP1A1 связан с изменением активности гена. Носители «высокоиндуцибельного» аллеля (особенно курильщики) имеют повышенный риск рака легкого [22, 23], так как у таких людей фермент более активно переводит полициклические ароматические углеводороды табачного дыма в активные канцерогены.
Аллельные варианты генов фолатного цикла – MTHFR и MTR, связаны со снижением уровня фолатов и развитием витамин-дефицитного состояния. Дефицит фолатов приводит к снижению метилирования ДНК, дестабилизации генома и активизации многих клеточных генов, в том числе и онкогенов. Кроме того, происходит избыточное накопление гомоцистеина – промежуточного продукта синтеза метионина. В случае сниженной активности MTHFR усиливается влияние тератогенных и мутагенных факторов внешней среды во время беременности [9–11].
В нашем исследовании было выявлено, что уровень полициклических ароматических углеводородов, таких как бенз(а)пирен, стирол и формальдегид, в крови женщин и в пуповинной крови был связан с полиморфизмом генов детоксикации. Уровень бенз(а)пирена был ниже у женщин и новорожденных с наличием генотипа АА гена GSTP1 c.313 A>G, генотипа ТТ гена EPHX1 c.337 T>C, генотипа СС гена GPX1 c.599C>T, генотипа GG гена NAT2 c.857 G>A, генотипа GG гена SULT1A1 c.404G>A, генотипа СC гена MTHFR c.677 C>T и генотипа AA гена MTR c.2756A>G. Т.е. данные генотипы, по-видимому, играют защитную роль против накопления бенз(а)пирена в организме как матери, так и плода. Аналогично, повышенный уровень стирола в материнской или пуповинной крови был ассоциирован с наличием генотипа ТТ гена GPX1 c.599C>T, генотипа ТС гена CYP1A1 c.1189T>C, генотипа GG/AG гена MTR c.2756A>G и генотипа СТ гена MTHFR c.677 C>T. Уровень формальдегида был повышен при наличии генотипа СС/ТС гена NAT2 c.341 T>C. Таким образом, можно предположить, что аллель С гена NAT2 c.341 T>C играет негативную роль в плане накопления формальдегида в организме матери и плода.
В нашем исследовании было установлено, что масса тела новорожденных была выше при более низком содержании в крови матери и пуповинной крови изучаемых полициклических ароматических углеводородов. При этом влияние этих веществ на массу тела плода модифицировалось носительством определенных аллельных вариантов генов детоксикации, влияющих на накопление и разрушение данных поллютантов в организме матери. Повышенный уровень бенз(а)пирена не приводил к снижению массы тела новорожденного при условии наличия аллеля А гена GSTP1 c.313 A>G, аллеля G гена SULT1A1 c.404G>A, аллеля T гена CYP1A1 c.1189T>C и аллеля А гена MTR c.2756A>G. Что касается стирола, то его повышенное содержание в организме женщины и плода приводило к снижению массы тела при рождении при носительстве аллеля С гена CYP1A1 c.1189T>C, аллеля Т гена MTHFR c.677 C>T и аллеля G гена MTR c.2756A>G. В случае более высокого содержания формальдегида масса тела новорожденных детей была значимо ниже при наличии аллеля С гена NAT2 c.341 T>C (rs1801280).
В литературе имеются данные, учитывающие влияние полициклических ароматических веществ, а также данные о сочетанном влиянии концентрации в воздухе мелких частиц (PM10) и полиморфизмов генов антиоксидантной системы (CYP1A1 rs4646903) на массу тела новорожденных, которые согласуются с нашими данными [24–27]. При этом нами не были найдены исследования, в которых бы изучалось влияние полициклических ароматических углеводородов на массу новорожденных с учетом наличия полиморфизмов генов детоксикации. Влияние генов фолатного цикла на массу тела при рождении также недостаточно освещено в научной медицинской литературе. В единственном исследовании, где изучалось влияние полиморфизмов MTR на патологические акушерские исходы (включая малую массу новорожденных), не было выявлено значимых ассоциаций [28]. Имеются данные о снижении массы тела новорожденных у пациенток- носительниц аллеля Т гена MTHFR c.677 C>T (rs1801133), что согласуется с нашими данными [29].
Анализ сочетанного влияния концентрации свинца в крови матери и полиморфизма MTHFR на массу тела новорожденных не привел к получению статистически значимых результатов [30].
Заключение
Полученные нами результаты свидетельствуют о ключевой роли аллельного состояния генов системы биотрансформации ксенобиотиков (GSTP1 c.313 A>G, EPHX1 c.337 T>C, NAT2 c.341 T>C, SULT 1A1 c.404 G>A и CYP1A1 c.1189 T>C), антиоксидантной защиты (GPX1 c.599 C>T) и фолатного обмена (MTHFR c.677 C>T и MTR c.2756 A>G) в формировании задержки роста плода. Полициклические ароматические углеводороды при попадании в организм сначала активируются ферментами семейства цитохромов, в частности CYP1A1, а затем инактивируются глутатионтрансферазами, в частности GSTМ1 и GSTР1. Cочетание «высокоактивного» генотипа CYP1A1 с «дефицитными» вариантами GST может существенно усиливать риск рождения детей с малой массой тела. Важно отметить, что все выявленные нами «благоприятные» аллели являются преобладающими в популяции.



