Повышение эффективности методов вспомогательных репродуктивных технологий (ВРТ) является актуальной задачей современной репродуктивной медицины. Поскольку стимуляция суперовуляции – важный этап программы ЭКО, во многом определяющий ее результативность, перспективным направлением репродуктологии является оптимизация протоколов стимуляции суперовуляции с учетом индивидуальных особенностей репродуктивной системы женщины.
Развитие и рост нескольких фолликулов в результате гормональной стимуляции яичников в программе ЭКО увеличивает количество полученных эмбрионов, доступных для переноса. При этом стимуляция яичников вызывает закономерное увеличение сывороточного уровня эстрадиола (Е2) и прогестерона. Полагают, что одна из причин низкой эффективности программы ЭКО – преждевременная лютеинизация (ПЛ) – повышение уровня прогестерона в сыворотке крови в день введения хорионического гонадотропина человека (ХГч) [1].
ПЛ осложняет в среднем от 12,4 до 52,3% циклов ВРТ [2], варьируя от 5–35% в длинных протоколах с агонистами гонадотропин-рилизинг гормона (аГнРГ) до 85% в коротких протоколах с аГнРГ, а в протоколах с антагонистами ГнРГ (антГнРГ) составляет 13–71% [3].
Патогенез ПЛ в программах ВРТ плохо изучен. До появления аналогов ГнРГ ПЛ была следствием преждевременного пика ЛГ, что приводило к плохому качеству ооцитов и эмбрионов, низкому уровню фертилизации и частоты наступления беременности в программах ВРТ [4, 5]. С внедрением аналогов ГнРГ в рутинную практику стимуляции суперовуляции стали предполагать, что повышение прогестерона является результатом неполной десенситизации гипофиза [6], но более поздние исследования не подтвердили эти предположения [7, 8]. Наиболее сложен и противоречив механизм развития ПЛ в длинных протоколах с аГнРГ, поскольку они предотвращают преждевременный пик ЛГ у 95–98% пациенток [8]. В последние годы появились данные, что повышение прогестерона перед назначением ХГч в циклах с аналогами ГнРГ может быть результатом стимуляции как таковой, и прежде всего результатом ответа на стимуляцию ФСГ, а не ЛГ [9–11].
Несмотря на существенную распространенность ПЛ, в литературе продолжаются дебаты о ее влиянии на исходы программ ЭКО/ИКСИ. В то время как некоторые исследователи не находят существенной взаимосвязи между ПЛ и вероятностью наступления беременности [2, 3], другие подтверждают ее неблагоприятный эффект на исходы ВРТ за счет негативного влияния либо на параметры фолликуло-, оо- и эмбриогенеза [12], либо на рецептивность эндометрия [9, 10]. Последний систематический обзор и метаанализ 60 000 циклов, проведенный С. Venetis и соавт. (2013), показал, что частота прогрессирующей беременности снижается при концентрации прогестерона в день введения триггера овуляции более 0,8 нг/мл [1].
Однако большинство исследователей используют пороговое значение прогестерона ≥1,5 нг/мл [9].
Наличие негативной ассоциация между повышением прогестрона в день назначения ХГч и наступлением беременности диктует необходимость разработки лечебных подходов для предотвращения влияния ПЛ на эффективность программ ЭКО. Наоборот, отсутствие этой связи свидетельствует о том, что исследование прогестерона в течение фолликулярной фазы или в день назначения ХГч нецелесообразно [13].
Таким образом, отсутствие однозначных данных о механизме развития и влияния ПЛ на исходы циклов ВРТ послужило основанием для проведения настоящего исследования.
Цель: оценить частоту встречаемости и влияние повышения уровня прогестерона в день введения ХГч на эффективность лечения бесплодия в программе ЭКО в протоколах с аГнРГ.
Материал и методы исследования
Проведено клиническое контролируемое исследование у 253 пациенток с трубно-перитонеальным и/или мужским факторами бесплодия, которые получали лечение в программах ВРТ, и у 19 доноров ооцитов. Критерии включения: возраст до 38 лет, уровень ФСГ <12 МЕ/л, регулярный менструальный цикл 21–35 дней, не более 2 безуспешных попыток ЭКО в анамнезе. Критерии исключения: наружный и внутренний эндометриоз III–IV степени распространения, интерстициальная или субсерозная миома матки размером более 4 см, пороки развития внутренних половых органов, включая состояния после хирургической коррекции, патозооспермия III–IV степени, развитие синдрома гиперстимуляции яичников средней или тяжелой степени на фоне стимуляции функции яичников в данном цикле ЭКО. Информированное согласие на участие в исследовании было получено у всех пациенток.
Возраст пациенток, включенных в исследование, составил 32,1±0,2 года. Бесплодие было обусловлено трубно-перитонеальным фактором у 116 (45,8%) пациенток, мужским – у 73 (28,9%), сочетание факторов наблюдалось у 66 (25,8%) больных. Наружный генитальный эндометриоз I–II степени распространения диагностирован у 57 (21%) пациенток. Первичное и вторичное бесплодие встречалось с одинаковой частотой (51 и 49% соответственно); продолжительность бесплодия – 5,8±0,2 года. Первая программа ЭКО проведена у 163 (59,9%) пациенток.
Стимуляцию функции яичников проводили по стандартному длинному протоколу с использованием препаратов рекомбинантного ФСГ (рФСГ) у 141 (51,8%) пациенток и человеческого менопаузального гонадотропина (чМГ) – у 131 (48,2%). Предварительную десенситизацию гипоталамо-гипофизарно-яичниковой системы проводили с 21-го дня менструального цикла путем введения аГнРГ в дозе 0,1 мг ежедневно однократно подкожно. Введение гонадотропинов начиналось при подтверждении десенситизации: отсутствие кист яичников, толщина эндометрия не более 4 мм; уровень гормонов: Е2<100 пмоль/л, прогестрон <1,5 нмоль/л; ЛГ<4 МЕ/л. Подбор стартовой дозы индуктора проводился исходя из параметров овариального резерва (возраст, уровень ФСГ, АМГ, количество антральных фолликулов и ответ на предыдущую стимуляцию). Доза индуктора изменялась в соответствии с ответом яичников на стимуляцию. Для финального созревания ооцитов вводили овуляторную дозу ХГч 10 000 МЕ при визуализации трех и более фолликулов ≥17 мм в диаметре и толщине эндометрия 8–10 мм. Аспирацию ооцитов осуществляли через 35–36 ч после введения триггера овуляции. Преинкубация, оплодотворение ооцитов или ИКСИ, а также культивирование эмбрионов осуществлялось в средах для культивирования фирмы «ORIGIO» (Дания). Оценка качества полученных ооцитов по степени зрелости и эмбрионов осуществлялась на основании общепринятых критериев. Перенос 1–2 эмбрионов проводили на 2–5-е сутки культивирования. Поддержку посттрансферного периода осуществляли с помощью вагинального введения микронизированного прогестерона в суточной дозе 600 мг со следующего дня после пункции.
Гормональный мониторинг цикла включал определение уровней ФСГ, ЛГ, Е2, прогестерона на 2–3-й день цикла после десенситизации; ЛГ, Е2, прогестерона на 6-й день стимуляции и в день введения триггера овуляции. Концентрацию гормонов в сыворотке крови определяли с использованием иммуноферментных тест-систем фирмы «Hoffmann La Roche» (Швейцария) на автоматическом анализаторе Elecsys 2010 той же фирмы, а также хемилюминесцентных тест-систем фирмы DPC на автоматическом анализаторе Immulite (USA).
Использовали пороговое значение сывороточного уровня прогестерона для определения преждевременной лютеинизации – 4,77 нмоль/л (1,5 нг/мл; коэффициент пересчета 3,18). Пороговое значение прогестерона в день введения триггера овуляции было выбрано на основании данных литературы [4]. В зависимости от уровня прогестерона в день введения ХГч пациентки были разделены на группы:
- 1-я группа (n=233) – прогестерон <4,77 нмоль/л;
- 2-я группа (n=39) – прогестерон ≥4,77 нмоль/л.
 Проводилась оценка стартовой и суммарной дозы гонадотропинов, длительности стимуляции яичников до введения ХГч; числа полученных и зрелых ооцитов; частоты оплодотворения, качества эмбрионов. Эффективность лечения оценивали по показателям частоты наступления беременности на перенос эмбрионов. Биохимическая беременность была диагностирована на 12–14-й день после переноса эмбрионов при концентрации β-субъединицы ХГ в сыворотке крови >20 МЕ/л. Клиническую беременность подтверждали при визуализации в полости матки одного или двух плодных яиц, содержащих живые эмбрионы через 5–6 недель после переноса.
Проводилась оценка стартовой и суммарной дозы гонадотропинов, длительности стимуляции яичников до введения ХГч; числа полученных и зрелых ооцитов; частоты оплодотворения, качества эмбрионов. Эффективность лечения оценивали по показателям частоты наступления беременности на перенос эмбрионов. Биохимическая беременность была диагностирована на 12–14-й день после переноса эмбрионов при концентрации β-субъединицы ХГ в сыворотке крови >20 МЕ/л. Клиническую беременность подтверждали при визуализации в полости матки одного или двух плодных яиц, содержащих живые эмбрионы через 5–6 недель после переноса.
Статистический анализ результатов проводили с использованием программы IPM SРSS Statistics, версия 21. Для сравнения непараметрических данных применяли метод Манна–Уитни (для 2 групп) для несвязанных совокупностей; критерий χ2 для таблиц сопряженности признаков 2*2, 2*3 и 2*4 (для сравнения частот встречаемости признаков в анализируемых группах). Результаты представлены как среднее ± стандартная ошибка среднего (М±m). Статистически значимыми считали отличия при р<0,05 (95% уровень значимости).
Результаты исследования
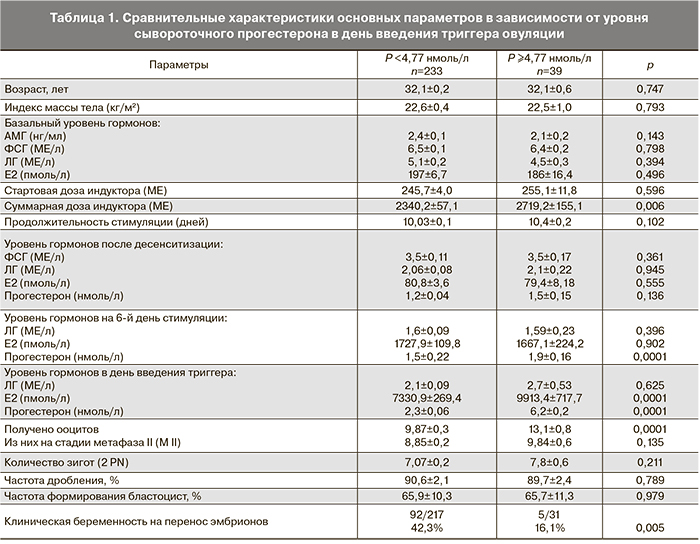
Анализ базальных характеристик обследованных больных показал, что статистически значимых различий по возрасту и параметрам овариального резерва у пациенток с нормальным и повышенным уровнем прогестерона выявлено не было (табл. 1).
Стартовая доза гонадотропинов была сопоставима в обеих группах (245,7±4,0 МЕ и 255,1±11,8 МЕ; р=0,596), также не отличалась продолжительность стимуляции (10,03±0,09 и 10,46±0,2 дня; р=0,102).
Результаты гормонального мониторинга не выявили достоверных различий в концентрации ФСГ, ЛГ, Е2, прогестерона на 2–3-й день цикла после десенситизации. На 6-й день стимуляции уровень ЛГ (1,6±0,09 и 1,59±0,23 МЕ/л; р=0,396) и Е2 (1727,9±109,8 и 1667,05±224,2 пмоль/л; р=0,902) также достоверно не отличался. Уровень прогестерона на 6-й день стимуляции у пациенток 1-й группы был существенно ниже, чем во 2-й группе (1,5±0,2 и 1,9±0,2 нмоль/л; р=0,0001) (табл. 1).
Было установлено, что в группе с повышенным прогестероном наблюдался более высокий уровень Е2 в день введения ХГч (9913,41±717,7 и 7330,9±269,4 пмоль/л; р=0,0001), получено большее количество ооцитов (13,1±0,8 и 9,87±0,3; р=0,0001) и использована большая суммарная доза индуктора (2719,2±155,1 и 2340,1±57,1 МЕ; р=0,006) по сравнению с группой с нормальным уровнем сывороточного прогестерона. При этом различий в количестве зрелых ооцитов (М II) (8,85±0,2 и 9,84±0,6; р=0,135) и зигот (2 PN) (7,07±0,2 и 7,8±0,6; р=0,211) выявлено не было. Не наблюдалось различий в частоте дробления и развития эмбрионов до стадии бластоцисты.
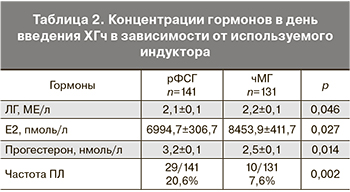
 Анализ частоты ПЛ в зависимости от используемого индуктора показал, что концентрации прогестерона ≥4,77 нмоль/л в день введения ХГч наблюдались у 10 пациенток (7,6%) в группе чМГ и у 29 пациенток (20,6%) в группе рФСГ. При этом концентрация ЛГ (2,1±0,1 и 2,2±0,1 МЕ/л; р=0,046) и Е2 (6994,7±306,7 и 8453,9±411,7 пмоль/л; р=0,027) была существенно выше при использовании чМГ (табл. 2).
Анализ частоты ПЛ в зависимости от используемого индуктора показал, что концентрации прогестерона ≥4,77 нмоль/л в день введения ХГч наблюдались у 10 пациенток (7,6%) в группе чМГ и у 29 пациенток (20,6%) в группе рФСГ. При этом концентрация ЛГ (2,1±0,1 и 2,2±0,1 МЕ/л; р=0,046) и Е2 (6994,7±306,7 и 8453,9±411,7 пмоль/л; р=0,027) была существенно выше при использовании чМГ (табл. 2).
Среди пациенток с нормальным уровнем прогестерона было 13 (5,6%) доноров ооцитов, с повышенным уровнем прогестерона – 6 (15,4%). У 1 (0,4%) пациентки в 1-й группе ооциты не были получены, во 2-й у 1 (2,5%) наблюдалась преждевременная овуляция в связи с неполной десенситизацией.
Анализ частоты встречаемости повышенного уровня прогестерона в день введения триггера овуляции в зависимости от количества полученных ооцитов показал, что частота ПЛ существенно выше (р=0,010) у пациенток с большим количеством ооцитов (табл. 3).
Перенос эмбрионов выполнен у 217 (93,1%) пациенток в 1-й группе и у 31 (79,4%) во 2-й группе. Эмбрионы, пригодные для переноса, не были получены у 3 (1,2%) пациенток с нормальным и у 1 (2,5%) женщины с повышенным уровнем прогестерона.
Клиническая беременность на перенос эмбрионов была достигнута у 92 из 217 пациенток в группе с нормальным уровнем сывороточного прогестерона в день введения ХГч (42,3%) и у 5 из 31 пациенток в группе с высоким уровнем прогестерона (16,1%). Это различие было статистически значимым (р=0,005) (табл. 1).
Обсуждение
Частота встречаемости повышения уровня сывороточного прогестрона ≥4,77 нмоль/л (1,5 нг/мл) в день введения ХГч в нашем исследовании составила 14,3%. В литературе частота ПЛ изменяется в соответствии с используемым пороговым значением прогестерона, варьируя от 46,7% при пороговом значении 0,4–0,6 нг/мл до 12,3% при пороговом значении 1,9–3,0 нг/мл [1]. Так, в исследовании E.G. Papanikolaou и соавт. (2012) при пороговом значении прогестрона 1,5 нг/мл частота ПЛ составила 24,1% в протоколах с аГнРГ [14].
Анализ более 4000 циклов, проведенный Bosch и соавт. (2010), показал, что частота повышения прогестерона в день введения чХГ более 1,5 нг/мл составляет 8,4% в протоколах как с аГнРГ, так и антагонистом ГнРГ [9].
Проведенный анализ показал, что у пациенток с повышенным уровнем прогестерона в день введения ХГч суммарная доза индуктора была существенно выше. В исследованиях E. Bosch и соавт. (2010) высокая ежедневная доза ФСГ является фактором, ассоциированным с повышением прогестерона [9]. В нашем исследовании стартовая доза индуктора в группе с прогестероном ≥4,77 нмоль/л в день введения триггера была снижена на 10±0,5 дня стимуляции, в группе с прогестероном <4,77 нмоль/л – на 7,6±0,1 дня стимуляции. Это различие было статистически значимым (р=0,006). У 33 из 39 пациенток в 1-й группе (84,6%) и у 109 из 233 во 2-й группе (46,8%) стартовая доза гонадотропинов не изменялась (р=0,0001). Этим можно объяснить значимые различия между группами в суммарной дозе индуктора при отсутствии различий в стартовой дозе и длительности стимуляции.
Кроме того, у пациенток с уровнем прогестерона ≥4,77 нмоль/л в день введения триггера овуляции наблюдались более высокие концентрации Е2 и получено большее количество ооцитов. Результаты исследования D. Kyrou и соавт. (2009) также показали, что пациентки с высокой концентрацией Е2 имели значительно более высокий уровень прогестерона и большее количество полученных ооцитов [15]. Сочетание высокого уровня Е2 и прогестерона в конце стимуляции позволяет предположить, что одним из механизмов повышения прогестерона может служить избыточный ответ яичников на стимуляцию. Повышенный уровень прогестерона может быть связан с большим количеством растущих при стимуляции фолликулов, каждый из которых производит нормальное количество прогестерона [2], и в редких случаях – с ПЛ лидирующего фолликула [14]. По данным C.Y. Andersen (2011), концентрация прогестерона в день введения ХГч была связана с количеством фолликулов >10 мм, числом полученных ооцитов и суммарной дозой ФСГ [16]. При этом повышение концентрации прогестерона не сопровождается повышением уровня ЛГ, что подтверждают данные об отсутствии взаимосвязи между концентрацией ЛГ и прогестерона в позднюю фолликулярную фазу [9, 17]. Однако в исследовании Hugues (2011) была обнаружена положительная корреляция прогестерона с сывороточными ЛГ у пациентов в протоколах с аГнРГ. Авторы предполагают, что в условиях десенситизации ЛГ может косвенно способствовать росту сывороточного прогестерона [18]. В нашем исследовании концентрации ЛГ в день введения ХГч не отличались в группе пациенток с нормальным и повышенным уровнем прогестерона.
Следует отметить, что более высокий уровень прогестерона в день введения триггера овуляции наблюдался у пациенток в группе с рФСГ в сравнении с чМГ. При этом уровень ЛГ и Е2 был существенно выше при использовании чМГ. В исследовании MERIT (2006) также отмечена более высокая доля пациенток с повышением прогестерона в день введения триггера овуляции в группе женщин с рФСГ по сравнению с пациентками, получавшими чМГ (24,1 и 11,8% соответственно, р<0,001), что объясняет целесообразность использования препаратов с ЛГ-активностью, которые уменьшают, а не повышает уровень прогестерона перед назначением ХГч [19]. Использование фиксированной дозы ФСГ (150МЕ) и различных доз ЛГ (37,5 МЕ; 75 МЕ; 150 МЕ) в протоколах с аГнРГ показало, что уровень сывороточного Р позитивно коррелировал с дозой ФСГ (r=0,447, р<0,00001), но не с дозой ЛГ [11]. Эти данные подтверждают мнение, что ПЛ может быть вызвана повышением стероидогенной функции гранулезных клеток за счет интенсивной ФСГ-стимуляции, а не за счет ЛГ-активности индукторов. Однако последний метаанализ (2013) не выявил статистически значимой разницы в частоте ПЛ при сравнении исследований, в которых были использованы рФСГ и ЛГ-содержащие гонадотропины для стимуляции яичников [1].
Более высокую концентрацию Е2 в конце стимуляции в группе с чМГ можно объяснить непрерывным воздействием ЛГ из чМГ, который индуцирует ароматизацию андрогенов, что приводит к повышению концентрации Е2 в позднюю фолликулярную фазу стимулированного цикла [20]. Также это может быть связано с различной кинетикой изоформ ФСГ в двух гонадотропинах [21].
Результаты исследования показали, что повышение прогестерона в день введения ХГч ≥4,77 нмоль/л связано со снижением частоты клинической беременности. Это подтверждает важную роль концентрации прогестерона в конце стимуляции в исходах циклов ЭКО. Однако в литературе продолжаются дебаты о влиянии ПЛ на частоту наступления беременности. Так, систематический обзор и метаанализ Venetis и соавт. (2007) не выявил связи между концентрацией прогестерона в день введения чХГ и частотой наступления беременности [2]. Данное исследование было подвергнуто критике в связи с рядом недостатков. Недавний систематический обзор и метаанализ 60 000 циклов, проведенный этими же авторами, показал, что уровень прогестерона ≥0,8 нг/мл в день введения ХГч связан со значительно меньшей вероятностью наступления беременности после переноса эмбриона в лечебном цикле у женщин, подвергающихся стимуляции яичников с использованием гонадотропинов и аналогов ГнРГ. В исследовании Bosch и соавт. (2010) пациентки с уровнем прогестерона ≤1,5 нг/мл в день введения триггера овуляции имели более высокую частоту наступления беременности, чем пациентки с концентрацией прогестерона ≥1,5 нг/мл (31 и 19,1%; р=0,00006) [9].
Оказывая негативный эффект на частоту наступления беременности, повышенная концентрация прогестерона в конце стимуляции не влияет на качество ооцитов/эмбрионов. Свидетельством этого является отсутствие значимых отличий в показателях ооцито- и эмбриогенеза у пациенток с нормальным и повышенным уровнем прогестерона. Эти данные также подтверждают мнение, что ПЛ оказывает негативное влияние на исходы циклов ЭКО путем снижения рецептивности эндометрия, вызывая опережение созревания эндометрия, в результате чего отсутствует синхронизация между эндометрием и развивающимся эмбрионом [22]. Более того, результаты исследования Melo и соавт. (2006), проведенного в программе донации ooцитов, показали, что на частоту наступления беременности реципиентов не влиял сывороточный уровень прогестерона доноров в конце стимуляции [23], что также позволяет предположить неблагоприятное влияние ПЛ на эндометрий.
Заключение
Таким образом, полученные данные показали, что повышенный уровень сывороточного прогестерона в день введения ХГч связан с количеством полученных ооцитов и концентрацией Е2 в конце стимуляции, а также с суммарной дозой гонадотропинов. Наиболее часто ПЛ наблюдается при использовании рФСГ. Частота клинической беременности существенно снижается при концентрации прогестерона ≥4,77 нмоль/л в день введения ХГч. При этом уменьшение частоты наступления беременности, наблюдаемое в группе с высоким прогестероном, не было связано с влиянием на ооциты и/или эмбрионы, что позволяет предположить возможность влияния на рецептивность эндометрия. Необходимы исследования, оценивающие патогенетическое влияние ПЛ на созревание и рецептивность эндометрия.



