Сперматозоиды – высокоспециализированные клетки, основной функцией которых является хранение и транспортировка наследственной информации. ДНК сперматозоида уложена отличным от соматической клетки образом. При созревании мужских гамет происходит ремоделирование структуры хроматина, что связано с заменой гистонов на более основные белки – протамины, что приводит к уплотнению хроматина. Так, объем ядра мужской гаметы в 6 раз меньше по сравнению с объемом ядра соматической клетки [1]. В такой форме ДНК сперматозоидов защищена от повреждений и доставляется из мужского репродуктивного тракта в женский. Однако в ходе созревания и транспорта сперматозоидов в молекуле ДНК могут возникать разрывы, как одно-, так и двунитевые. Разрывы ДНК могут повлиять на дальнейшее эмбриональное развитие и наступление беременности.
Выделяют несколько основных причин возникновения разрывов в ДНК сперматозоида. В первую очередь это нерепарированные разрывы ДНК из-за ошибок в ходе ремоделирования хроматина. Также разрывы ДНК могут быть следствием незавершенного апоптоза. Другой причиной, приводящей к фрагментации ДНК сперматозоида, служат активные формы кислорода, в норме необходимые для пролиферации, дифференциации и функционирования мужских гамет. При этом происхождение повреждений ДНК может быть комплексным и включать сразу все перечисленные причины [2, 3]. В то же время известно, что системы репарации ДНК менее активны на поздних стадиях сперматогенеза, что позволяет сперматозоидам с поврежденной ДНК попадать в эякулят [4].
Определение причины нарушения репродуктивной функции у мужчины основывается на комплексном обследовании с применением клинического и лабораторного исследований. Основные нарушения связаны со снижением спермопродукции, подвижности или функционированием сперматозоидов. При этом важно отметить, что сперматозоиды даже со значительным уровнем фрагментации ДНК сохраняют способность к оплодотворению ооцита, но в дальнейшем могут вести к остановке эмбрионального развития [5]. В случае, когда в эякуляте мужчины снижена подвижность, количество сперматозоидов или присутствует большое число аномальных сперматозоидов, используют внутрицитоплазматическую инъекцию сперматозоида в ооцит (ICSI). По данным европейской мониторинговой программы ЭКО метод ICSI в 2010 году применялся почти в 70% случаев циклов вспомогательных репродуктивных технологий (ВРТ) [6]. При ICSI выбор эмбриологом единичного сперматозоида для оплодотворения ооцита происходит субъективно, опираясь только на некоторые биохимические и морфологические характеристики клетки. Однако морфология и подвижность сперматозоидов не всегда указывают на состояние его ДНК. Поэтому исключительно важным является поиск маркеров состояния генетического материала для прижизненного отбора сперматозоида [7].
Целью данного исследования была оценка влияния фрагментации ДНК сперматозоидов на эффективность оплодотворения и развитие эмбрионов, культивируемых in vitro.
Материал и методы исследования
Данное исследование проведено в отделении вспомогательных репродуктивных технологий ФГБНУ НИИ акушерства, гинекологии и репродуктологии им. Д.О. Отта (Санкт-Петербург) с разрешения этического комитета.
Критерием включения являлся диагноз «бесплодие» в супружеской паре более одного года половой жизни без применения контрацепции. У обоих супругов были получены отрицательные результаты обследования на определение антител к бледной трепонеме в крови, антител класса М, G к ВИЧ 1, ВИЧ 2, антител к вирусам гепатитов В и С. Причинами бесплодия у женщин являлись хронический сальпингоофорит, эндометрит, трубный фактор бесплодия. У мужчин результат спермограмм варьировал от нормозооспермии до различных форм патозооспермии. В исследование включены 65 эмбриологических протоколов: в 29 протоколах оплодотворение ооцитов проводили методом ЭКО, в 36 – методом ICSI. Выбор метода оплодотворения зависел от показателей спермиологического анализа. Средний возраст мужчин из бесплодных супружеских пар составил 37,4±6,0 года, женщин – 35,7±5,0 года.
Полученный в день пункции ооцит-кумулюсных комплексов нативный эякулят оценивали согласно требованиям ВОЗ [8]. Стандартный спермиологический анализ включал в себя измерение объема эякулята, а также оценку концентрации, подвижности и морфологии сперматозоидов. После проведения спермограммы образцы разделяли на две части. Первую подготавливали для процедуры ЭКО или ICSI с помощью метода центрифугирования в градиенте плотности силиконовых частиц SupraSperm (Origio, Denmark) в течение 20 мин при 300g. После центрифугирования удаляли супернатант и добавляли Sperm Preparation Medium (Origio, Denmark). Проводили повторное центрифугирование 10 мин при 400g, удаляли супернатант и проводили выделение фракции живых подвижных сперматозоидов методом флотации. Вторую часть полученного нативного эякулята обрабатывали гипотоническим раствором 0,33% цитрата натрия. После центрифугирования 15 мин при 600g эякулят фиксировали с помощью метанол-уксусного фиксатора (3:1) и хранили до приготовления препаратов на -20 °С.
Исследование фрагментации ДНК сперматозоидов проводили методом TUNEL (Terminal deoxynucleotidil transferase (TdT)-mediated dUTP Nick and Labelling).
Согласно инструкции фирмы-производителя суховоздушные препараты сперматозоидов отмывали в фосфатно-солевом буфере (1хPBS). После дополнительной фиксации в 4% растворе парафольмальдегида (ПФА) препараты инкубировали в пермобилизирующем растворе 0,1% Triton X-100, растворенном в 0,1% цитрате натрия, в течение 15 мин при -20 °С (Sigma, Germany). Далее под покровное стекло добавляли реакционную смесь: 4,5 мкл 1хTdT буфера и 0,5 мкл фермента (Roche, Germany). Позитивный и негативный контроли проводили согласно инструкции фирмы-производителя. Препараты инкубировали 1 час при +37ºС. После двухкратной отмывки в 1хPBS реакцию останавливали дистиллированной водой, препараты проводили по спиртам возрастающей концентрации (70°, 80°, 96°). Затем препараты заключали в фотозащитный раствор, содержащий краситель DAPI (4,6-diamino-2-phenylidole) в концентрации 1 мкг/мл (Sigma, Germany). Флуоресцентный сигнал оценивали с помощью микроскопа Leica DM 2500 с камерой Leica DFC 345 FX. Для получения фотоизображения использовали программное обеспечение Leica Application Suite V.3.8.0. Для каждого пациента оценивали не менее 2000 сперматозоидов.
В зависимости от показателей параметров спермиологического анализа полученные ооциты оплодотворяли методом ЭКО или методом ICSI. Оплодотворение и последующее культивирование эмбрионов проводили в 4-луночных планшетах со средой под минеральным маслом (Origio, Denmark) и инкубировали в атмосфере 5,3% CO2 при +37°С. Через 16–18 часов после оплодотворения оценивали число двупронуклеарных зигот. Эффективность оплодотворения оценивали как отношение количества двупронуклеарных зигот к числу полученных ооцит-кумулюсных комплексов. Эмбрионом высшего качества считали эмбрион на стадии морулы на 4-е сутки развития (Grade 4) [9]. Долю эмбрионов высшего качества рассчитывали как отношение числа эмбрионов на стадии морулы на 4-е сутки развития к числу двупронуклеарных зигот. Перенос эмбрионов осуществляли на 4-й день развития.
Клиническая беременность подтверждалась с помощью ультразвукового исследования по наличию плодного яйца спустя три недели после переноса эмбриона/ов в полость матки.
Статистический анализ проводили с помощью программного обеспечения GraphPad InStat. Для проверки данных на нормальное распределение использовали критерий Колмогорова–Смирнова. Для данных, не подчиняющихся нормальному распределению, применялись непараметрические критерии. Для сравнения медиан использовали тест Манна–Уитни (U-test). Для определения связи между фрагментацией ДНК и эффективностью оплодотворения, а также качеством эмбрионов использовали корреляцию Спирмена. Уровень значимости приняли p<0,05.
Результаты исследования
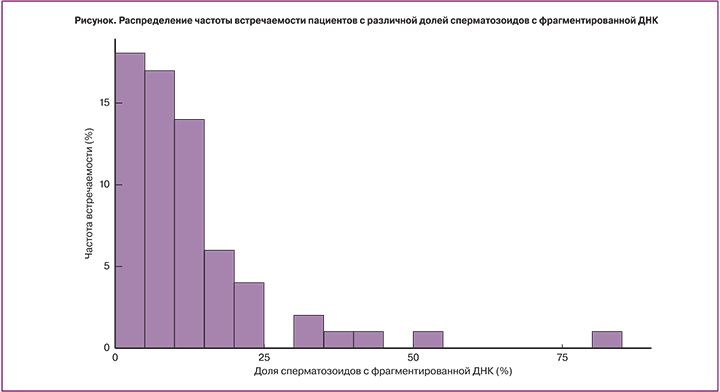
С помощью метода флуоресцентного мечения одно- и двунитевых разрывов ДНК (TUNEL) была оценена доля сперматозоидов с фрагментированной ДНК в эякуляте пациентов. Распределение частоты встречаемости пациентов с различной долей сперматозоидов с фрагментированной ДНК отображено на рисунке. Медиана распределения составила 9,93 (95% доверительный интервал 9,1–15,8), среднее распределения ± стандартное отклонение составило 12,44±13,35.
Между долей сперматозоидов с фрагментированной ДНК и эффективностью оплодотворения была выявлена отрицательная взаимосвязь вне зависимости от метода оплодотворения r=-0,33 (p=0,01). При этом в группе пациентов, для которых оплодотворение проводили методом ЭКО, коэффициент корреляции составил r=-0,35 (p=0,05), в группе ICSI – r=-0,34 (p=0,04).
Протоколы оплодотворения ооцитов разделили на две группы в зависимости от показателя эффективности оплодотворения: ≤70% и >70% [10]. В группе пациентов с эффективностью оплодотворения ≤70% доля сперматозоидов с фрагментированной ДНК составила 14,45±14,89 и была достоверно выше, чем в группе с эффективностью оплодотворения >70% – 7,47±5,74 (p=0,02) (табл. 1).
Проанализировано влияние доли сперматозоидов с фрагментированной ДНК на развитие эмбрионов. Не было обнаружено корреляции между долей сперматозоидов с фрагментированной ДНК и долей эмбрионов высшего качества, как при учете всех циклов (r=0,03; p=0,82), так и при разделении циклов в зависимости от метода оплодотворения (ICSI: r=-0,14; p=0,42; ЭКО: r=0,09; p=0,67).
В данном исследовании между группами, сформированными по доле эмбрионов высшего качества (<50% и ≥50% соответственно), достоверных различий по доле сперматозоидов с фрагментированной ДНК обнаружено не было (10,76±9,83 vs. 13,57±11,93; p=0,22) (табл. 2).
Общее количество клинических беременностей составило 25,8% (16/62). Как показано в табл. 3, в парах, в которых клиническая беременность наступила, и мужчина, и женщина были моложе, чем в парах с отсутствием беременности (p=0,05). Однако группы, сформированные по наличию/отсутствию беременностей, достоверно не отличались по доле сперматозоидов с фрагментированной ДНК.
Обсуждение
Вопрос о влиянии фрагментации ДНК сперматозоидов на эффективность оплодотворения и качество эмбрионов при использовании ВРТ остается открытым. Однако некоторыми исследователями показано, что повреждение ДНК сперматозоидов влияет на ранние этапы эмбрионального развития, в особенности на формирование бластоцисты, что определяет частоту наступления беременности в циклах ЭКО/ICSI [11].
Многие исследователи сходятся во мнении, что фрагментация ДНК сперматозоидов не снижает эффективности оплодотворения [12–14]. В то же время другие, напротив, считают, что при повышении уровня фрагментации ДНК сперматозоидов эффективность оплодотворения снижается [1, 15]. Кроме того, нет единого мнения и о влиянии фрагментации ДНК сперматозоидов на развитие эмбрионов. Некоторые исследователи полагают, что при увеличении уровня фрагментации ДНК сперматозоидов качество эмбрионов, культивируемых in vitro, снижается [16, 17]. Существует и альтернативное мнение по данному вопросу [18, 19]. Вместе с тем существует точка зрения об отсутствии каких-либо ассоциаций между фрагментацией ДНК сперматозоидов и эффективностью оплодотворения или эмбриональным развитием, но предполагается связь с наступлением или потерей беременности [20–22]. Более того, в некоторых исследованиях не обнаружено никаких побочных эффектов фрагментации ДНК сперматозоидов как при ЭКО, так и при ICSI [23].
Считается, что до стадии 4–8 клеток, до момента, когда происходит зиготическая трансформация (MZT, maternal to zygotic transformation), мужской геном находится в неактивном состоянии [24].
Следовательно, разрывы в ДНК сперматозоида не должны оказывать влияние на формирование пронуклеусов [12]. В то же время известно, что сперматозоиды с поврежденной ДНК, при условии, что фрагментация обусловлена действием активных форм кислорода (АФК), двигаются медленнее вследствие перекисного окисления липидов плазматической мембраны, что, безусловно, должно сказываться на оплодотворении. Нарушение плазматической мембраны сперматозоида в области акросомы может влиять и на акросомную реакцию [16].
Показано, что присутствие АФК негативно влияет на формирование пронуклеусов [17]. Полагают, что это происходит за счет разрушения микротрубочек и структур цитоскелета. Взаимосвязь между повышенным содержанием АФК и фрагментацией ДНК сперматозоидов подтверждена исследованиями [25]. Вероятно, и нарушение оплодотворения, и повышенная фрагментация ДНК сперматозоидов могут быть следствием одного процесса – повышенного содержания АФК.
В то же время присутствие небольшой концентрации АФК необходимо для созревания и функционирования сперматозоидов, например, для капацитации и акросомной реакции [24].
Согласно нашим данным, существует небольшая, но статистически значимая негативная корреляция между фрагментацией ДНК сперматозоидов и эффективностью оплодотворения, как в циклах ЭКО, так и в циклах ICSI, что согласуется с результатами других исследователей [1, 21, 26].
Также не существует единого мнения о влиянии фрагментации ДНК сперматозоидов на морфологические характеристики эмбрионов как in vivo, так и in vitro. Так, например, многими исследователями показано, что при внутриматочной инсеминации в парах, где у мужчин была повышена доля сперматозоидов с фрагментированной ДНК, число неудач было выше [16, 27].
По данным некоторых исследователей фрагментация ДНК негативно сказывается на раннем эмбриональном развитии. Однако различные методы детекции повреждения ДНК сперматозоидов, отсутствие стандартизированных методик и разнообразие критериев включения пациентов в группы исследования приводят к противоречию результатов. Так, например, пороговый уровень доли сперматозоидов с фрагментированной ДНК, который позволяет оценить влияние на развитие эмбрионов, сильно варьирует среди лабораторий от 10 до 35% [14].
В мета-анализе, представленном J.A. Collins и соавт. [13], показана небольшая, но статистически значимая ассоциация между фрагментацией ДНК сперматозоидов и результатами циклов ЭКО/ICSI, однако эта связь не обладает достаточной силой, чтобы обеспечить клиническую значимость для повсеместных исследований повреждения ДНК сперматозоидов при оценке бесплодия у мужчин.
Существует альтернативное мнение: M. Esbert с соавт. не было обнаружено влияния фрагментации ДНК на исход программ ВРТ как при использовании ооцитов от пациентов из бесплодных супружеских пар, так и от доноров ооцитов [23]. В нашем исследовании также не было обнаружено корреляции между долей сперматозоидов с фрагментированной ДНК и долей эмбрионов высшего качества как при учете всех циклов, так и при разделении в зависимости от метода оплодотворения. Результаты согласуются с данными многих исследователей [1, 21, 28].
Важно отметить, что нами не было обнаружено повышения доли сперматозоидов с фрагментированной ДНК у мужчин из супружеских пар с отсутствием клинической беременности. Известно, что после оплодотворения до начала первого деления дробления системы репарации ооцита могут исправлять до 10% повреждений ДНК сперматозоида [29]. Вероятно, дальнейшее эмбриональное развитие зависит от степени повреждения ДНК сперматозоида, участвовавшего в оплодотворении и качества ооцита. Безусловно, изучение влияния фрагментации ДНК сперматозоидов на раннее доимплантационное развитие и исход программ ВРТ требует дальнейших исследований.
Заключение
По результатам проведенного исследования было показано, что фрагментация ДНК сперматозоидов снижает эффективность оплодотворения, но не приводит к нарушению раннего доимплантационного развития эмбрионов при культивировании in vitro и снижению частоты наступления беременности.
Результаты данной работы могут быть использованы для разработки алгоритма обследования пациентов с нарушением фертильности, что особенно актуально для пар, прошедших ряд неудачных попыток ЭКО.



