Дисплазия соединительной ткани (ДСТ) остается до настоящего времени одной из самых обсуждаемых тем. Столь повышенный интерес к данной проблеме связан с широкой распространенностью данного патологического процесса в популяции. Считается, что распространение ДСТ среди населения значительно выше, чем можно было бы предположить [1, 2].
В зависимости от особенностей этиологии различают дифференцированные и недифференцированные формы ДСТ. К дифференцированным (синдромным) формам ДСТ относят болезни монофакторного характера с установленным генным дефектом, известным типом наследования и с выраженной и четко очерченной клинической картиной (синдром Марфана, синдром Элерса–Данло, несовершенный остеогенез и некоторые другие редкие генетические синдромы) [1, 2].
Для недифференцированной формы ДСТ (нДСТ) характерно наличие и/или сочетание нижеперечисленных симптомов: мышечная гипотония, уплощение свода стопы, астеническое телосложение, гиперподвижность суставов, сколиоз, кифосколиоз, привычные вывихи суставов, грыжи, спланхноптоз и другие симптомы). Интересен тот факт, что сочетание перечисленных признаков является основой для постановки диагноза ДСТ, но отдельно взятый признак может не быть строго специфичным для дисплазии [1, 2].
Причинами, приводящими к развитию нДСТ, являются полиморфизмы или мутации большого числа генов в различных сочетаниях, а также воздействие разнообразных факторов внешней среды [3–6]. НДСТ является одним из самых распространенных заболеваний соединительной ткани, хотя распознаваемость ее не превышает 2,4% [7–10].
Пациентки с патологией соединительной ткани входят в группу риска по развитию таких осложнений во время беременности и в родах, как угроза прерывания беременности, преэклампсия, плацентарная недостаточность, оперативное родоразрешение [11–13].
Чем более выражены симптомы ДСТ на полиорганном уровне, тем чаще имеют место быстрые и стремительные роды, а также развитие пролапса гениталий, причем уже в молодом возрасте. В таком случае пролапс гениталий быстро прогрессирует, сложнее поддается хирургической коррекции и чаще развивается рецидив в послеоперационном периоде [1, 8].
Известно, что магний является одним из основных элементов, который участвует в обеспечении важных биохимических и физиологических процессов в организме человека. Магний принимает участие в энергетическом, пластическом и электролитном обмене. Также магний стимулирует многие клеточные процессы [1, 14].
Недостаток магния также сочетается с различными осложнениями со стороны беременности и родов. На его фоне возможны преждевременные роды, развитие преэклампсии и эклампсии, артериальной гипертонии беременных, аритмии и мышечных судорог у беременных, также возможны развитие гестационного диабета и метаболического синдрома в послеродовом периоде и др. [14–17].
Дефицит магния активирует ренин-альдостероновую систему, приводит к повышению реабсорбции натрия и повышению сосудистого тонуса, повышению агрегации тромбоцитов и развитию инсулинорезистентности и в конечном итоге – к развитию артериальной гипертензии [8]. Выявлена обратная зависимость между уровнем магния в эритроцитах и величиной артериального давления в III триместре беременности. Низкий уровень внутриклеточного магния может способствовать развитию артериальной гипертензии у беременных [7, 8, 10].
Таким образом, учитывая все вышеперечисленное, можно сделать выводы о значительном влиянии нДСТ и гипомагниемии на течение различной сопутствующей патологии, беременности и родов [1, 8, 18]. Улучшение методов диагностики патологии со стороны соединительной ткани, проведение адекватных профилактических и лечебных мероприятий позволит предотвратить развитие возможных осложнений и повысит вероятность благоприятных исходов беременности.
Целью настоящего исследования явилось улучшение перинатальных исходов с учетом метаболизма коллагена на фоне гипомагниемии.
Материалы и методы
При оценке степени тяжести ДСТ мы пользовались данными Т.Ю. Смольновой, представленными в ее работах [19]. Помимо традиционных клинико-лабораторных исследований, дополнительно определяли уровень магния в плазме крови [20]. Для уточнения степени выраженности нДСТ мы определяли биохимические маркеры распада коллагена: гликозаминогликаны, пирилинкс Д (ДПИД) в утренней порции мочи, фибронектин в крови [21].
Статистический анализ
Для статистической обработки результатов настоящего исследования использовали статистические пакеты Statistica версии 13.3 с соблюдением общих рекомендаций для медицинских и биологических исследований.
Результаты и обсуждение
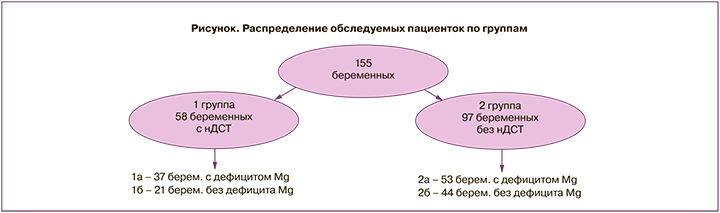
Всего было обследовано 155 беременных, часть из которых обратились в гинекологическое отделение с жалобами на симптомы, характерные для угрозы прерывания беременности, другая часть пациенток обратилась для постановки на учет по ведению беременности.
Все пациентки были разделены на 2 группы в зависимости от наличия или отсутствия у них признаков ДСТ. В 1-ю группу вошли 58 беременных (37,4%) с нДСТ. Во 2-ю группу включены 97 беременных (62,6%), у которых могли встречаться симптомы, характерные для нДСТ, однако их изолированное присутствие и отсутствие сочетания нескольких признаков не укладывалось в диагностику нДСТ.
Каждая группа была разделена на 2 подгруппы в зависимости от наличия или отсутствия у беременных дефицита магния. При уровне магния в плазме крови ниже 0,8 ммоль/л пациенток относили в группу с дефицитом магния. При показателях 0,8 ммоль/л и выше – в группу с нормальным содержанием магния в плазме.
1а подгруппу составили 37 пациенток (63,8%) с дефицитом магния в плазме крови, в 1б подгруппу вошли 21 пациентка (36,2%) с ДСТ, но с нормальным количеством магния в плазме крови. 2а подгруппу составили 53 беременных (54,6%) с дефицитом магния, 2б подгруппу – 44 здоровых беременных (45,4%) без признаков ДСТ в отсутствие дефицита магния в плазме крови (контрольная группа) (рисунок).
Средний возраст пациенток в группах не имел значимых отличий. Так, средний возраст в 1-й группе составил 28,7 (4,4) года (от 19 до 38 лет), во 2-й группе – 22,0 (4,6) года (от 22 до 39 лет).
Проявления ДСТ у пациенток 1-й группы были не столь выраженными. У 36 пациенток (62,1%) была легкая степень проявлений нДСТ, у 22 (37,9%) – средней степени.
Также у беременных мы выявляли наличие сопутствующей патологии. Дело в том, что наибольшую роль в постановке диагноза нДСТ играют такие проявления ДСТ, как сколиоз позвоночника с юности и сколиоз шейно-грудного отдела, пролапс митрального клапана, миопия, варикозное расширение вен нижних конечностей. Поэтому мы решили определить частоту встречаемости у обследуемых пациенток именно данных проявлений.
Оказалось, что сколиоз как одно из возможных проявлений ДСТ был у 12 пациенток (20,7%) 1-й группы и у 4 беременных (4,1%) 2-й группы. Анатомически узкий таз разной степени как одна из особенностей формирования костного скелета был выявлен у 8 беременных (13,8%) 1-й группы и у 3 пациенток (3,1%) 2-й группы. Миопия разной степени наблюдалась у 20 пациенток (34,5%) 1-й группы и у 29 пациенток (50%) 2-й группы. Пролапс митрального клапана без нарушения гемодинамики наблюдался у 8 пациенток (13,8%) 1-й группы, варикозная болезнь вен нижних конечностей – у 10 пациенток (17,2%). У пациенток 2-й группы пролапс митрального клапана был у 4 беременных (4,1%), варикозная болезнь вен нижних конечностей – у 10 (10,3%).
То есть при наличии у беременной сколиоза, анатомически узкого таза, пролапса митрального клапана, варикозной болезни вен нижних конечностей вероятность у пациентки нДСТ составляет 64,4%.
При сборе анамнеза, выяснении особенностей репродуктивной функции оказалось, что у пациенток с нДСТ чаще отмечаются самопроизвольные выкидыши по сравнению с пациентками 2-й группы.
Также интересно отметить, что в 1а подгруппе у пациенток на фоне дефицита магния частота самопроизвольного выкидыша в анамнезе составила 32,4% (12), в 1б подгруппе – 38,1% (у 8 пациенток), более высокие цифры у пациенток с нормальным уровнем магния могут указывать на то, что в данном случае причиной патологического течения беременности может быть не дефицит магния, а наличие ДСТ. Угроза прерывания беременности в 1а подгруппе наблюдалась у 17 беременных (45,9%), в 1б подгруппе – у 9 (42,9%).
Во 2а подгруппе у пациенток на фоне дефицита магния частота самопроизвольного выкидыша в анамнезе была у 9 пациенток (16,9%), во 2б подгруппе – у 6 (13,6%). Угроза прерывания беременности наблюдалась у 18 беременных (34%) 2а подгруппы и у 4 (9,1%) во 2б подгруппе.
Анализируя полученные данные, мы отмечаем, что большее количество самопроизвольных абортов в анамнезе было у пациенток с ДСТ независимо от уровня магния в плазме крови по сравнению с пациентками контрольной группы. Угроза прерывания беременности чаще наблюдается у беременных с ДСТ и у пациенток без признаков ДСТ, но при наличии дефицита магния.
При сравнении пациенток без дефицита магния выяснилось, что определяющим в развитии данных патологических состояний является наличие ДСТ в большей степени, а при отсутствии ДСТ определяющим является дефицит магния.
В процессе проведения данной работы мы определяли такие показатели гемостаза, как активированное частичное тромбопластиновое время (АЧТВ), антитромбин 3, Д-димер, растворимые фибрин-мономерные комплексы (РФМК).
В ходе исследования мы наблюдали, что в течение беременности более значимые изменения уровня АЧТВ, а именно его укорочение, что указывает на тенденцию к гиперкоагуляции, наблюдаются у пациенток 2а подгруппы при отсутствии признаков ДСТ, но на фоне дефицита магния, даже в большей степени, чем у пациенток с нДСТ (р>0,05).
При измерении уровня антитромбина-3 также наблюдается его уменьшение, причем в большей степени у пациенток с ДСТ и на фоне дефицита магния. Что касается пациенток без ДСТ, но имеющих дефицит магния, у них изначально уровень антитромбина был ниже по сравнению с другими группами, поэтому само снижение показателя оказалось не столь значимо (р>0,05).
Известно, что во время беременности отмечается повышение уровня Д-димера, что, по мнению многих, не является определяющим в прогнозировании развития гиперкоагуляционного синдрома. Однако в данном исследовании мы решили проследить за особенностями его изменения у пациенток с нДСТ и без нее (табл. 1).
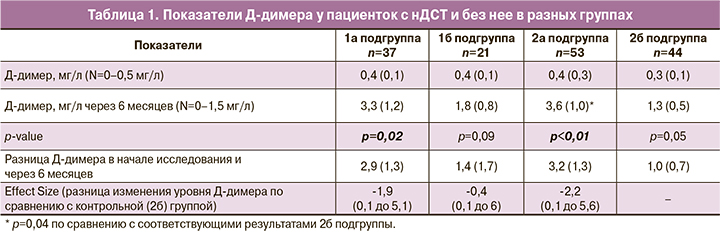
Обращает на себя внимание тот факт, что в течение беременности отмечается статистически значимое повышение уровня Д-димера у пациенток на фоне дефицита магния как при нДСТ, так и при отсутствии признаков ДСТ. При сравнении показателей между группами значимых отличий выявлено не было, за исключением статистически значимо высоких цифр Д-димера по сравнению с таковыми у пациентом 2б подгруппы.
Также мы определяли изменение уровня РФМК во время беременности у обследуемых пациенток. Значения уровней РФМК через 3 месяца исследования не имели статистически значимых изменений, поэтому в таблице не приведены (табл. 2).
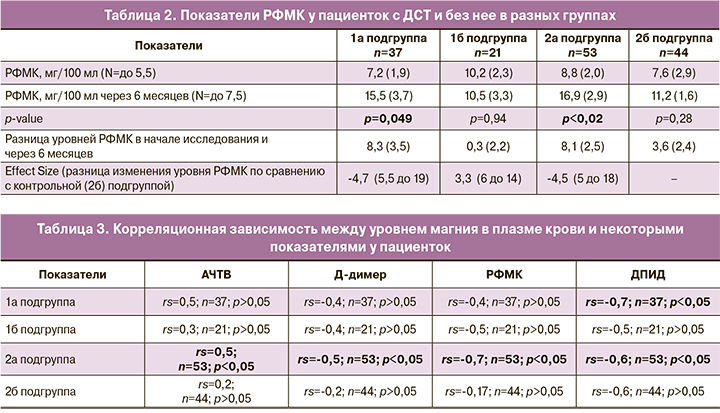
При анализе полученных результатов обращает на себя внимание, что изменения уровней РФМК у пациенток с дефицитом магния прогрессивно увеличиваются и через 6 месяцев достигают значений, которые статистически значимо выше по сравнению со значениями данной группы в начале исследования. У здоровых беременных также отмечается физиологическое увеличение уровня РФМК во время беременности. У пациенток с нДСТ с нормальным значением магния изначально показатели РФМК выше по сравнению со здоровыми беременными, но во время беременности значительного его повышения не отмечается. При сравнении уровней РФМК между группами значимых изменений выявлено не было.
Мы также контролировали изменения уровней магния у пациенток в течение беременности на фоне приема магниевой соли оротовой кислоты. Интересно отметить, что у пациенток при отсутствии дефицита магния даже на фоне приема препаратов отмечалось незначительное постепенное снижение уровня магния – у пациенток 1б подгруппы с нДСТ на 8,9% за 6 месяцев, а у пациенток 2б подгруппы всего на 3,3%. В отличие от описанных результатов у пациенток с дефицитом магния на фоне приема препарата отмечается незначительное повышение уровня магния в плазме крови, правда, нормативных показателей не достигает. У пациенток 1а подгруппы с нДСТ на фоне дефицита магния и приема препаратов за 6 месяцев показатель увеличивается на 6,7%, а во 2а подгруппе – на 12,5%, что указывает на то, что пациенткам с нДСТ необходим более длительный прием препаратов магния для восполнения его дефицита.
Далее мы проводили сравнительный анализ результатов, полученных при определении биохимических показателей распада коллагена у беременных с патологией соединительной ткани и без нее с разным уровнем магния в плазме крови.
Самый высокий уровень ДПИД в моче, что указывает на повышенный метаболизм коллагена, отмечается у пациенток с нДСТ, особенно на фоне дефицита магния. У здоровых пациенток во время беременности также отмечается его повышение, однако оно не выходит за рамки нормативных значений. У пациенток с нДСТ и у беременных без патологии соединительной ткани на фоне гипомагниемии отмечается повышенный уровень ДПИД в моче, который в течение беременности значительно увеличивается, что указывает на повышенный распад коллагена. У беременных с нДСТ и на фоне гипомагниемии отмечается повышение ДПИД на 33,3%, у беременных с нДСТ при нормальном уровне магния в плазме крови – на 26,7%, у пациенток без патологии соединительной ткани и на фоне сниженного уровня магния в плазме крови – на 19,1%. Интересно отметить, что у здоровых беременных уровень ДПИД в моче также повышается на 19%, но остается в пределах референсных значений.
При проведении сравнительного анализа уровней гликозаминогликанов оказалось, что исходные значения у пациенток с нДСТ и при ее отсутствии, но на фоне дефицита магния статистически значимо выше по сравнению с пациентками контрольной группы (2б подгруппа). Кроме того, такая же тенденция сохраняется через 3 и через 6 месяцев наблюдений.
Что касается еще одного показателя распада коллагена – фибронектина, который мы определяли в нашем исследовании, то значимых отличий мы не получили, поэтому данный биохимический маркер распада коллагена, по нашему мнению, не стоит рассматривать в качестве прогностического маркера развития возможных осложнений беременности.
В источниках литературы имеются данные о том, что дефицит магния увеличивает активность тромбоксана А2, что сопровождается повреждением сосудистой стенки. Нарушение соотношения уровней магния и кальция в сторону развития недостатка магния приводит к кальцификации сосудов даже при наличии дефицита кальция. Эти описанные изменения могут являться причиной избыточного тромбообразования. При беременности данное состояние может сопровождаться в том числе плацентарной недостаточностью [8, 17, 20, 21].
В ходе исследования мы проводили корреляционный анализ с целью статистического изучения связи между уровнем магния и показателями гемостаза и биохимическими маркерами распада коллагена.
Оказалось, что не было выявлено статистически значимой зависимости между уровнем магния в плазме крови и показателями гемостаза у пациенток 1-й группы с признаками нДСТ, значимая корреляция была выявлена между уровнями магния и ДПИД в моче у пациенток 1а подгруппы. У беременных 2а подгруппы на фоне дефицита магния была выявлена статистически значимая корреляция между уровнем магния в плазме крови и показателями гемостаза и ДПИД в моче. У здоровых беременных корреляционная связь практически отсутствует. Более значима корреляционная связь между уровнем магния и биохимическим показателем распада коллагена (ДПИД), однако данные незначимы (табл. 3).
Анализируя представленные данные, можно предположить, что магний может быть использован в качестве одного из маркеров в прогнозировании развития возможных осложнений во время беременности, особенно у пациенток с его дефицитом.
Для оценки гемодинамики в системе мать-плацента-плод мы, помимо традиционного ультразвукового исследования плода в установленные сроки, проводили допплерометрию в сроках 12–13, 24–25 и 36–37 недель. Было выявлено, что более высокие цифры индекса резистентности и пульсационного индекса в исследуемых сосудах отмечаются у пациенток с признаками нДСТ по сравнению с пациентками без патологии со стороны соединительной ткани. Однако данные оказались статистически значимыми только по отношению к маточным артериям в сроке беременности 36–37 недель.
Надо отметить, что выраженная плацентарная недостаточность, которая сопровождается нарушением гемодинамики в сосудах плода, в нашем исследовании была обнаружена только у пациенток 1а подгруппы – 4 (10,8%), что подтверждает вышеуказанное утверждение о частоте развития плацентарной недостаточности у пациенток с нДСТ, особенно на фоне дефицита магния. Данные изменения сопровождались нарушениями также и в маточных артериях, что в сочетании с результатами проведенного кардиотокографического исследования послужило причиной родоразрешения данных беременных в сроке 36–37 недель.
В группе пациенток с нДСТ по сравнению с пациентками без нее чаще отмечены несвоевременное излитие вод, аномалии родовой деятельности, преэклампсия, травмы шейки матки, влагалища и промежности в родах.
А при сравнении частоты развития осложнений у пациенток на фоне дефицита магния по сравнению со здоровыми пациентками была выделена большая частота преждевременных родов, несвоевременного излития вод, аномалий родовой деятельности.
У остальных пациенток роды произошли в сроке 37–40 недель беременности. Наибольшее количество оперативных родов было у пациенток с нДСТ. При сравнении количества оперативных родов у пациенток без нДСТ обращает на себя внимание то, что у пациенток с дефицитом магния они проводятся в 2 раза чаще по сравнению с контрольной группой.
Таким образом, в процессе исследования мы попытались выяснить зависимость развития осложнений беременности от наличия у пациентки признаков нДСТ, уровня магния в плазме крови, уровня биохимических маркеров распада коллагена, что может помочь в дальнейшем в разработке алгоритма обследования пациенток, планирующих беременность, и подборе адекватного лечения, которое поможет избежать развития осложнений.
Заключение
В ходе исследования оказалось, что сниженный уровень магния в плазме крови беременных значительно ухудшает прогнозы течения беременности и родов. Коррекция магниевого статуса во время беременности малоэффективна. У больных с нДСТ и у пациенток с отягощенным акушерским анамнезом необходимо определять уровень магния до беременности и своевременно проводить лечебно-профилактические мероприятия, включающие восполнение дефицита магния, а пациенткам с нДСТ – назначать препараты, направленные на улучшение метаболизма коллагена. Планировать беременность данной категории пациенток следует при достижении нормативных значений магния и нормализации уровня биохимических маркеров распада коллагена, что значительно может улучшить перинатальные исходы.
Таким образом, на основании оценки результатов стандартных и специальных методов обследования, включая определение уровней магния в крови, маркеров распада коллагена (ДПИД и гликозаминогликаны в моче, фибронектин в крови) представлены оптимальные методы диагностики и предупреждения развития осложнений у беременных с гипомагниемией в сочетании с ДСТ и без нее.



