Вагинальные симптомы, такие как неприятный запах, зуд и выделения являются наиболее распространенными жалобами, предъявляющими женщинами всех возрастных групп и особенно репродуктивного возраста. Ежегодно в США выделения из влагалища являются причиной более 10 миллионов визитов к врачам [1]. По оценкам исследователей доля патологических вагинальных выделений составляет до 38% в структуре женской обращаемости за медицинской помощью [2].
Как врачи, так и пациенты зачастую воспринимают вагинальные выделения как проявление инфекционного заболевания. Тем не менее, это наиболее распространенное клиническое заблуждение думать, что выделения из влагалища являются синонимом вагинальной инфекции. Это очевидно при проведении тщательного обследования вагинального отделяемого у женщин с выделениями. Так, при исследовании 400 женщин с этим симптомом инфекционный агент выявляли лишь у 51,75% пациенток [3]. Важную роль в возникновении вагинальных выделений играют ИППП. Тем не менее, их распространенность среди всех случаев заболеваний незначительна. В данном обзоре речь идет о ведении пациенток с патологическими вагинальными выделениями, не связанными с ИППП.
Вагинальная микробиота и ее роль в возникновении вагинальных выделений
Поверхность слизистой оболочки влагалища представляет иммунологический и физический барьер. Вагинальный барьер состоит из гликозилированных белков и иммуноглобулинов. Гликозилированные белки (сиалогликопротеины), такие как муцин, в виде плотной смазки обеспечивают физический барьер, который ограждает эпителиальные клетки от патогенов [4].
Иммунологический барьер обеспечивают иммуноглобулины IgG и секреторный sIgA, которые распознают и нейтрализуют антигенные микробные продукты. В то же время Gardnerella vaginalis секретирует сиалидазу, которая разрушает слизь, путем расщепления ее гликопротеинов. При этом образуется сиаловая кислота, которая затем поглощается G. vaginalis [5].
Деградация и истощение компонентов защитного барьера слизистой оболочки делает возможной восходящую инфекцию верхних половых путей. Кроме того, Lactobacillus iners и G. vaginalis продуцируют холестерол-зависимый лизин-вагинолизин, который образует поры во влагалищном эпителии, что дополнительно разрушает защитный барьер. Напротив, защитная функция слизистого слоя усиливается микробиотой с преобладанием Lactobacillus crispatus, что препятствует проникновению ИППП, тогда как микробиота с преобладанием L. iners способствует инфицированию ИППП. Таким образом, изменения в составе микробного сообщества влагалища значительно влияют на целостность защитного поверхностного слоя слизистой оболочки [6].
Вагинальная микробиота представляет собой динамичное сообщество разнообразных видов бактерий, которые подвергаются как внутренним, так и внешним воздействиям: колебаниям уровней половых гормонов, стадиям менструального цикла, сексуальной активности, антибиотикотерапии, использованию оральных контрацептивов и вагинального спринцевания, менопауза, беременность, лактация, сахарный диабет и стресс. На состав вагинальной микробиоты оказывают влияние генетические и эпигенетические факторы [7].
Ряд защитных видов Lactobacillus доминируют в здоровой вагинальной микробиоте у большинства женщин репродуктивного возраста [8]. Недавние достижения в области секвенирования ДНК показали, что доминирующие виды Lactobacillus здоровой вагинальной микробиты включают L. crispatus, L. iners, Lactobacillus gasseri, и Lactobacillus jensenii, тогда как такие анаэробы как Gardnerella, Atopobium, Mobiluncus, Prevotella, Streptococcus, Ureaplasma, Megasphaera и др. вызывают бактериальный вагиноз (БВ), патогенез которого во многом обусловлен бездействием защитных лактобактерий. Данные полученные в результате секвенирования позволили выделить пять типов микрофлоры влагалища (ТМВ): I, II, III и V типы, в которых доминируют L. crispatus, L. gasseri, L. iners и L. jensenii соответственно, в то время как в ТМВ IV доминируют анаэробы, подобные тем, которые были найдены при БВ [9–11]. Распространенность этих микроорганизмов в вагинальной микробиоте варьирует в разных этнических группах и континентах.
В отличие от кишечника, разнообразие вагинальной микробиоты связано с повышенным риском дисбиотических состояний и воспалительных заболеваний гениталий, которые могут оказать негативное влияние на репродуктивную функцию [12].
Слизистая оболочка влагалища содержит иммунные клетки, такие как нейтрофилы, макрофаги, Т и В лимфоциты. Эти иммунные клетки на своей поверхности имеют специализированные рецепторы: толл-подобные рецепторы и nod-подобные рецепторы, с помощью которых они распознают патогенные виды микроорганизмов [13]. Микробный липополисахарид стимулирует толл-подобные рецепторы, запускает высвобождение цитокинов и хемокинов, таких как IL-1β, IL-6, IL-8 и фактор некроза опухолей-α. Это высвобождение активируется и регулируется с помощью сигнального пути: ядерный фактор-κB-митоген-активированная протеинкиназа. Другие иммунные факторы, такие как макрофаги, нормальные киллеры, хелперные и цитотоксические Т- и B-лимфоциты, впоследствии также включаются в иммунный ответ. Такие воспалительные реакции, индуцированные возбудителем, обычно сдерживают инфекцию, но в некоторых случаях могут нарушать поверхность слизистой оболочки и способствовать передаче некоторых инфекций, в том числе ИППП. Следовательно, вагинальные сообщества, в которых доминируют анаэробы, потенциально связаны с большей провоспалительной реакцией, чем L. crispatus, L. gasseri или L. jensenii. Однако Lactobacilli spp. и молочная кислота через многочисленные механизмы способствуют противомикробной защите без запуска иммунно-опосредованного воспаления, в отличие от патогенных анаэробов [14, 15].
Наиболее частыми причинами вагинальных выделений не связанными с ИППП являются бактериальный вагиноз, аэробный вагинит и кандидозный вульвовагинит.
Бактериальный вагиноз
Наиболее распространенным видом вагинального дисбиоза у женщин репродуктивного возраста является бактериальный вагиноз (БВ). БВ распространен у 29–70% женской популяции, характеризуется истощением лактобактерий и избыточным ростом анаэробов, таких как Gardnerella, Atopobium, Mobiluncus, Prevotella, Streptococcus, Mycoplasma, Ureaplasma, Dialister, Bacteroides и т. д. [16]. Они создают гетерогенную влагалищную среду со сниженным уровнем молочной кислоты, рН> 4,5 и большим количеством короткоцепочечных жирных кислот, таких как ацетат, бутират, пропионат и сукцинат. При этом явный воспалительный ответ не проявляется, содержание лейкоцитов остается в пределах нормы. Тем не менее наблюдается увеличение уровня иммунных медиаторов, таких как IL-1β, IL-2, IL-6, IL-8, IL-10, TNF-α, интерферон -γ и т.д. Также происходит снижение концентрации антимикробного пептида липокалина, ассоциированного с нейтрофильной желатиназой [17].
Симптомы БВ могут проявляться в виде необильных, но раздражающих, сливкообразных влагалищных выделений с рыбным запахом, которые могут быть более заметными после полового акта и во время менструации.
Для диагностики БВ в клинических случаях используются критерии Amsel. Они включают в себя оценку вагинального рН, наличие выделения из влагалища, появление «ключевых» клеток (десквамативные эпителиальные клетки влагалища, усеянные анаэробными бактериями) и положительный тест с 10% калия гидроксидом. При этом возникает характерный «рыбный» запах, воспринимаемый, когда химикат добавляется к капле вагинального отделяемого. Наиболее чувствительными критериями являются вагинальный рН> 4,5 и наличие гомогенных, сливкообразных выделений (97%) [18]. Однако обнаружение выделений с другими характеристиками имеет низкую специфичность (26%) и положительное прогностическое значение (27%), а критерий с наивысшей специфичностью – наличие «ключевых» клеток (86%). Наличие по меньшей мере трех критериев значительно увеличивает вероятность проведения точной диагностики БВ, что позволяет достичь чувствительности 97% и специфичности 90% [19].
В исследовательском пространстве БВ обычно диагностируют с помощью системы оценки Nugent. Хотя диагноз требует, чтобы микроскопию проводил опытный врач клинической лабораторной диагностики, он более объективен и надежен и имеет более высокую чувствительность и специфичность по сравнению с критериями Amsel. Для оценки Nugent используют окраску по Граму для определения сдвига влагалищной микробиоты от здорового доминирования лактобацилл (грамположительные палочки) до промежуточного уровня грамотрицательной микробиоты (Gardnerella и Bacteroides), отсутствия лактобацилл и преобладания грам-отрицательных/вариабельных палочек или изогнутых бацилл (Mobiluncus). Оценка 0–3 соответствует вагинальному здоровью с преобладанием лактобацилл оценка 4–6 указывает на промежуточное, смешанное вагинальное бактериальное сообщество, тогда как >7 указывает на БВ.
БВ связан с повышенным риском заражения ИППП, вызванными Neisseria gonorrhoeae, Chlamydia trachomatis, Trichomonas vaginalis, ВПГ-1,2, ВПЧ, ВИЧ, Treponema pallidum. БВ ассоциирован с более высокой частотой воспалительных заболеваний органов малого таза и хориоамнионитом. Во время беременности БВ приводит к преждевременному разрыву околоплодных оболочек и преждевременным родам. Бактериальный вагиноз – рецидивирующее заболевание, что может быть обусловлено нахождением анаэробных микроорганизмов в составе бактериальных биофильмов и, как следствие, неудовлетворительными результатами лечения [20].
Аэробный вагинит (АВ)
Это состояние схоже по степени разрушения нормальной вагинальной микробиоты с БВ. Здесь могут преобладать лактобациллы, но при этом имеются явные признаки воспаления и пролиферации кишечных аэробных бактерий, таких как Escherichia coli, Enterocoсci, Staphylococcus aureus и Streptococcus group B. АВ был описан как аэробный эквивалент БВ, который возникает из-за снижения концентрации молочной кислоты, вторичного по отношению недостатку Lactobacillus. Однако, поскольку анаэробы отсутствуют, концентрация сукцината и других короткоцепочечных жирных кислот низка. Клинические особенности АВ включают: воспаление слизистой оболочки влагалища с желтоватыми липкими выделениями без рыбного запаха, вагинальный рН> 6, а также зуд, жжение и диспареунию. Частота АВ достигает 25% среди женщин репродуктивного возраста и ассоциируется с тяжелыми неблагоприятными гинекологическими и акушерскими исходами, включая восходящую инфекцию, преждевременный разрыв околоплодных оболочек и преждевременные роды [21].
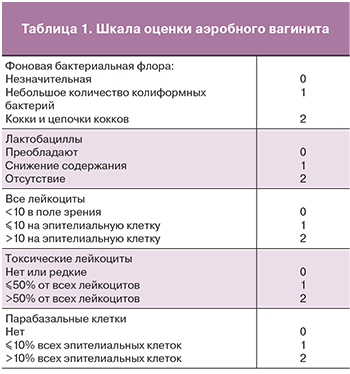 Методами диагностики АВ являются микроскопия и бактериологическое исследование вагинального отделяемого. За рубежом для диагностики АВ применяют Шкалу оценки аэробного вагинита, которая включает информацию о бактериальной флоре, типе эпителия и лейкоцитов с количественным индексом от 0 до 10 (табл. 1).
Методами диагностики АВ являются микроскопия и бактериологическое исследование вагинального отделяемого. За рубежом для диагностики АВ применяют Шкалу оценки аэробного вагинита, которая включает информацию о бактериальной флоре, типе эпителия и лейкоцитов с количественным индексом от 0 до 10 (табл. 1).
При этом индекс от 0 до 2 свидетельствует об отсутствие АВ, 3–4 – о наличии АВ легкой степени, 5–6 умеренном АВ, 7–10 – тяжелом АВ [22, 23].
Видовая идентификация этиологически значимых микроорганизмов, а также их количественная оценка возможны с помощью бактериологического исследования с определением чувствительности к антимикробным препаратам.
Кандидозный вульвовагнит (КВВ) является второй по распространенности причиной вагинальных выделений после БВ. По оценкам, приблизительно 75% женщин репродуктивного возраста в жизни имеют по крайней мере один эпизод этой инфекции. Около 90% инфекций вызваны видами Candida albicans, а остальные – non-albicans видами, главным образом C. glabrata, и нередко C. krusei, C. tropicalis, C. parapsilosis, C. pseudotropicalis [24]. У 40–50% женщин с первым эпизодом КВВ наблюдаются рецидивы. Около 5% женщин страдают от постоянных рецидивов.
Предрасполагающие факторы: антибиотики, беременность, оральные контрацептивы, диабет, высокое потребление глюкозы в диете, рискованное сексуальное поведение, плотное синтетическое белье и ВИЧ-инфекция. Также возможна генетическая предрасположенность.
Клиническая картина обычно включает вагинальный и вульварный зуд, боли в вульве, терминальная дизурия и выделения из влагалища от творожистых до водянистых. Запах, как правило, отсутствует. Ни один из симптомов не является патогномоничным для КВВ, поэтому диагноз, основанный только на клинических результатах, является ненадежным. Специалисты, использующие эмпирический подход к лечению этого заболевания, зачастую выписывают антимикотические препараты в тех случаях, где нет КВВ [25].
Клиническая картина варьирует от экссудативного синдрома с обильными выделениями и тяжелой эритемой с белыми бляшками на стенках влагалища, до минимальных выделений.
Отсутствие специфичных симптомов и признаков КВВ исключает верификацию диагноза, основанную только на клинической картине. С другой стороны, получение роста Candida spp. может отражать колонизацию влагалища и не используется в качестве единственного критерия диагноза. Большинство пациентов с симптоматическим вагинитом могут быть диагностированы с помощью микроскопического исследования вагинального отделяемого с окраской метиленовым синим, по Граму или нативного материала [24]. Наличие ветвистоподобных псевдогифов или почкообразных дрожжей является диагностическим признаком. Кислотность вагинального отделяемого обычно нормальная (рН <4,5). В типичных случаях культуральное исследование не требуется, но может выполняться при наличии отрицательной микроскопии у пациенток с патологическими вагинальными выделениями [23]. Однако, в связи с появлением Candida non- albicans штаммов устойчивых к флуконазолу, рекомендовано проведение культурального исследования с определением чувствительности к антимикотическим препаратам [24].
Помимо вышеперечисленных заболеваний вагинальные выделения наблюдаются при трихомониазе и других ИППП (C.trachomatis, N.gonorrhoeae, M.genitalium, T.vaginalis, ВПГ-1,2). При этом методы амплификации нуклеиновых кислот являются наиболее чувствительными в их детекции [26].
В более редких случаях причинами выделений из влагалища являются атрофический вагинит, опухоли генитальной сферы, наличие инородных тел, ятрогенные факторы, кожные заболевания и психосоматические заболевания.
Ведение пациентов с патологическими вагинальными выделениями
Женщины по-разному понимают причины своих выделений, что влияет на их выбор медицинской помощи. Так, зачастую женщина предпринимает самостоятельное лечение безрецептурными препаратами без консультации с врачом. Такая «терапия» часто приводит к неудачному результату, так как в большинстве случаев используют противогрибковые препараты там, где имеется более серьезное заболевание, хотя и со схожими симптомами. Визит к специалисту как правило запоздалый из-за страха или смущения симптомами со стороны интимной сферы.
Согласно Европейским рекомендациям по лечению вагинальных выделений 2018 г при выявлении бактериального вагиноза назначают [23]:
Клиндамицин вагинальный крем 2% 1 раз в день на протяжении 7 дней;
Метронидазол вагинальный гель 0,75% 1 раз в день на протяжении 5 дней
В отличие от метронидазола клиндамицин имеет более широкий спектр активности.
Систематический обзор зарубежных исследований, сравнивающих клиндамицин и метронидазол, показал, что они имеют равную эффективность, будь то пероральные или влагалищные препараты, как через одну неделю (отношение шансов (ОШ) 1,01, 95% доверительных интервал (ДИ) от 0,69 до 1,46), так и через один месяц (ОШ 0,91, 95% ДИ 0,70 до 1,18). Примерно, от 58 до 88% пациенток будут излечены после 5-дневного лечения клиндамицином или метронидазолом. Однако с точки зрения побочных эффектов в большинстве исследований клиндамицин показал профиль безопасности лучше, чем метронидазол (ОШ 0,75, 95% ДИ от 0,56 до 1,02) [27]. Клиндамицин также показал свою эффективность и в российских исследованиях [28]
По мнению авторов Европейских рекомендаций по лечению вагинальных выделений 2018 г, наиболее оптимальной схемой для лечения аэробного вагинита является:
Клиндамицин вагинальный крем 2% 1 раз в день на протяжении 7–21 дней [22, 23].
Клиндамицин – полусинтетический антибиотик группы линкозамидов, аналог линкомицина, практически вытеснивший его в большинстве стран благодаря улучшенному фармакологическому профилю. Обладает широким спектром антимикробной активности: эффективен против анаэробов и грамположительных кокков, а также умеренно активен в отношении протозойных инфекций. По мнению авторов клинических рекомендаций клиндамицин является наиболее эффективным препаратом для лечения аэробного вагинита (сила рекомендации: степень 2, качество данных С)
Для лечения кандидозного вульвовагинита наиболее часто применяют препараты азолового ряда. Группа европейский экспертов свидетельствует, что в настоящее время наилучшим способом лечения неосложненного КВВ, вызванного Candida albicans у женщин является однократная пероральная или вагинальная доза азоловых препаратов (сила рекомендации: степень 1, качество доказательств А).
Ведение пациентов с вагинальными выделениями не требует обязательного привлечения сексуального партнера. Однако известно, что у мужчин–половых партнеров женщин с БВ, АВ и КВВ значительно чаще выявляют негонококковый уретрит и баланопостит [29]. Исходя из этого представляется необходимым как минимум клиническая оценка состояния сексуального партнера женщины с вагинальными выделениями.
Создание наиболее удобных форм лекарственных препаратов для повышения комплаентности терапии коснулось и заболеваний, проявляющихся патологическими вагинальными выделениями, для лечения которых разработан комбинированный препарат «Клиндацин Б пролонг» для местного применения с содержанием бутоконазола и клиндамицина. Бутоконазол – производное имидазола, обладает фунгицидной активностью в отношении грибов родов Candida, Trichophyton, Microsporum, Epidermophyton и некоторых грамположительных бактерий. Наиболее эффективен при кандидозах, включая кандидозный вульвовагинит. Блокируя в клеточной мембране образование эргостерола из ланостерола, увеличивает проницаемость мембраны, что приводит к лизису клетки гриба.
Клиндамицин – бактериостатический антибиотик из группы линкозамидов, обладает широким спектром действия, связывается с 50S субъединицей рибосомальной мембраны и подавляет синтез белка в микробной клетке. В отношении ряда грамположительных кокков возможно бактерицидное действие. Активен в отношении Staphylococcus spp., Streptococcus spp., Corinebacterium spp, Mycoplasma spp., анаэробных и микроаэрофильных грамположительных кокков (включая Peptococcus spp. и Peptostreptococcus spp.), Clostridium perfringens, Clostridium tetani, Bacteroides spp. (включая Bacteroides fragilis и Prevotella melaninogenica), Fusobacterium spp., Propionibacterium spp. и Actinomyces israelii.
Активные вещества, содержащиеся в препарате лишь в небольшой степени всасываются в кровь: 1,7% дозы бутоконазола и 4% клиндамицина. Важным свойством вагинального крема является его способность сохраняться в гелеобразном состоянии, для обеспечения длительного контакта активных действующий веществ с поверхностью слизистой оболочки. Гидрофильная кремовая основа обеспечивает препарату гелеобразную консистенцию при температуре 35–40°С. При интравагинальном применении крем не плавится, в связи с чем активные вещества находятся на слизистой оболочке влагалища в течение 1–3 дней.
«Клиндацин Б пролонг» для удобства применения снабжен вагинальным аппликатором, который позволяет вводить 5 г крема (100 мг бутоконазола и 100 мг клиндамицина) глубоко во влагалище. Благодаря инновационной формуле гидрофильной кремовой основы активные вещества крема находятся на поверхности слизистой оболочки в течение 1–3 дней, что позволяет применять препарат в неосложненных случаях на протяжение 3 дней.
Заключение
Вагинальные выделения – широко распространенный симптом в женской популяции, значительно влияющий на качество жизни. Последние исследования вагинальной микробиоты с использованием молекулярно-генетических методов определили значение различных видов лактобацилл и транзиторной микрофлоры в повреждении здорового вагинального барьера и возникновении воспалительных и дисбиотических заболеваний влагалища, с последующими социально-значимыми осложнениями в виде воспалительных заболеваний органов малого таза, перинатальной патологией и бесплодием.
Оптимальные схемы терапии согласно с Европейскими рекомендациями по лечению вагинальных выделений 2018 г включают местное применение клиндамицина и азолов. Таким требованиям отвечает усовершенствованная формула препарата «Клиндацин Б пролонг», который может с успехом применяться при подавляющем большинстве заболеваний, проявляющихся вагинальными выделениями.



