Эмболизация маточных артерий (ЭМА) в качестве лечения миомы матки применяется в клинической практике уже два десятилетия [1, 2]. После сообщения об успешной серии J.H. Ravina и соавт. в 1995 г. [3] к 2009 г. во всем мире было выполнено более 50 тыс. процедур [4]. В настоящее время ЭМА выступает в роли эффективной альтернативы гистерэктомии и миомэктомии [1, 5, 6].
Безусловно, как и любая инвазивная техника, ЭМА имеет свои осложнения, которые достаточно разнообразны и делятся на легкие и тяжелые.
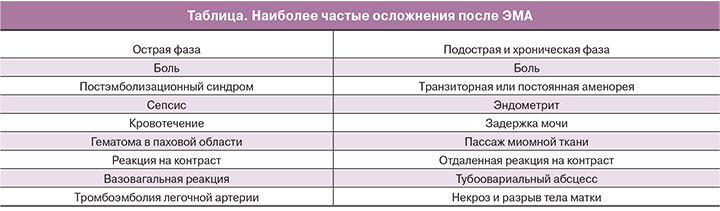
В общем, тяжелые осложнения наблюдаются примерно у 3,5–4% больных, а легкие – у 13,2–23% [7, 8]. Различают осложнения острой фазы (24 ч после ЭМА), подострой (>24 ч до недели) и хронической (более 1 недели) (таблица) [9].
 Осложнения, развившиеся в острую фазу, как правило, связаны с сосудистым доступом процедуры, тромбоэмболическими и инфекционными осложнениями [7]. Могут отмечаться, в частности, расслоение артерии, псевдоаневризма, эмболизация артерий нижних конечностей, гематома на месте пунктирования, аллергические реакции на контраст, контраст-идуцированная нефропатия, повреждение периферического нерва и др. [7].
Осложнения, развившиеся в острую фазу, как правило, связаны с сосудистым доступом процедуры, тромбоэмболическими и инфекционными осложнениями [7]. Могут отмечаться, в частности, расслоение артерии, псевдоаневризма, эмболизация артерий нижних конечностей, гематома на месте пунктирования, аллергические реакции на контраст, контраст-идуцированная нефропатия, повреждение периферического нерва и др. [7].
Потенциально фатальным осложнением ЭМА является тромбоэмболия легочной артерии (ТЭЛА), развитие которой связывают с транзиторным изменением коагулирующей системы крови, возникающим при этом вмешательстве [9, 10]. Кроме того, тромбообразованию с последующей эмболизацией предрасполагают такие факторы, как сдавление крупными миомами близлежащих вен, длительное нахождение в госпиталях и индивидуальные особенности пациенток [7].
Частота ТЭЛА при ЭМА оценивается как 1 случай на 200–400 процедур [11, 12]. По данным крупного мета-анализа (8159 процедур ЭМА) [13], частота развития тромбоза глубоких вен у больных, подвергшихся этой процедуре, составила 0,2%, а ТЭЛА – 0,4% (1 случай на 250 и 500 операций соответственно).
Мы также наблюдали ТЭЛА, развившуюся после проведенной ЭМА.
Описание клинического наблюдения
Больная Б., 36 лет, поступила в гинекологическое отделение Института неотложной и восстановительной хирургии им. В.К. Гусака 14.04.2016 с диагнозом: «Симптомная фибромиома матки» с целью проведения ЭМА. Жалобы при поступлении на тянущие боли внизу живота, обильные менструации, слабость, учащенное мочеиспускание. Фибромиома выявлена при профосмотре в апреле 2015 г. Ранее в феврале 2015 г. оперирована по поводу фиброаденомы правой молочной железы.
Каких-либо отклонений от нормы со стороны органов дыхания, кровообращения и пищеварения при объективном осмотре нет. Пульс ритмичен, удовлетворительных пальпаторных свойств, 78 в мин. Артериальное давление (АД) – 110/70 мм рт. ст.
Гинекологический статус: наружные половые органы развиты правильно по женскому типу. Шейка матки с ovuli nabotii, выделения слизистые, матка в антефлексио, увеличена до 6–7 недель за счет миометрия и субсерозного фиброматозного узла до 3,5 см по правой боковой стенке, чувствительная при пальпации и смещении. Придатки с обеих сторон без особенностей.
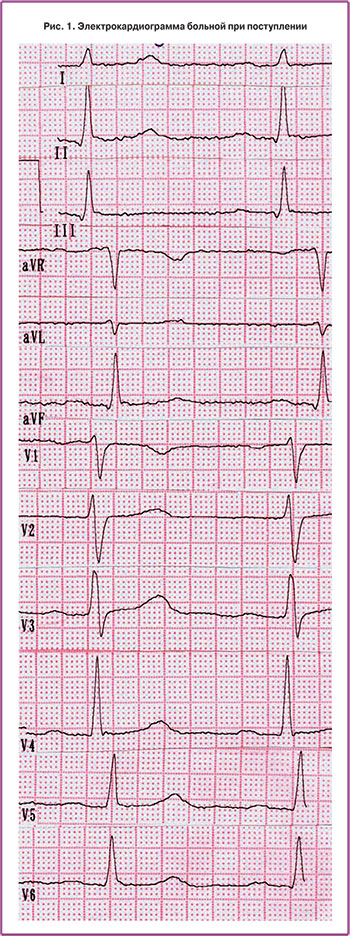
Данные обследования: В анализах крови и мочи – без патологии. На электрокардиограмме (ЭКГ) – синусовый ритм с частотой 80 сокр./мин, вариант нормы (рис. 1).
При ультразвуковом исследовании органов малого таза выявлен фиброматозный узел по правой боковой стенке матки до 3,5 см.
14.04.16 (в 1210-1410) пациентке была выполнена ЭМА. В ходе операции под местной анестезией правым трансфеморальным доступом проведена катетеризация левой внутренней подвздошной артерии катетером RUC 5F, суперселективно – левой маточной артерии. Через катетер под ангиографическим контролем в сосуд порционно введены эмболы (полиуретан) диаметром 400–750 µк до прекращения кровотока в ветвях маточной артерии. Эмболизация правой маточной артерии проведена по этой же методике. На контрольной ангиографии отмечалось отсутствие кровотока по ветвям обеих маточных артерий, результат вмешательства признан удовлетворительным, пациентка переведена в общую палату.
В послеоперационном периоде она отмечала тянущие боли внизу живота, общую слабость. 15.04.16 в 1345 при попытке встать с кровати ее состояние резко ухудшилось – появились удушье, боль за грудиной и головокружение. Отмечался цианоз лица, поверхностное дыхание – 33 дых./мин, АД снизилось до 80/60 мм рт. ст., пульс стал нитевидным, 98 в мин. Больная была транспортирована в палату интенсивной терапии гинекологического отделения, куда была вызвана реанимационная бригада. В 1405 пациентка потеряла сознание. При этом отмечался выраженный цианоз лица и воротниковой зоны, пульс и АД не определялись, а на кардиомониторе ЭКГ регистрировалась асистолия.
Предприняты реанимационные мероприятия: непрямой массаж сердца, искусственная аппаратная вентиляция легких (ИВЛ) через эндотрахеальную трубку в режиме принудительной вентиляции с контролем по давлению, внутривенно с интервалами введен адреналин 0,1%-1,0 №2 и атропин 0,1%-1,0 №2. Сердечная деятельность с частотой 138 сокр./мин восстановилась в 1408. В 1410 вновь наступила асистолия. Был продолжен непрямой массаж сердца, внутривенно интервально введен адреналин 0,1%-1,0 №3, атропин 0,1%-1,0 №2, дексаметазон 8 мг и капельно – сода-буфер (400 мл). Сердечная деятельность снова восстановлена в 1415. В 1420 на фоне инфузии дофамина (200 мг) начало определяться АД (75/45 мм рт. ст.), повторно введен дексаметазон 8 мг. В 1425 АД стабилизировалось на уровне 110/45–125/65 мм рт. ст. Несмотря на ИВЛ 100% кислородом, сохранялся цианоз кожи лица и воротниковой зоны.
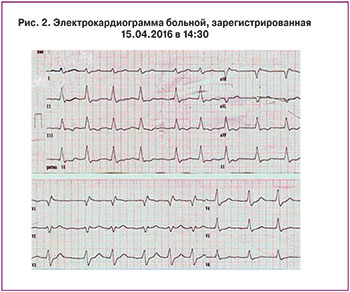 В 1429 пациентка осмотрена кардиологом. На записанной ЭКГ в 1430 (рис. 2) отмечена фибрилляция предсердий с тахисистолией желудочков (130–158 сокр./мин), полная блокада правой ножки пучка Гиса. Выполнено эхокардиографическое (ЭхоКГ) исследование, при котором выявлены признаки перегрузки правого желудочка давлением и высокая легочная гипертензия (давление в легочной артерии 70 мм рт. ст.).
В 1429 пациентка осмотрена кардиологом. На записанной ЭКГ в 1430 (рис. 2) отмечена фибрилляция предсердий с тахисистолией желудочков (130–158 сокр./мин), полная блокада правой ножки пучка Гиса. Выполнено эхокардиографическое (ЭхоКГ) исследование, при котором выявлены признаки перегрузки правого желудочка давлением и высокая легочная гипертензия (давление в легочной артерии 70 мм рт. ст.).
Выставлен диагноз острой массивной ТЭЛА высокого риска, что стало основанием для неотложного проведения системной тромболитической терапии [14].
В 1430 начато проведение системного внутривенного тромболизиса препаратом урокиназа по следующей схеме: 1. Начальная доза (4400 МЕ×вес 70 кг) – 308000 МЕ за 10 мин; 2. Поддерживающая доза (4400 МЕ×вес 70 кг/ч) – 308000 МЕ/ч в течение 12 ч (общая доза 3696000 МЕ). Больная была транспортирована в кардиореанимационное отделение института, где была продолжена тромболитическая терапия урокиназой. Помимо этого, по показаниям ей вводился дофамин, фуросемид, гидрокарбонат натрия, маннит, L-лизин эсцинат, актовегин, глиатилин, дексаметазон, нитроглицерин, эзомепразол, метоклопрамид, а после завершения введения урокиназы – гепарин посредством внутривенной инфузии под контролем активированного частичного тромбопластинового времени.
На контрольной ЭхоКГ, выполненной 16.04.15 в 1500: правые отделы сердца не расширены, сократимость миокарда в норме, давление в легочной артерии 30 мм рт. ст. На ЭКГ 16.04.16 1600 – синусовый ритм с частотой 100 сокр./мин, блокада правой ножки пучка Гиса отсутствует (рис. 3).
 После введения нефракционированного гепарина пациентка была переведена на низкомолекулярный гепарин (эноксапарин натрия), а затем – на прямой ингибитор фактора Ха (ривароксабан). В течение недели у больной сохранялись симптомы постгипоксической энцефалопатии, которые в последующем исчезли. При ультразвуковом исследовании вен нижних конечностей и околоматочного пространства признаков тромбоза не выявлено.
После введения нефракционированного гепарина пациентка была переведена на низкомолекулярный гепарин (эноксапарин натрия), а затем – на прямой ингибитор фактора Ха (ривароксабан). В течение недели у больной сохранялись симптомы постгипоксической энцефалопатии, которые в последующем исчезли. При ультразвуковом исследовании вен нижних конечностей и околоматочного пространства признаков тромбоза не выявлено.
Заключение
Таким образом, ТЭЛА является нередким и весьма грозным осложнением ЭМА. Для его предупреждения перед выполнением процедуры пациентки должны быть тщательно обследованы на предмет наличия скрытого тромбоза (вены нижних конечностей, малого таза, полости сердца), при его наличии показано проведение соответствующих лечебных мероприятий [4]. Ю.Э. Доброхотова и др. (2009) полагают обоснованным проведение профилактических мероприятий в зависимости от выявленной степени риска развития венозных тромбоэмболических осложнений больным, перенесшим ЭМА [6]. Комплекс мер профилактики при низкой степени риска включает раннюю активацию больных и эластическую компрессию нижних конечностей, при умеренной степени риска рекомендуется назначение антиагрегантов или даже низкомолекулярных гепаринов спустя 8 часов после ЭМА в течение недели [6].
Учитывая, что ТЭЛА относится к ранним осложнениям ЭМА, такие пациентки должны в течение хотя бы первых суток после вмешательства пребывать в условиях реанимационного отделения при постоянном кардиореспираторном мониторинге [15].



