Актуальность
Проблема невынашивания беременности, имеющая не только медицинское, но и социальное значение, остается одной из наиболее актуальных в современном акушерстве [1].
Пациентки с привычным выкидышем ранних сроков составляют группу высокого риска по реализации осложнений во II и III триместрах беременности. Так, в мета-анализе, обобщившем данные за 28 лет было показано, что у женщин с 2 и более потерями предшествующих беременностей достоверно выше процент развития плацентарной недостаточности, задержки роста плода, очень ранних преждевременных родов, отслойки плаценты, излития околоплодных вод при недоношенной беременности [2, 3]. Вероятно, в основе большинства данных осложнений лежат нарушения процессов имплантации, инвазии трофобласта, роста и развития структур плодного яйца с последующей реализацией нарушений функции плаценты. Вышеперечисленные процессы в течение долгого временного промежутка протекают бессимптомно, в связи с чем, оценка адекватности инвазии и прогнозирования успешной плацентации продолжают интересовать исследователей и клиницистов.
Уровни свободной эмбриональной ДНК (сэ-ДНК) в периферической крови беременной женщины могут являться показателем, отражающим интенсивность апоптоза в развивающейся плаценте [4]. В этой связи открывается возможность изучения и прогнозирования плацента ассоциированных осложнений по уровням сэ-ДНК в периферической крови женщин во время беременности.
Клиническое использование количественного измерения сэ-ДНК в настоящее время активно развивается. Еще в 1999 году было обнаружено почти 5-кратное повышение сэ-ДНК плода в кровотоке матери при преэклампсии по сравнению с группой женщин с нормально протекающей беременностью [5]. Было установлено, что при преэклампсии происходит выброс в материнский кровоток клеток синцитиотрофобласта, микрочастиц, ДНК и РНК молекул. Анализ данного материала может расширить понимание вклада плацентарных факторов в этиологию преэклампсии. При дальнейшем изучении этой патологии выявлен не только рост уровней сэ-ДНК, но и значительное повышение общего уровня ДНК матери, причем увеличение обоих показателей соответствовало степени тяжести преэклампсии [6–9]. Кроме того, было показано, что концентрация сэ-ДНК возрастает задолго до появления первых клинических симптомов. Так как ДНК плазмы является маркером клеточной гибели, повышенный уровень сэ-ДНК может быть результатом некроза и апоптоза клеток плаценты. Кроме преэклампсии, были описаны и другие акушерские осложнения, при которых имеет место повышение уровня сэ-ДНК: преждевременные роды, тяжелая рвота беременных, плотное прикрепление плаценты или ее врастание, задержка роста плода, внутриматочные гематомы, многоводие, плацентарная недостаточность [10, 11].
Связь повышенных уровней сэ-ДНК с развитием плацентарной недостаточности была продемонстрирована в нескольких исследованиях. Однако, в большинстве публикаций проанализированы уже диагностированные случаи плацентарной недостаточности, в то время как именно проспективное исследование и возможность прогнозирования осложнений представляет научный и практический интерес.
Описание клинического наблюдения
Приводим собственное клиническое наблюдение ведения беременности и родоразрешения женщины с привычным выкидышем и тяжелой плацентарной недостаточностью. В течение всей беременности до 22 недель каждые 2 недели, далее ежемесячно проводилось измерение уровней сэ-ДНК и сопоставление с данными в группе женщин с привычным выкидышем и с неосложненной беременностью.
Пациентка М-ва, 32 года, обратилась в НЦАГиП в связи с привычным выкидышем вне беременности. В анамнезе – 2 ранние самопроизвольные потери беременности в сроках 7–8, 9–10 недель. В обоих случаях проводилось кариотипирование тканей абортусов – без патологии.
При обследовании супружеской пары:
- кариотип супругов 46,ХХ, 46ХY;
- гормональных нарушений не выявлено, менструальный цикл пациентки регулярный с менархе;
- анатомических факторов привычного выкидыша не отмечалось;
- при обследовании на антифосфолипидный синдром: проба на волчаночный антикоагулянт отрицательная, антитела к кардиолипину, бета 2-гликопротеину, аннексину, протромбину в пределах низких, нормативных значений;
- совместимости супругов по системе HLA I и II классов не отмечено тромбофилий высокого риска не выявлено.
В связи с наличием клинических и ультразвуковых признаков хронического эндометрита, наличия хламидийной инфекции в анамнезе, проведена противовоспалительная терапия совместно с супругом вне беременности [12].
После лечения по данным ультразвукового исследования (УЗИ) – адекватный рост и секреторная трансформация эндометрия во второй фазе менструального цикла.
Пациентке рекомендована витаминотерапия, гестагенная поддержка со второй фазы предполагаемого фертильного цикла и даны рекомендации о планировании беременности.
При наступлении беременности определение сэ-ДНК, независимо от пола плода, проводилось методом полимеразной цепной реакции (ПЦР) в режиме реального времени. В качестве «мишени» выбирались участки генома, содержащие делеционные полиморфизмы, что позволяло отличить геном плода от генома беременной женщины на основании отцовских полиморфизмов.
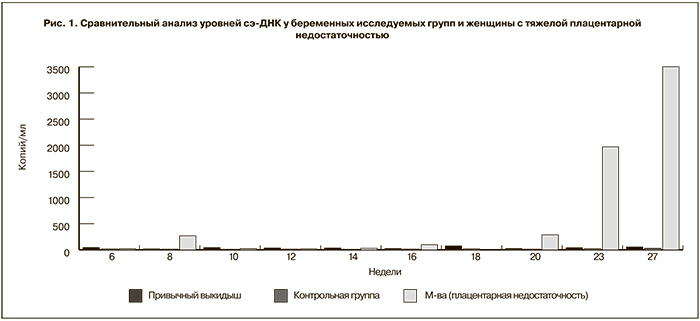
На ранних сроках, до 20 недель, беременность протекала на фоне гестагенной поддержки без осложнений. При сроке 6 недель уровень общей ДНК составил 5080 копий/мл, в то время как уровень сэ-ДНК – 19 копий/м. Уровень общей и сэ-ДНК колебался в небольших пределах и достоверно не отличался от средних показателей в группе женщин с привычным выкидышем и в контрольной группе с физиологически протекающей беременностью (рис. 1 и рис. 2).
В сроке 21 неделя беременности при УЗИ размеры плода соответствовали гестационному сроку, патологии развития плода не выявлено, количество околоплодных вод в пределах нормы.
Впервые в сроке 23 недели беременности уровень общей ДНК составил 225 393 копий/мл, а уровень сэ-ДНК – 1968 копий/м.
В 25 недель беременности произведены УЗИ и доплерометрия, выявлено: выраженное отставание в показателях фетометрии, снижение кровотока в маточных артериях и артериях пуповины. Размеры плода соответствуют 22 неделям беременности. Выставлен диагноз: Плацентарная недостаточность. Задержка роста плода. Проводилось динамическое наблюдение за состоянием беременной и плода, включая еженедельную допплерометрию и фетометрию, после 27 недель допплерометрия проводилась 1 раз в 3 дня.
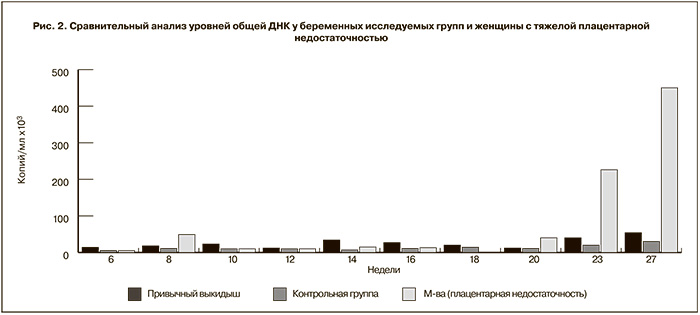
В сроке 27 недель зарегистрирован «нулевой» диастолический кровоток в артерии пуповины, уровни общей ДНК составили 456 000 копий/мл и сэ-ДНК – 3500 копий/мл. Пациентка была госпитализирована, проведена профилактика респираторного дистресс синдрома плода, обследована, данных за развитие преэклампсии не получено. Под тщательным контролем беременность была пролонгирована до 29–30 недель. В сроке 30 недель в связи с развитием маловодия, критическим ухудшением состояния плода вследствие тяжелой плацентарной недостаточности произведено досрочное родоразрешение путем операции кесарева сечения. Кесарево сечение проведено без технических трудностей, ребенок извлечен в целом плодном пузыре, отмечалось выраженное маловодие, воды светлые. Родился живой глубоко недоношенный гипопластичный мальчик массой 630 г, длиной 29 см, оценка состояния по шкале Апгар 5–6 баллов. Плацента массой 165 г, размерами 10×12 см. Ребенок длительно получал лечение в условиях отделения реанимации и интенсивной терапии новорожденных. Проводилась комплексная терапия: респираторная, антибактериальная, инфузионная, антианемическая, парентеральное питание с положительным эффектом. После стабилизации клинического состояния для дальнейшего лечения и выхаживания ребенок был переведен в отделение патологии новорожденных и недоношенных детей Центра, а в дальнейшем выписан домой в удовлетворительном состоянии под наблюдение участкового педиатра.
Заключение
Как следует из полученных результатов, за 2 недели до диагностированной задержки роста плода в периферической крови женщины отмечены апоптотические выбросы сэ-ДНК. Уровни общей ДНК превосходили средние показатели в группе с привычным выкидышем и угрозой преждевременных родов в 6,7 раза, в группе с физиологическим течением беременности в 35 раз. Та же тенденция получена при анализе уровней сэ-ДНК: в 2,2 раза выше показателей в группе с привычным выкидышем и угрозой преждевременных родов и 5,6 раза – с неосложненной беременностью. Полученные данные открывают новые возможности в прогнозировании плацентарной недостаточности по уровням сэ-ДНК.
Интерес представляют данные об уровнях сэ-ДНК на ранних сроках в периферической крови наблюдаемой пациентки с плацентарной недостаточностью. В отсутствии признаков угрожающего/начавшегося выкидыша до 22 недель, достоверных изменений уровней сэ-ДНК по сравнению с уровнями сэ-ДНК у женщин с неосложненной беременностью не отмечено. Вероятно, это свидетельствует о быстром динамическом изменении уровней сэ-ДНК в зависимости от процессов, происходящих в фетоплацентарном комплексе. Повторяющиеся высокие уровни сэ-ДНК в периферической крови женщины после 22 недели беременности свидетельствуют о прогрессировании плацентарной недостаточности.
Представленное клиническое наблюдение подтверждает возможность прогнозирования плацентарной недостаточности по апоптотическим выбросам сэ-ДНК в периферическую кровь беременной женщины.
Требуется проведение дальнейших исследований для расширения возможностей диагностики и прогнозирования осложнений второй половины беременности у женщин с отягощенным акушерским анамнезом.



