Название «микоплазмы» применяется как общее название класса бактерий Mollicutes – мельчайших свободноживущих микроорганизмов. В урогенитальном тракте рассматриваемые бактерии Mollicutes называются Mycoplasma genitalium и Mycoplasma hominis, а две разновидности микоплазм – Ureaplasma urealyticum и Ureaplasma parvum.
Цель данной статьи: дать краткий обзор взаимосвязи вышеуказанных микоплазм и различных акушерских осложнений. Краткий обзор основан на новейших тенденциях в лечении микоплазмоза.
Эпидемиология
Уреаплазмы и микроорганизмы M. hominis считаются оппортунистическими патогенами, так как их можно выделить из нижнего отдела урогенитального тракта как здоровых, так и больных женщин. В доступной литературе сообщается, что распространенность U. urealyticum у женщин составляет 12–53% в образцах от различных популяций [1–4].
Распространенность M. hominis у женщин составляет 1,3–40% в образцах от различных популяций. Большое исследование 2480 пациенток, имевших симптомы инфекции, выявило M. hominis у 3,3% [5]. Некоторые исследования обнаружили микоплазмы M. hominis только в качестве сочетанной инфекции с уреаплазмами [6–8].
Распространенность M. genitalium составила 0,3–1,2% [7, 9], что оказалось ниже, чем распространенность Chlamydia trachomatis, но выше, чем Neisseria gonorrhoeae.
В табл. 1 кратко представлены данные различных исследований о распространенности урогенитальных микоплазм.
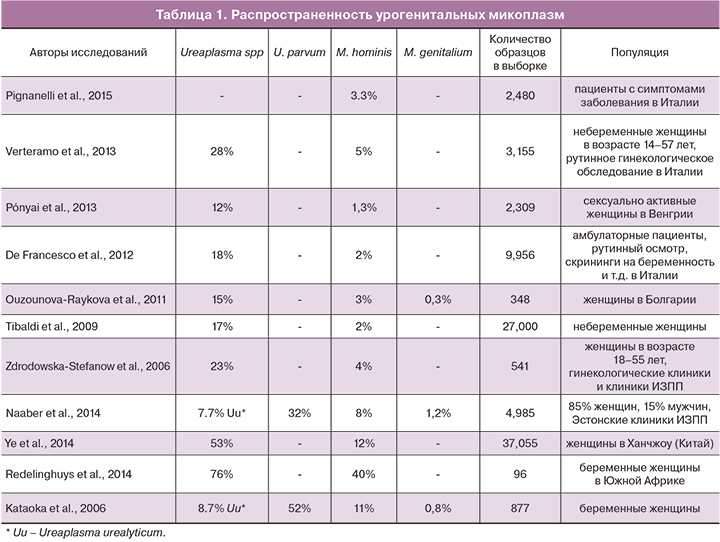
Как видно из табл. 1, распространенность значительно различается в разных исследованиях. Некоторые исследователи отдельно оценивали частоту выявления U. urealyticum и U. parvum. В этих исследованиях количество U. parvum составило 80% всех обнаруженных Ureaplasma spp.
Роль в акушерских осложнениях
Уреаплазмы и микоплазмы M. hominis считаются микроорганизмами-комменсалами микрофлоры организма человека, хотя во все большем количестве исследований обнаруживаются связи между неблагоприятными исходами беременности и колонизацией уреаплазмами и микоплазмами M. hominis. Тем не менее, до сих пор нет определенного консенсуса об их причинно-следственных взаимоотношениях. В следующем разделе кратко изложены последние полученные данные.
Ureaplasma spp.
Колонизация уреаплазмами генитального тракта связана с неблагоприятными исходами беременности, такими как: самопроизвольный выкидыш [10], преждевременный разрыв плодных оболочек (ПРПО) [4], преждевременные роды [11], неонатальная заболеваемость и перинатальная смертность [12]. Применяемая методология и образцы значительно отличаются в разных исследованиях, что затрудняет комбинирование и синтез результатов. В связи с этим данные представлены в табл. 2 в таком виде, как они были заявлены в исследованиях.
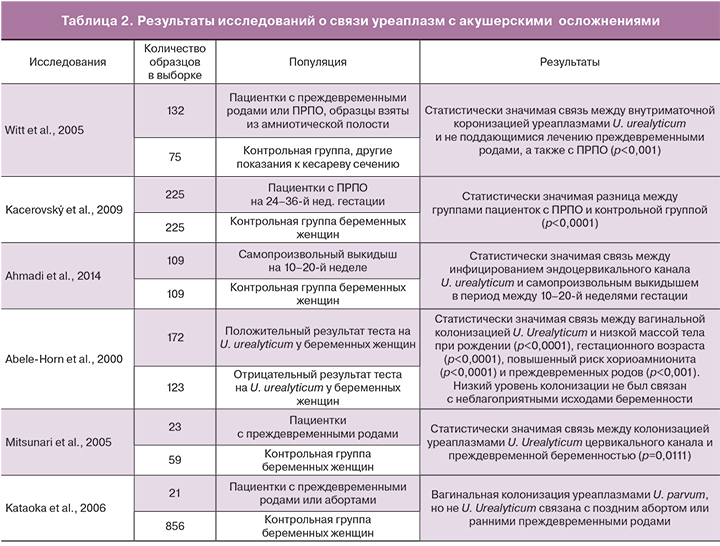
Witt и соавт. [13] обнаружили, что амниотическая полость была колонизована уреаплазмой U. urealyticum у 44% пациенток с ПРПО и преждевременными родами по сравнению с 2,7% беременных женщин в конт-рольной группе. Исследования Mitsunari и соавт. [11] поддерживают мнение о связи между присутствием уреаплазмы U. urealyticum в цервикальном канале и преждевременными родами (колонизация наблюдалась у 46% пациенток группы контроля по сравнению с 87% пациенток с преждевременными родами).
В незначительном количестве исследований проводится анализ отдельно для уреаплазм U. urealyticum и U. parvum и описывается влияние присутствия сразу двух типов уреаплазм Ureaplasma spp. Даже если в статье заявлено, что исследована U. ureaplasma, последующее тщательное изучение раздела «методы» обнаруживает, что применяемые методы не позволяет дифференциировать биовары. Тем не менее, некоторые исследователи провели разграничение. Kataoka и соавт. [14] обнаружили, что U. parvum (но не U. urealyticum) ассоциировали с поздним выкидышем или ранними преждевременными родами. Kasprzykowska и соавт. [15] пришли к заключению, что колонизация нижнего отдела урогенитального тракта уреаплазмами U. parvum может вызывать бессимптомную инфекцию верхнего отдела репродуктивной системы. Kasper и соавт. [16] установили, что увеличение количества уреаплазмы U. parvum в значительной степени было связано с гистологически подтвержденным хориоамнионитом, ПРПО, наряду с преждевременными родами, ранним сепсисом и бронхолегочной дисплазией. К этому можно добавить, что не наблюдалось значительного влияния бактериальной нагрузки U. urealyticum на исходы в неонатальном периоде [16]. Abele-Horn и соавт. [17] обнаружили значимость бактериальной нагрузки. В ходе исследования было выявлено, что высокий уровень колонизации (>105 КОЕ/мл) уреаплазмами U. urealyticum был связан со значительным увеличением частоты клинически значимого хориоамнионита, ПРПО и преждевременных родов. Колонизация низкой плотности не влияла на клинические признаки хориоамнионита и преждевременные роды [17].
Greenow и соавт. [18] провели исследование о возможности воздействия лечения эритромицином беременной женщины с высокой колонизацией уреаплазмы на массу тела ребенка при рождении, и не обнаружили статистически значимой разницы [18]. Однако в данном исследовании лечение антибиотиками было начато только в период между 22-й и 32-й неделями гестации, при том что такие неблагоприятные акушерские исходы, как выкидыш, могут возникнуть гораздо раньше.
M. hominis
Собраны доказательства, подтверждающие, что микоплазма хоминис (M. hominis) играет основную роль при заболевании бактериальным вагинозом (БВ). В свою очередь, последствием БВ может быть внутриутробная смерть плода [19]. Donders и соавт. [19] исследовали БВ и обнаружили, что наличие микоплазмы M. hominis и уреаплазмы U. urealyticum связаны с большим риском выкидыша на ранних сроках беременности. M. hominis может действовать симбиотически с другими бактериями, ассоциируемыми с БВ, или быть одиночным патогеном. Этот вывод сделан на основе наблюдения, что эта микоплазма может быть обнаружена в большом количестве во влагалище у большинства женщин с БВ, и реже – у здоровых женщин [20].
Микоплазма гениталиум (M. genitalium)
Mycoplasma genitalium является главным патогенным микроорганизмом, передающимся половым путем и вызывающим уретрит [21]. Однако не существует неопровержимых доказательств, поддерживающих его значимость в акушерских исходах и трубном бесплодии. Данные предполагают связь между цервицитом и микоплазмой M. genitalium. Подтверждающие доказательства причинно-следственной связи между воспалением тазовых органов и M. genitalium варьируют от умеренных до сильных. Тем не менее, до сих пор еще имеются противоречивые результаты [21]. Существующие данные в некоторой степени поддерживают гипотезу, что M. genitalium может вызывать женское бесплодие, но не позволяют сделать окончательный вывод [22]. Несколько исследований обнаружили независимую связь между наличием микоплазмы M. genitalium и преждевременными родами [23, 24]. Однако причинно-следственная связь наличия M. genitalium с неблагоприятными акушерскими исходами остается неустановленной [25].
Диагностика
Уреаплазмы и микоплазмы M. hominis считаются частью естественной микрофлоры здоровых женщин и мужчин. Следовательно, обнаружение этих бактерий имеет низкую положительную прогностическую значимость в отношении заболеваний. По этой причине в настоящее время в большинстве обзоров не рекомендуется включение этих патогенов в клинические протоколы рутинного скрининга инфекций, передаваемых половым путем, и заявляется, что к бессимптомным индивидуумам не следует применять метод скрининга культур или метод амплификации нуклеиновых кислот (МАНК).
Как обсуждалось ранее, обнаружение микоплазмы M. genitalium в высокой степени связано с заболеваниями. Так как она обнаруживается только в очень редких случаях у здоровых индивидуумов, положительная прогностическая значимость теста на микоплазму M. genitalium является высокой. Предполагается, что M. genitalium может оказаться среди микробов, выявленных рутинным скринигом, таких как хламидия трахоматис (C. Trachomatis) и гонококк (N. Gonorrhoeae).
Лабораторные методы исследования
Микроскопия культур
В прошлом культура считалась золотым стандартом в определении уреаплазм, но этот метод является трудным, поскольку эти микроорганизмы со сложными питательными потребностями требуют наличия сыворотки крови, метаболического субстрата и ростового фактора [26]. Кроме того, некоторые коммерческие наборы, доступные для диагностики урогенитальных инфекций, относящихся к классу молликутов, продемонстрировали недостаточную диагностическую чувствительность [27]. Отсутствие плотной клеточной стенки делает почти невозможной прямую визуализацию уреаплазмы с применением световой микроскопии. Лабораторное тестирование микоплазмы M. genitalium представляется особенно трудным, так как рост каждого изолята происходит в течение нескольких недель или даже месяцев, что делает невозможным использовать культуру для диагностики в рутинной клинической практике [28]. Поэтому из-за слабого и чрезвычайно медленного роста бактерии в культуре диагностика инфицирования микоплазмой M. genitalium выполняется исключительно МАНК [28].
Полимеразная цепная реакция (ПЦР)
Метод ПЦР был внедрен в практику благодаря возможности использовать различные клинические материалы, быстро получать результаты тестирования и возможности обнаруживать различные патогены в мазке [7]. ПЦР имеет большую чувствительность, чем исследования культур (<100 копий генома) для выявления нежизнеспособных, а также жизнеспособных уреаплазм. Результаты ПЦР можно получить в течение одного дня, в то время как культуры – от 2 до 5 дней. Наиболее широко используемые протоколы традиционно применяемой ПЦР на основе геля и ПЦР в реальном времени нацелены на антигены (mba) с множественными связями, уреазу или гены 16s РНК. В настоящее время разрабатываются новые чувствительные и малозатратные мультиплексные методы ПЦР с целью сделать диагностику МАНК [29] более экономически эффективной. Однако на сегодняшний день не существует золотого стандарта теста ПЦР, который можно было бы сравнить с другими новыми тестами. При выборе теста ПЦР следует учитывать, что ПЦР некоторых оперонов MgPa с родственной последовательностью может оказаться неспособной обнаружить некоторые штаммы M. genitalium по причине антигенной вариабельности [25, 28].
Количественная ПЦР (кПЦР)
Традиционная ПЦР ограничена в точности количественного учета микроорганизмов. В отличие от этого, количественная ПЦР в реальном времени (кПЦР) с использованием флуоресцентных красителей или зондов упрощает количественный учет амплифицированных вирусных, бактериальных или паразитарных продуктов. Как было указано выше, при некоторых акушерских осложнениях количество бактерий гораздо важнее, чем сам факт их присутствия.
Метод ПЦР является прекрасной альтернативой методу выращивания культур, но культуры дают возможность проводить тесты на чувствительность к антибиотикам. Однако ПЦР позволяет осуществить молекулярное тестирование на мутационную резистентность к макролидам и метокси-фторхинолонам.
Сбор образцов
До сих пор не существует консенсуса в отношении того, какие образцы имеют наибольшую чувствительность для выявления уреаплазм и микоплазм M. genitalium. Для M. genitalium использование более одного образца может значительно улучшить чувствительность диагностического теста. Lillis и соавт. [30] обнаружили, что наилучшим одиночным образцом для выявления M. genitalium является вагинальный мазок, за которым в порядке уменьшения относительной чувствительности следуют эндоцервикальный мазок (74,3%), образцы мочи (61,4%) и ректальный мазок (24,3%). Вагинальный мазок в сочетании с эндоцервикальным обеспечивает чувствительность, составляющую 95,7% [30]. Также исследование показало, что для диагностики C. trachomatis и N. gonorrhoeae самостоятельно собранные вагинальные мазки имеют равную ценность с мазками, собранными клиницистами, и нет причины сомневаться, что таким же образом будет правильно диагностирована M. genitalium [30].
Общее лечение
У микоплазм и уреаплазм отсутствуют клеточные стенки – мишени для антибиотиков β-лактамного ряда и ванкомицина, что делает их устойчивыми к воздействию этих антибиотиков. Кроме того, образцы уреаплазмы имеют природную устойчивость к линкозамидам (например, к клиндамицину), а микоплазма M. hominis обладает наследственной устойчивостью к макролидам, за исключением джозамицина [31].
Тетрациклины, макролиды и хинолоны традиционно применялись в качестве основных антибиотиков при лечении урогенитальных инфекций, вызываемых микоплазмами. Однако их терапевтическая эффективность может оказаться непредсказуемой из-за растущей устойчивости. Степень устойчивости варьирует в различных регионах в соответствии с различными антимикробными лечебными тактиками и динамикой противомикробного воздействия в разных популяциях. За последнее время в нескольких статьях было опубликованы данные исследований устойчивости микоплазмы M. hominis и уреаплазмы к антибиотикам. В табл. 3 обобщены результаты этих исследований.
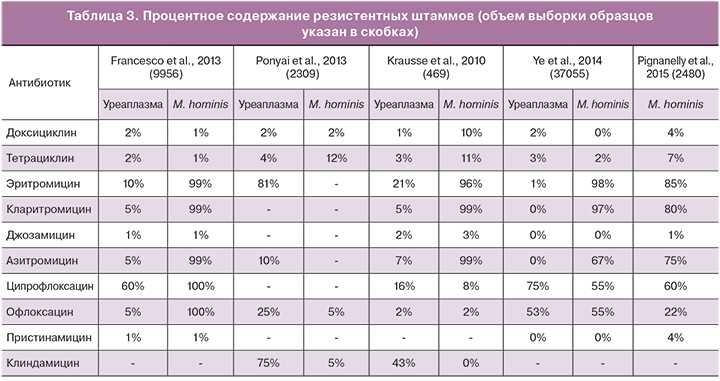
De Francesco и соавт. [32] исследовали образцы, взятые у 9956 пациентов в Италии. Как M. hominis, так и Ureaplasma spp. (без дифференцировки между уреаплазмами U. parvum и U. urealyticum) были наиболее чувствительными к доксициклину и тетрациклину, а также к джозамицину. Кларитромицин и джозамицин оказались наиболее сильнодействующими макролидами против уреаплазм. Единственным макролидом, эффективным против M. hominis, был джозамицин. Другим антибиотиком, эффективным от обоих микробов, был пристинамицин. Эффективность двух других исследованных макролидов – азитромицина и эритромицина оказалась умеренной [32]. В дополнение к этому данные об устойчивости к эритромицину приводятся в исследованиях Ponyai и соавт. [31] и Krausse и соавт. [33], которые определили, что устойчивость уреаплазм к эритормицину составляет 81 и 21% соответственно.
Pignanelly и соавт. [5] исследовали M. hominis и пришли к выводу, что изоляты были чувствительны к тетрациклину и доксициклину, но устойчивы к фторхинолонам и макролидам за исключением джозамицина. Krausse и соавт. [33] обнаружили, что доксициклин был наиболее активным антибиотиком из группы тетрациклинов по отношению к уреаплазмам и микоплазмам M. hominis. Однако 10–13% микоплазм M. hominis были усточивыми к тетрациклиновым антибиотикам [33]. Несмотря на это, доксициклин до сих пор является препаратом первой линии для лечения урогенитальных микоплазменных инфекций, а также может применяться при коинфицировании M. Hominis [33]. Тем не менее, устойчивые штаммы становятся все более распространенными.
В соответствии с действующими директивами Международный Союз по борьбе с инфекциями, передаваемыми половым путем (IUSTI), рекомендует применение антибиотиков группы макролидов в случаях неосложненной инфекции, вызванной микоплазмами M. genitalium при отсутствии мутационной резистентности к макролиду: азитромицин 500 мг 1 раз в первый день, затем 250 мг 1 раз в день в течение 2–5 дней орально, или джозамицин по 500 мг 3 раза в день в течение 10 дней. При резистентности к макролидам рекомендуется терапия моксифлоксацином по 400 мг один раз в день в течение 7–10 дней, что можно рассматривать в качестве одного из вариантов лечения, однако он противопоказан во время беременности [25, 34]. Джозамицин оказался эффективным против микоплазмы M. genitalium in vitro [35]. Этот 16-членный макролид широко применяется в Италии, России, Франции, Испании и др. В недавно опубликованном исследовании лечение джозамицином связывалось с 93,5% уровнем устранения инфекции M. genitalium путем применения 500 мг препарата три раза в день в течение 10 дней [36]. В странах, где джозамицин доступен, его следует рассматривать для лечения инфекции M. genitalium.
Лечение во время беременности
Список антибиотиков, которые не противопоказаны во время беременности и эффективны при урогенитальных микоплазмах, гораздо короче. Макролиды и клиндамицин разрешены к применению. Эритримицин – антибиотик, наиболее широко применяемый при лечении беременных женщин, проявил умеренную активность. Единственный макролид, проявивший сходную эффективность в отношении уреаплазм и микоплазм, – это джозамицин, который также может применяться во время беременности [32, 37, 38]. Различные конфигурации молекул джозамицина делают его устойчивым к эффлюксному насосу – важному механизму резистентности, которым может обладать бактерия [39, 40]. Инфекции M. genitalium также можно лечить азитромицином и джозамицином, однако резистентность может быть проблемой.
Заключение
Микоплазма M. hominis и уреаплазма U. urealyticum могут быть частью нормальной влагалищной флоры, но оба микроорганизма связаны с акушерскими осложнениями. В настоящее время вопрос о том, кого следует обследовать на выявление урогенитальных микоплазм, и есть ли необходимость устранять колонизацию ими с целью профилактики акушерских осложнений, остается нерешенным. M. genitalium является четко установленным урогенитальным патогеном, и в отношении него надо проводить лечение. В соответствии с действующими директивами, джозамицин и азитромицин – это препараты выбора при отсутствии мутационной резистентности M. genitalium к макролидам. Джозамицин безопасен для применения при беременности в случае необходимости лечения урогенитального микоплазмоза.



