Эндометриоз – распространенное заболевание матки, придатков, органов малого таза, актуальная проблема современной оперативной гинекологии, сложная патология для ранней и дифференциальной диагностики, комплексного лечения, профилактики и реабилитации [1–4]. В структуре генитального эндометриоза аденомиоз составляет 12–50% [2, 5–8]. Сложность диагностики заболевания на ранних этапах, трудности выявления предикторов заболевания объясняют частую встречаемость запущенных и распространенных форм аденомиоза, сопровождающихся снижением фертильности, нарушением трудоспособности женщин [8, 9].
Успехи ранней и дифференциальной диагностики патологии органов репродуктивной сферы, в т.ч. аденомиоза с использованием методов лучевой, ультразвуковой визуализации обнадеживают; возможности новейших технологий, инновационные решения последних лет внушают оптимизм. Применению новых технологий мультипараметрического ультразвукового исследования (УЗИ) в детализации структуры миометрия посвящено достаточно большое количество работ последних десятилетий [9–14]. Успешно применяются технологии серой шкалы, тканевых гармоник, допплеровские режимы, опции недопплеровской визуализации кровотока и мультипланарного сканирования, трехмерной реконструкции и контраст усиленной визуализации, методы ультразвуковой эластографии (УЭ) [12–21]. Однако, высокие аппарато- и операторозависимость при детализации структуры миометрия, большая частота (20–40%) диагностических ошибок при УЗ-дифференцировке аденомиза определяет поиск новых технологий, новых критериев данной патологии [11, 12, 15, 22].
УЭ – специальная методика визуализации тканей и органов, основанная на различии эластических свойств (упругости) нормальных и патологических тканей организма, на определении их деформации при дозированной компрессии, объективной оценке степени эластичности (коэффициента жесткости) зоны поражения по сравнению с неизмененными окружающими тканями и реализованная в современных ультразвуковых диагностических приборах.
Первые сообщения об использовании УЭ в медицине опубликованы в начале 90-х гг. XX в.; первым методом ультразвуковой оценки жесткости тканей применена компрессионная эластография (КЭГ) — технология улучшения визуализации неоднородностей тканей по их сдвиговым характеристикам, визуализация тканей и органов с отображением различия эластичности (жесткости) нормальных и патологических тканей на основе оценки локальной деформации при дозированной компрессии или вибрации. Кроме определения различий цветового окрашивания образования с окружающими тканями, степени неоднородности зон поражения, важным достоинством КЭГ является возможность оценки границ патологического образования органов и систем, уточнения его размеров, органной принадлежности. Имеются немногочисленные публикации, показывающие высокую степень надежности метода КЭГ в дифференциальной диагностике очаговых изменений миометрия, выявлении аденомиоза, гиперплазии эндометрия. Чувствительность технологии в диагностике очаговых изменений миометрия составляет 75,4–100,0%, специфичность – 75,6–100,0%, предсказательная ценность положительного результата – 69,3–100,0%, отрицательного результата – 90,5–98,0% [11, 12, 15, 21, 22].
Для объективизации метода в последнее время используют эластографию сдвиговой волной (ЭСВ, SWE – Shear Wave Elastograpgy), которая позволяет определять количественные показатели жесткости (эластичности) тканей. ЭСВ – метод объективного количественного определения жесткости (эластичности) тканей, характеризующий состояние исследуемых органов и тканей. Количественными показателями ультразвуковой эластичности органов и тканей могут являться модуль Юнга, скорость сдвиговой (поперечной) волны, индексы эластичности (SWE-ratio) и т.д. Возможно измерение и выражение показателей в числовом формате скорости волны, расходящейся в стороны от зоны воздействия акустического импульса высокой мощности на исследуемый объект. Чем жестче исследуемый объект, тем выше скорость поперечной волны. Технология ЭСВ считается более объективной и воспроизводимой, чем КЭГ [12].
Жесткость миометрия при узловых и диффузных формах его поражения, при наличии аденомиоза, доброкачественных миоматозных узлов, злокачественном поражении, определяемая по данным ЭСВ, существенно отличается от таковой неизмененного миометрия. Скорость распространения поперечной волны в неизменном миометрии по результатам различных исследователей может варьировать в пределах от 1,20 до 3,63 м/с, жесткость – 5–114 кПа; при аденомиозе – 2,40–4,50 м/с, 31–180 кПа; при доброкачественных миоматозных узлах – 0,92–3,97 м/с, 25–55 кПа. Чувствительность эластометрии в диагностике аденомиоза составляет 76,9–92,2%, специфичность – 71,1–88,8% [12, 15, 22–24].
Однако, до сих пор сохраняются нерешенные вопросы методологии, комплексного анализа результатов использования УЭ в определении жесткости миометрия, диагностике патологии матки, определенные трудности корректного воспроизведения, интерпретации результатов, комплексного анализа характеристик количественного и качественного анализа, что предполагает продолжение исследований в данной области с целью совершенствования диагностических критериев метода, уменьшения его аппарато-, операторозависимости.
Целью нашего исследования является оптимизация диагностических методов изучения миометрия с применением технологии УЭ (компрессионной и сдвиговой волны) для дифференциальной диагностики и определения оптимального доступа и объема оперативного лечения у пациенток с изменениями миометрия при аденомиозе.
Материалы и методы
Проведен анализ результатов комплексного обследования и лечения 120 пациенток, наблюдавшихся на базе отделений ФГБУ НМИЦ АГП им. В.И. Кулакова Минздрава России. Разделение по группам произведено в соответствии с выявленной патологией миометрия после проведенного ультразвукового обследования и оперативного лечения 96/120 пациенток и морфологического подтверждения диагноза. Критерием исключения из исследования являлось подозрение на наличие злокачественного поражения матки, новообразования придатков по данным предварительной мультипараметрической эхографии.
В первую (основную) группу вошли 36 женщин в возрасте от 23 до 42 лет (средний возраст составил 39,42±10,9 года) с признаками аденомиоза (диффузной и узловой форм различной степени выраженности), выявляемыми при клиническом обследовании и УЗИ, и последующим морфологическим исследованием удаленных тканей. Критерии исключения: наличие миомы матки, образований яичников, онкологические заболевания органов репродуктивной системы.
Во 2-ю группу включили 60 пациенток в возрасте 25–46 лет (средний возраст составил 38,1±8,2 года) с наличием узлов миомы матки, различных размеров и расположения, отсутствием аденомиоза, по данным предварительного комплексного УЗИ и последующего морфологического исследования узлов матки, удаленных во время операции. Критерии исключения: наличие аденомиоза, образований яичников, онкологические заболевания органов репродуктивной системы.
В 3-ю группу (контрольную) вошли 24 амбулаторных пациентки в возрасте от 19 до 65 лет (средний возраст составил 40,5±10,3 года), с отсутствием жалоб со стороны органов репродуктивной системы, существенных отклонений по данным лабораторно-инструментальных исследований и неизмененным миометрием по данным УЗИ. Критерии исключения: наличие жалоб со стороны репродуктивной системы, миомы матки, аденомиоза, образований яичников, онкологических заболеваний органов репродуктивной системы.
Пациенткам 1-й и 2-й групп проведено оперативное лечение в гинекологическом отделении. Для диагностики применяли стандартные клинико-лабораторные методы исследования, гинекологический осмотр, опрос пациенток. Из дополнительных обследований в отделении функциональной диагностики ФГБУ НМИЦ АГП им. В.И. Кулакова Минздрава России всем пациенткам проведено УЗИ малого таза. Оно выполнено на сканерах Aixplorer (SuperSonic Imagine, Франция), Logiq E9 (GE, США) в стандартных режимах трансабдоминальной эхографии с использованием конвексных датчиков (3,5–5,0 МГц) и трансвагинальной эхографии с использованием полостных датчиков (3,0–12,0 МГц). Мультипараметрическая эхография проводилась в первую фазу менструального цикла в два этапа.
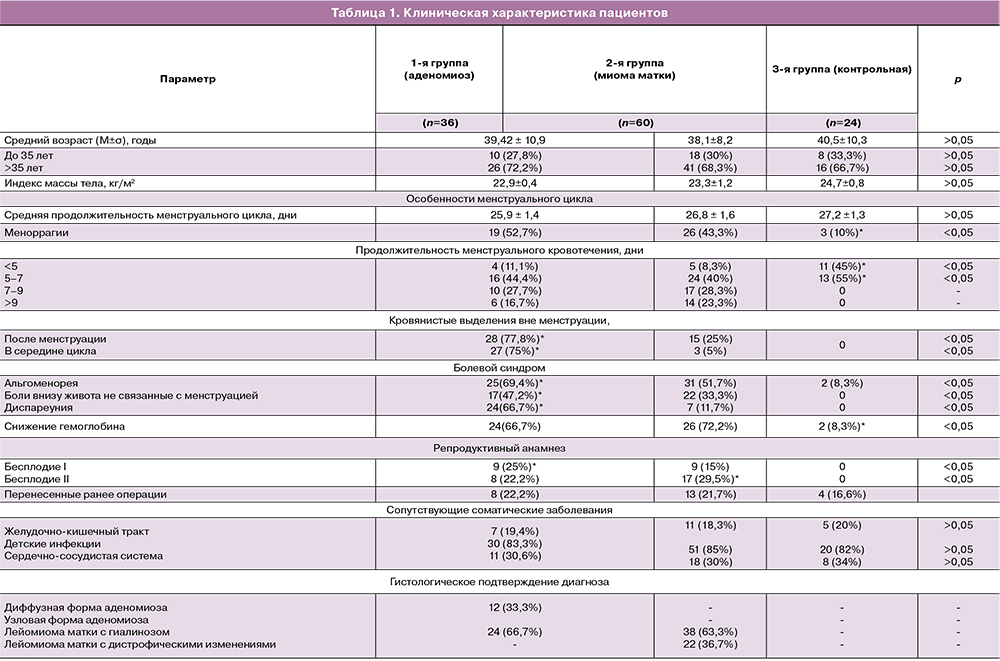
Клиническое обследование пациенток представлено в табл. 1. Все три группы пациенток были примерно однородны по индексу массы тела (ИМТ) и возрастному составу. Отмечено большее количество жалоб пациенток на обильные менструации в 1-й группе с аденомиозом (достигающее 54,7%), чем во 2-й группе с миомой матки (43,3%) по сравнению с группой контроля. Продолжительность менструального цикла во всех трех группах была примерно одинаковой и составила от 25 до 27 дней. Длительность менструального кровотечения более 7 дней у пациенток в 1-й группе была у 44,4%, во 2-й – у 53,6%, тогда, как в группе контроля у всех пациенток менструальное кровотечение не превышало 5–7 дней. Из особенностей менструации у более 70% пациенток с аденомиозом отмечались кровянистые выделения после менструации и в середине менструального цикла. При оценке болевого синдрома выявлено, что болезненные менструации, боли, не связанные с менструацией, диспареуния преимущественно больше беспокоили пациенток с аденомиозом.
Первичное бесплодие преобладало у пациенток 1-й группы (25% по сравнению с 15% пациенток 2-й группы), а вторичное бесплодие у пациенток 2-й группы (29,5% по сравнению с 22,2% пациентками 1-й группы).
Все три группы пациенток были примерно однородны по наличию сопутствующей соматической патологии и перенесенным оперативным вмешательствам в анамнезе.
Из клинико-лабораторного обследования обращает на себя внимание снижение уровня гемоглобина у пациенток с аденомиозом и миомой матки (66,7 и 71,1% соответственно), что напрямую связано с наличием менометроррагий у пациенток этих двух групп.
При морфологическом исследовании в первой группе у 100% пациенток выявлены гистологические признаки аденомиоза, во 2-й группе в 100% образцах подтверждена миома матки.
Первый (предварительный) этап исследования (до проведения УЭ) включал в себя стандартный протокол гинекологического УЗИ. Наряду с топографо-анатомическими характеристиками положения, эховолюметрии матки, придатков, характеризовали: структуру миометрия, эндометрия, определяя наличие диффузных изменений, детализируя очаговые поражения, анализируя эхогенность, однородность, васкуляризацию патологических очагов в режимах серой шкалы, цветового допплеровского картирования (ЦДК), энергетического картирования (ЭК), 3D/4D-реконструкции.
Второй этап исследования включал в себя протокол проведения УЭ: КЭГ и ЭСВ.
В процессе выполнения КЭГ в реальном режиме времени в течение 2–5 с после включения опции, на экране монитора (в окне интереса) отображалось несколько последовательных статических изображений. Изображение на эластограмме, содержащее минимальное количество шумов и артефактов, являлось результатом анализа, обработки и наложения двух составляющих: базового В-режима и компрессионного изображения, полученного после активации опции. В результате математического анализа эластичность тканей на экране отображалась определенными цветами (цветовым картированием). Возможности приборов позволяли проводить окрашивание с использованием сине-зелено-красной цветовой гаммы, оттенков красного, серого, большого спектра других цветов. В данной работе использовалась сине-зелено-красная цветовая гамма, при которой «жесткие» участки картировались синим цветом, а более «мягкие» – красным, промежуточные значения картировались оттенками желтого и зеленого цветов. Район интереса у пациенток без изменений миометрия захватывал максимальную площадь передней и задней стенок матки, у пациенток с аденомиозом и миомами матки захватывал зону патологических изменений миометрия и, по возможности, неизмененный миометрий.
В режиме КЭГ при анализе структуры миометрия во всех исследуемых группах полученные цветовые карты подразделяли: по однородности окрашивания миометрия на однородное и неоднородное, по характеру окрашивания миометрия на окрашивание в оттенках синего, в оттенках красного и смешанное мозаичное окрашивание.
ЭСВ проводили на сканере Aixplorer (SuperSonic Imagine, Франция) с использованием полостного датчика (3,0-12,0 МГц) при трансвагинальной эхографии на глубине до 3–5 см. Исследования и измерения проводили в гинекологическом режиме (пресете), диапазоне шкалы значений модуля Юнга 0–180 кПа без дополнительной компрессии при минимизации возможных движений датчиком. Район интереса (цветовое окно) у пациенток без патологических изменений миометрия, по данным В-режима, устанавливали вдоль хода мышечных волокон в ближней к датчику стенке матки, а у пациенток с аденомиозом и миомами матки захватывал зону патологических изменений миометрия, по данным В-режима, и, по возможности, неизмененный миометрий. Окно опроса окрашивалось в соответствии со значениями жесткости – участкам с наибольшими значениями модуля Юнга соответствовал красный цвет, с меньшими – синий цвет, промежуточные значения картировались цветами от голубого до желтого, соответственно возрастанию жесткости. Процесс измерения жесткости тканей производили в автоматическом режиме при полном (максимально возможном) паттерне окрашивания цветового окна, для измерения использовали одинаковые по площади окна опроса (Q-Box) – по три в каждом цветовом окне, которые располагали в зоне максимальной жесткости. Результаты отображались на экране монитора в режиме реального времени в единицах измерения – кПа. На экране отображались среднее значение (E-mean), минимальное значение (E-min) и максимальное значение (E-max), стандартное отклонение (SD). К анализу было принято среднее значение E-mean по результатам 5 измерений. Во всех случаях анализировали качественные характеристики ЭСВ. Полученные цветовые карты дифференцировали по однородности окрашивания миометрия на однородные и неоднородные и характеру окрашивания – по цвету (синий, голубой, желтый, красный).
Все полученные варианты окрашивания, цветовые карты, количественные показатели модуля Юнга неизмененного миометрия, его патологических участков (при очаговых изменениях) фиксировались в памяти ультразвуковых сканеров для последующего сохранения на цифровых носителях, анализа и математической обработки.
Дизайн статистического исследования:
- качественные признаки описывали путем выделения подгрупп в соответствии со значениями любой из учитываемых переменных, выражая данные через абсолютную и относительную частоту;
- сопоставление подгрупп на предмет возможных различий с использованием анализа вариаций по Крускалу–Уоллесу. Различия считали достоверными, когда полученное значение p для данного критерия (теста) ниже критического уровня значимости α=0,05;
- расчет операционных характеристик качественных параметров УЭ в диагностике аденомиоза;
- при оценке количественных данных произведена оценка репрезентативности выборки;
- в зависимости от количества групп, сравнение и проверка состоятельности предположения о неравенстве параметров положения в этих группах;
- объединение в пределах неявных взаимодействий ряда учитываемых признаков и оценка операционных характеристик построенных моделей.
Статистическую обработку исследования произвели с помощью программ STATISTICA (Data analysуs of software system, StatSoft, Inc. 2014) версия 12.5, MedCalc Statistical Software версия 15.8 (Med Calc Software bvba, Ostend, Belgium) в среде WINDOWS.
Результаты и обсуждение
Клинически группа пациенток с аденомиозом характеризуется: средними показателями индекса массы тела (ИМТ), возраста, продолжительностью менструального цикла 25,9±1,4 дня, наличием меноррагий, длительностью менструаций больше 5–7 дней, наличием межменструальных кровотечений, альгоменореи, диспареунии, выраженного болевого синдрома, не связанного с менструальным циклом, первичного и вторичного бесплодия, снижением уровня гемоглобина, морфологически подтвержденным диагнозом: аденомиоз. Группа пациенток с миомой матки характеризуется: средними показателями ИМТ, возраста, продолжительностью менструального цикла 26,8±1,6 дня, наличием меноррагий, длительностью менструаций более 5–7 дней, альгоменореи, вторичного бесплодия, снижением уровня гемоглобина, морфологически подтвержденным диагнозом: миома матки.
При специальном УЗИ выявлены достоверные отличия (p<0,001) по цвету окрашивания миометрия при проведении КЭГ между 1-й и 2-й группами и между 1-й и 3-й группами пациенток, по однородности окрашивания (p<0,001) – между 3-й группой и 1-й–2-й группами. Достоверных отличий по признаку однородности между пациентами 1-й и 2-й групп не выявлено.
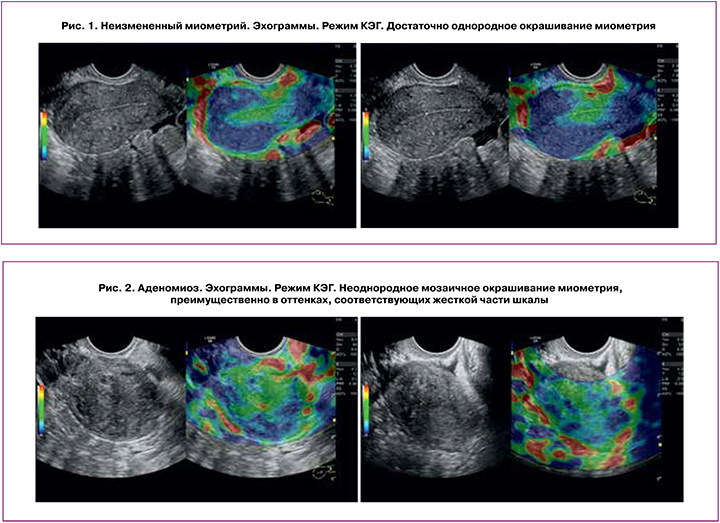
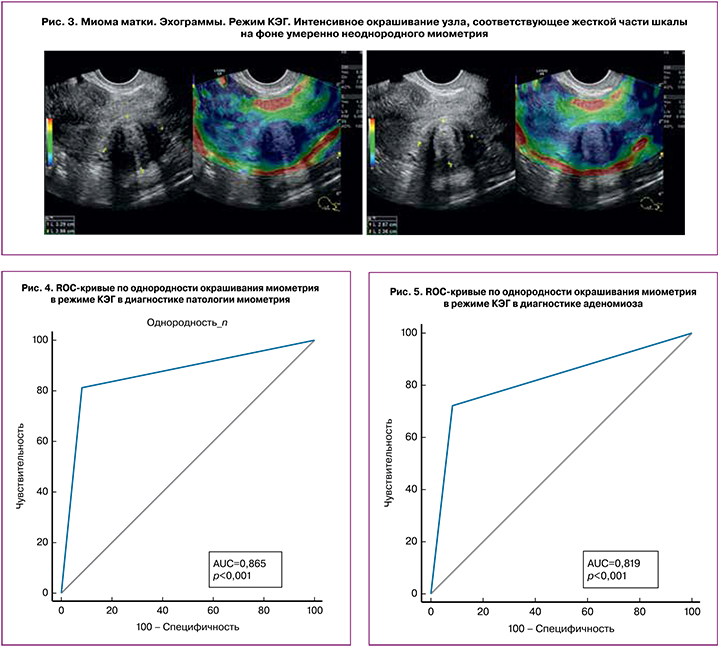
Неизмененный миометрий в 92% случаев имел однородное окрашивание в различных оттенках шкалы (рис. 1), и в 8% случаев определялось неоднородное смешанное мозаичное окрашивание. При аденомиозе в большинстве (72%) случаев выявлена выраженная диффузная неоднородность окрашивания миометрия – смешанное мозаичное окрашивание отмечено в 61% случаев (рис. 2), в оттенках синего – в 33% и в 6% – в оттенках красного. У пациенток с миомами неоднородное окрашивание выявлено в 87% случаев, за счет неоднородного интенсивного синего («жесткого») окрашивания узлов миомы на фоне умеренно неоднородного миометрия, окрашивающегося в оттенках светло-синего и зеленого цвета (рис. 3), а в 13% (при малых размерах миом) миометрий окрашивался достаточно однородно, и миоматозные узлы слабо дифференцировались на фоне неизмененного миометрия.
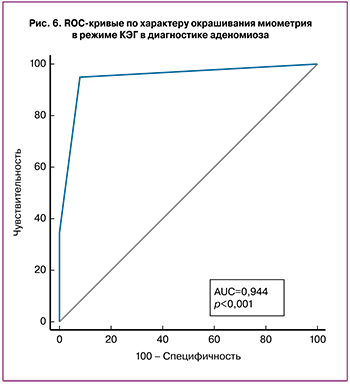
Была оценена диагностическая точность качественных параметров КЭГ в дифференциальной диагностике неизмененного и патологически измененного миометрия (3-я группа и объединенные 1-я и 2-я группы). Тест «однородное окрашивание миометрия при КЭГ – норма» характеризуется чувствительностью 81,25%, специфичностью 91,67%, AUC – 0,865 PV+–91,0%, PV- – 82,4% (рис. 4).
При дифференциальной диагностике нормы и аденомиоза тест «неоднородное окрашивание миометрия – аденомиоз» – чувствительность 72,22%, специфичность 91,67%, AUC – 0,892 PV+ – 90,0%, PV- – 76,0%, тест «смешанное мозаичное окрашивание – аденомиоз» – 94,44%, 91,67%, 0,944, 92,2% и 94,1% соответственно (рис. 5, 6) .
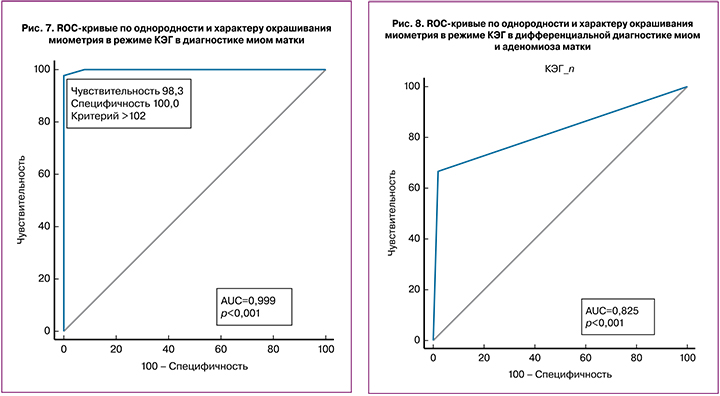
При дифференциальной диагностике нормы и миом матки было решено объединить признаки однородности и цвета окрашивания миометрия в тест «жесткое неоднородное окрашивание на фоне неизмененного миометрия – миома», чувствительность теста составила 98,3%, специфичность – 100%, AUC – 0,983, PV+ – 100%, PV- – 98,3% (рис. 7).
В дифференциальной диагностике миом матки и аденомиоза тест «неоднородное «жесткое» окрашивание узлов на фоне более «мягкого» однородного миометрия – миома»: чувствительность – 66,67%, специфичность – 98,33%, AUC – 0,825, PV+ – 97,7%, PV- – 73,9% (рис. 8).
Неоднородность структуры миометрия при аденомиозе и миомах матки, подтвержденная гистологически, обусловливает отсутствие различий между этими группами по признаку неоднородности окрашивания в режиме КЭГ. Различия в характере окрашивания миометрия в режиме КЭГ обусловлены распространенностью процесса при аденомиозе – в нашем исследовании преобладала диффузная форма аденомиоза, гистологически представленная утолщенным миометрием [25]. Такая гистологическая структура отражалась на эластограмме неоднородным смешанным мозаичным окрашиванием с участками повышенной и пониженной жесткости. В случаях миом матки по периферии узлов определялся неизмененный миометрий, за счет чего «жесткие» миомы хорошо дифференцировались на фоне более «мягкого» миометрия. Сложности возникали в случае аденомиотических узлов, которые окрашивались в оттенках красного «мягкий»; такой характер окрашивания отмечен нами в 4 случаях. В исследовании Stoelinga B. и соавт. [26] участки аденомиоза окрашивались светлее неизмененного миометрия, что соответствовало «мягкому» паттерну, а миомы матки – темнее, что соответствовало «жесткому» паттерну. В нашем исследовании при картировании аденомиотических узлов на эластограмме отмечалось неоднородное мозаичное сине-зеленое их окрашивание на фоне неизмененного миометрия.
При анализе качественных показателей ЭСВ достоверные различия выявлены между контрольной группой и 1-й и 2-й группами, а между 1-й и 2-й группами достоверных различий не выявлено.
Неизмененный миометрий характеризовался окрашиванием в оттенках синего цвета (96%), при этом окрашивание было однородным (91,66%).
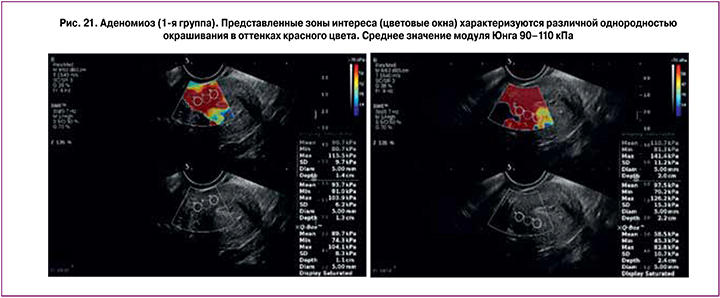
При аденомиозе миометрий окрашивался оттенками красного цвета в 83,3% и оттенками желтого цвета – в 8,3% случаев; в 61,1% случаев наблюдалось неоднородное красное окрашивание и в 38,9% окрашивание было неоднородным в оттенках красного–желтого–светло-синего цветов.
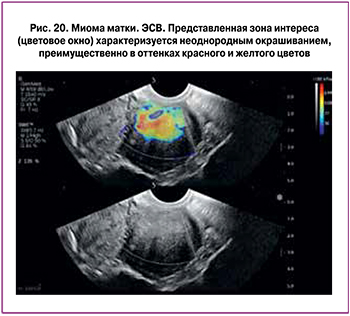
При миомах чаще определялось окрашивание в проекции миоматозного узла в оттенках красного (58,33%), желтого (21,66%) и светло-синего (16,6%) цветов на фоне синего миометрия; неоднородное окрашивание миоматозных узлов выявлено в 81,7%, однородное окрашивание – в 18,3% случаев.
Была оценена диагностическая точность качественных параметров ЭСВ в дифференциальной диагностике неизмененного и патологически измененного миометрия (3-я группа и объединенные 1-я и 2-я группы). Тест «неоднородное окрашивание – патология миометрия» характеризовался чувствительностью 65,62%, специфичностью – 91,67%, AUC – 0,786, PV+ – 89,1%, PV- – 71,9%, тест «окрашивание миометрия в синих тонах – норма» – 81,25%, 95,83%, 0,849, 95,3%, 83,1% соответственно (рис. 9, 10).
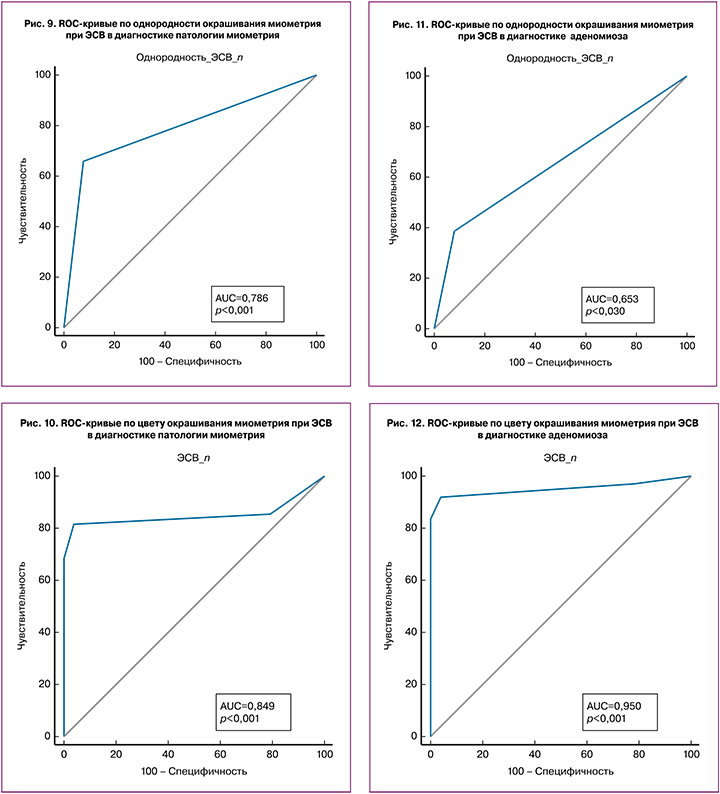
При оценке диагностической точности качественных параметров ЭСВ в дифференциальной диагностике нормы и аденомиоза тест «неоднородное окрашивание – аденомиоз» характеризовался чувствительностью 39,89%, специфичностью – 91,67%, AUC – 0,653, PV+ – 82,9%, PV- – 59,0%, тест «окрашивание миометрия с преобладанием красного, и желтого цветов – аденомиоз» – 91,67%, 95,83%, 0,950, 95,8%, 91,7% соответственно (рис. 11, 12).
В дифференциальной диагностике нормы и миом матки тест неоднородное окрашивание – миома» характеризовался чувствительностью 81,67%, специфичностью – 91,67%, AUC – 0,867, PV+ – 91,1% PV- – 82,8%, тест «окрашивание в оттенках красного и желтого цветов» – 75,0%, 95,83%, 0,789, 94,9%,78,6% соответственно (рис. 13, 14).
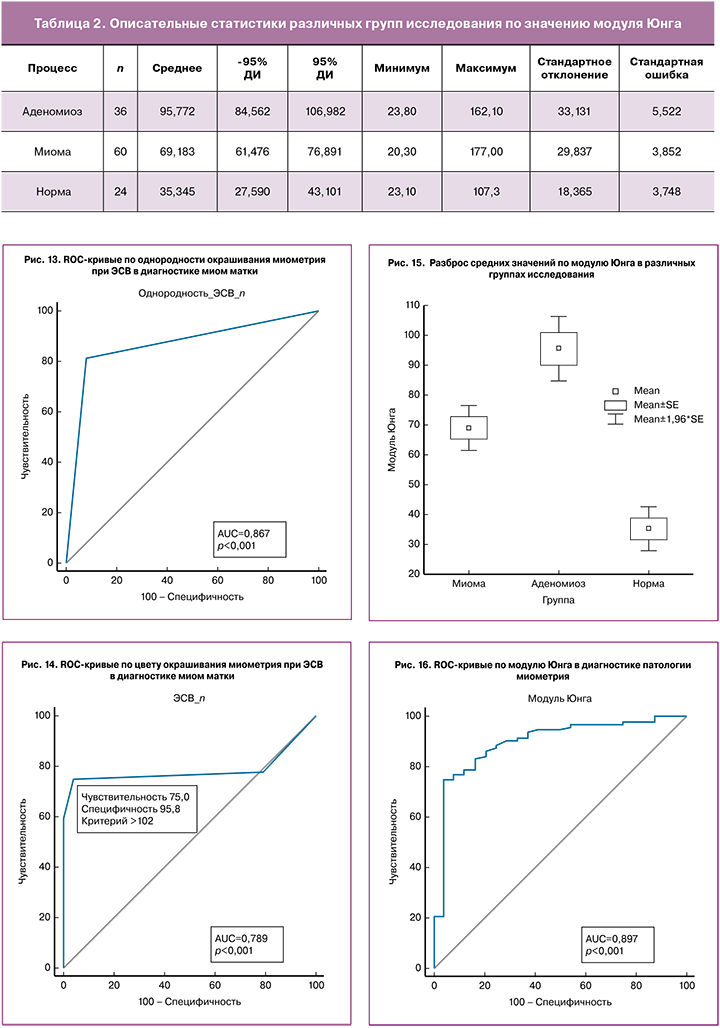
Выявлены достоверные различия значений модуля Юнга (E mean) между всеми исследуемыми группами (p≤0,001). Значения модуля Юнга –среднее, 95% доверительный интервал (ДИ), минимальное и максимальное значение, стандартное отклонение и стандартная ошибка среднего представлены в табл. 1, графическое представление разброса средних значений представлено на рис. 15.
Как видно из табл. 2, неизмененный миометрий характеризовался наименьшими значениями модуля Юнга (M±SD), (95%ДИ) 35,34±18,36 кПа, (27,59-43,10 кПа). Значения, полученные в нашем исследовании, соответствуют данным литературы. По данным Митькова В.В. и соавт. [12], жесткость неизмененного миометрия составляла 24,58±1,97 кПа (17,84– 32,97 кПа), по данным Диомидовой В.Н. [27] – 22,3±1,7 кПа (8,4–40,5), по данным Manchanda S. и соавт. (2019) – 40,24±8,59 кПа [28]. Диагностическая точность УЭ в диагностике патологических изменений миометрия при пороговом значении модуля Юнга >54,2 кПа составила: чувствительность – 75%, специфичность – 95,83%, AUC – 0,897, PV+ – 94,9%, PV- – 78,6% (рис. 16). При понижении порогового значения до >46,8 кПа, чувствительность повышается до 79,17%, специфичность – 83,33%, PV+ – 83,2%, PV- – 79,4%. Миомы матки характеризовались значениями модуля Юнга 69,19±29,83 кПа (61,47–76,89 кПа). По данным Митькова В.В. [29], при исследовании ex vivo жесткость миом матки коррелировала с их гистологическим типом: среднее значение модуля Юнга при миомах матки без отека и гиалиноза – 83,57±10,40 кПа (47,05–175,83 кПа), в случае миом матки с отеком – 53,87±7,60 кПа (12,65–77,60 кПа); наибольшие значения модуля Юнга соответствовали миомам матки с гиалинозом – 257,99±29,12 кПа (207,52–269,80 кПа). Таким образом, различия значений жесткости миом матки по данным различных авторов обусловлены преобладанием того или иного гистологического типа миом в группе исследования. При сравнении с 3-й группой диагностическая точность ЭСВ в диагностике миом матки при пороговом значении модуля Юнга >54,2 кПа составила: чувствительность – 68,33%, специфичность – 95,83%, AUC – 0,875, PV+ – 94,5%, PV- – 74,4% (рис. 17).
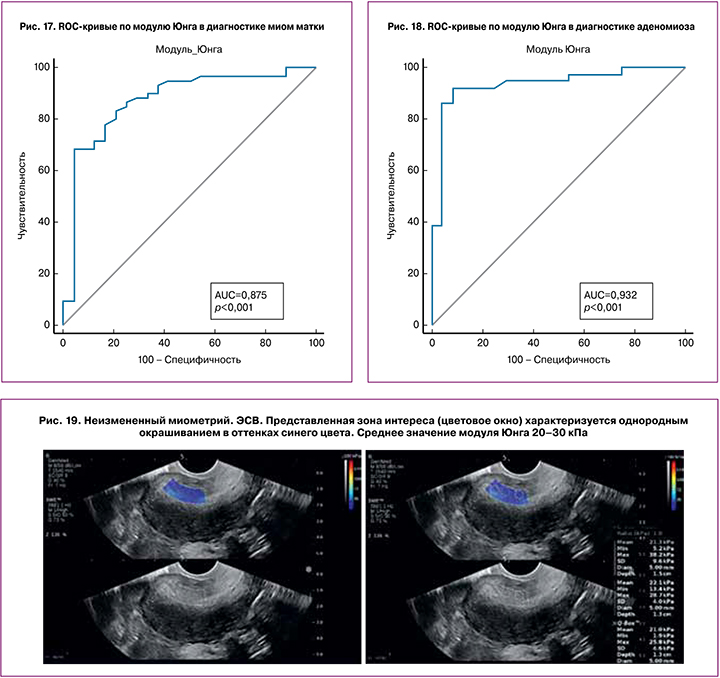
При аденомиозе выявлены наибольшие значения модуля Юнга – 84,54±33,13 кПа (84,56–106,98 кПа). По данным Митькова В.В. и соавт. [29], при исследовании ex vivo жесткость миометрия при аденомиозе также различалась в зависимости от степени аденомиоза: при диффузной форме аденомиоза наибольшие значения модуля Юнга были выявлены при III степени аденомиоза – 260,57±22,68 кПа (156,09–280,70кПа), а при I-II степени – 70,02±9,20 кПа (48,49–93,74 кПа); наименьшие значения соответствовали узлам при аденомиозе с отеком – 15,67–33,53 кПа; аденомиотическим узлам без отека соответствовали значения 262,80–292,94 кПа. Как видно из табл. 2, разброс минимального и максимального значений Emean в 1-й группе пациенток составил 23,80–162,10 кПа, наименьшие значения соответствовали аденомиотическим узлам (n=4) – 23,8–52,3 кПа, при диффузной форме аденомиоза разделения по степеням нами не производилось. При пороговом значении модуля Юнга >51,7 кПа в диагностике аденомиоза при сравнении с нормой чувствительность, специфичность, AUC, PV+ и PV- эластометрии матки составили 91,67%, 91,67%, -0,932, 92,0%, 91,4% соответственно (рис. 18).
 Несмотря на полученные различия значений модуля Юнга при аденомиозе и миомах матки, показатели диагностической точности эластометрии в дифференциальной диагностике миом матки и аденомиоза невысоки. Тест «модуль Юнга >81,4 кПа – аденомиоз» характеризуется чувствительностью, специфичностью, AUC, PV+ и PV- – 69,44%, 75,0%, 0,739, 74,3% и 70,2% соответственно. В исследовании Zhang M. и соавт. [30] миомы матки и аденомиоз также характеризовались повышенной жесткостью, по сравнению с неизмененным миометрием при измерении скорости сдвиговой волны, а достоверных различий между группой аденомиоза и миом матки не выявлялось. Таким образом, эластометрия без учета качественных характеристик не может быть рекомендована для дифференциальной диагностики миом матки и аденомиоза.
Несмотря на полученные различия значений модуля Юнга при аденомиозе и миомах матки, показатели диагностической точности эластометрии в дифференциальной диагностике миом матки и аденомиоза невысоки. Тест «модуль Юнга >81,4 кПа – аденомиоз» характеризуется чувствительностью, специфичностью, AUC, PV+ и PV- – 69,44%, 75,0%, 0,739, 74,3% и 70,2% соответственно. В исследовании Zhang M. и соавт. [30] миомы матки и аденомиоз также характеризовались повышенной жесткостью, по сравнению с неизмененным миометрием при измерении скорости сдвиговой волны, а достоверных различий между группой аденомиоза и миом матки не выявлялось. Таким образом, эластометрия без учета качественных характеристик не может быть рекомендована для дифференциальной диагностики миом матки и аденомиоза.
На рис. 19–21 представлены примеры окрашивания при ЭСВ и значения модуля Юнга при неизмененном миометрии, миомах матки и аденомиозе.
Заключение
Жесткость миом матки и участков аденомиоза достоверно выше жесткости неизмененного миометрия, что позволяет применять методики УЭ (КЭГ и ЭСВ) в диагностике патологии миометрия с высокой степенью диагностической точности, однако возможности КЭГ и ЭСВ в дифференциальной диагностике аденомиоза и миом матки ограничены.



