Качество половых клеток в циклах экстракорпорального оплодотворения (ЭКО) является ключевым фактором успеха. В последнее время в литературе активно обсуждается взаимосвязь между неудачными попытками ЭКО/ИКСИ (интрацитоплазматическая инъекция сперматозоида в ооцит) и качеством полученных при стимуляции суперовуляции ооцитов [1–3]. В связи с этим становится ясно, что работа клинического эмбриолога и репродуктолога невозможна без фундаментальных знаний о строении половых клеток. Гаметы человека, в отличие от животных, мало изучены по причине недоступности материала, особенно это касается ооцитов человека.
В данной статье сделана попытка обобщить известные данные о строении зрелого ооцита человека, а также на примере клинических случаев показать возможные аномалии развития женских половых клеток.
Современные представления об ультраструктуре ооцита человека на стадии MII
 В цитоплазме зрелого неоплодотворенного ооцита человека на стадии деления I мейоза (MII) различают три основных уровня организации органелл: кортекс, субкортекс и центральный цитоплазматический регион, представляющий основную часть цитоплазмы (рис. 1).
В цитоплазме зрелого неоплодотворенного ооцита человека на стадии деления I мейоза (MII) различают три основных уровня организации органелл: кортекс, субкортекс и центральный цитоплазматический регион, представляющий основную часть цитоплазмы (рис. 1).
Кортекс ооцита содержит большие плотные кортикальные гранулы, которые являются уникальными органеллами ооцита. При ультраструктурном изучении ооцита человека было обнаружено, что существует два различных типа кортикальных гранул [4]. Первый тип, гранулы G1, имеют диаметр 350 нм, содержат гомогенную плотную субстанцию; эти гранулы, вероятно, выделяют свое содержимое до того, как зрелый ооцит выходит из фолликула. Второй тип, гранулы G2, размером 450 нм, имеют гранулярное содержимое. При активации ооцита после проникновения сперматозоида содержимое кортикальных гранул G2 оказывается полностью вышедшим в перивителлиновое пространство в качестве дисперсного волокнистого материала.
Субкортекс ооцита насыщен многочисленными митохондриями, которые тесно связаны с крупными и мелкими гранулами гладкого эндоплазматического ретикулума (ГЭР), а также с агрегатами трубочек ГЭР. Область субкортекса содержит мейотическое веретено деления ооцита, которое имеет бочкоподобный вид и состоит из многочисленных микротрубочек тубулина, центриоль в материнской половой клетке не выявлена. В ооците веретено анастральное (без выраженных полюсов). Вместо полюсов – скопление изолированных мелких гранул ГЭР и изолированных трубочек ГЭР. Веретено деления часто окружено агрегатами трубочек и крупными гранулами ГЭР, связанными с митохондриями. В составе веретена деления два основных типа микротрубочек: отходящие от полюсов (полюсные) и от кинетохоров хромосом (хромосомные). Расхождение хромосом происходит в результате укорочения хромосомных микротрубочек, скольжения их относительно полюсов. Выброс первого полярного тельца с минимумом цитоплазмы возможен благодаря ассиметричному клеточному делению – асимметричное позиционирование веретена деления мейоза возникает в силу уникальной цитоскелетной архитектоники ооцита в процессе созревания [5].
В ооцитах различают две формы ГЭР: изолированные пузырьки и агрегаты трубчатых элементов. В клетках ГЭР вовлечен в метаболизм липидов и синтез стероидов, а также выработку и выброс кальция. ГЭР в ооцитах чувствителен к стимуляции гонадотропинами и становится гипертрофированным [6, 7].
Митохондрии находятся в ооплазме ооцита в большом количестве и распределены равномерно по всему объему клетки. Они расположены вокруг веретена деления и важны для клеточного деления, так как обеспечивают АТФ для активности микротрубочек, включая перемещение хромосом в анафазе I и II мейоза и цитокинез, который индуцируется активностью микрофиламентов. Митохондриальная дисфункция может приводить, таким образом, к абберантной хромосомной сегрегации, приводя к анеуплоидии в зрелых ооцитах. Во время дегенерации ооцита митохондрии могут приобретать внутренние плотные гранулы, лизосомы или иметь дезорганизованный матрикс [8]. Мембраны аппарата Гольджи встречаются довольно редко в зрелых ооцитах, хотя они находятся в изобилии в ооцитах на стадии GV (стадия зародышевого пузырька).
Центральная цитоплазматическая область изобилует многочисленными крупными гранулами ГЭР, связанными с митохондриями, и многочисленными мелкими гранулами ГЭР, либо связанными, либо локализованными свободно. Зрелый ооцит на стадии MII не имеет шероховатого эндоплазматического ретикулума.
Зрелые ооциты на стадии развития MII окружены интактной структурированной плазматической мембраной с многочисленными ее выступами – микроворсинками, которые имеют в своем строении остов из микрофиламентов, преимущественно составленных из актина. Основная функция микроворсинок – участие в питании и способствование проникновению сперматозоида в ооцит. Именно плазматическая мембрана женской половой клетки служит разграничительным барьером при оплодотворении и препятствует полиспермии. При оплодотворении микроворсинки окружают головку сперматозоида, способствуя его проникновению в ооцит. Получены единичные наблюдения, когда сперматозоид проникает в ооцит в области, лишенной микроворсинок [9].
При различных повреждающих воздействиях на ооцит происходит деформация и разрушение плазматической мембраны, а количество микроворсинок существенно снижается.
Зона пеллюцида (zona pellucida, ZP, блестящая оболочка) – внешняя оболочка ооцита, конгломерат из гликопротеинов, синтезируемых и секретируемых растущим ооцитом и клетками гранулезы, который утолщается по мере роста ооцита. ZP в процессе эволюции шла по пути усложнения, сперматозоиды человека способны связываться с ZP и проникать через оолемму только у высших приматов [10]. У человека зона пеллюцида состоит из четырех гликопротеинов, названных ZP1, ZP2, ZP3 и ZP4 [11, 12]. Эти гликопротеины синтезируются как длинные гликозилированные полипептидные цепи, которые требуют дальнейшего процессинга и протеолитического расщепления и полимеризации внутри аппарата Гольджи [13].
Клиническое наблюдение 1. Ооциты с грубозернистой деструкцией цитоплазмы
Пациентка, 36 лет, обратилась с жалобами на отсутствие беременности в течение 2,5 лет. Из анамнеза: менструации с 12 лет, через 28 дней, регулярные, умеренные, без особенностей; половая жизнь с 17 лет, предохранение барьерное (презерватив), комбинированные оральные контрацептивы в течение 4 лет; 3 беременности, закончившиеся медицинским абортом до 12 нед; рост 170 см, масса 55 кг. При эндокринологическом обследовании на момент обращения никаких отклонений гормонального профиля не выявлено (ЛГ=7,27 Ед/мл; ФСГ=9,85 Ед/мл; пролактин=10,84 нг/мл; тестостерон=1,98 нмоль/л; ТТГ=3,41 мкМЕ/мл). При ультразвуковом исследовании органов малого таза обнаружена диффузно-узловая форма аденомиоза с деформацией полости матки, миома матки небольших размеров. Поставлен диагноз: Бесплодие вторичное, эндометриоз. У мужа (38 лет) – не поддающаяся медикаментозной коррекции тератозооспермия. Показатели эякулята: концентрация сперматозоидов 36 млн/мл; подвижность (а+b)=50,5%; морфологически нормальные сперматозоиды – 0%; концентрация лейкоцитов 2 млн/мл. Супруги соматически здоровы. Супружеской паре было проведено лечение бесплодия по программе ЭКО-ИКСИ в коротком протоколе на фоне агониста гонадотропин-рилизинг гормона (диферелин, Beaufour-Ipsen International, Франция) 0,1/0,05 мг. Контролируемую овариальную стимуляцию проводили препаратом пурегон (Organon Ltd, Нидерланды) в суммарной дозе 1850 МЕ + менопур (Ferring A/S, Германия) в суммарной дозе 2075 МЕ в течение 10 дней. Триггер овуляции – прегнил (Organon Ltd, Нидерланды) в дозе 10 000 МЕ. При трансвагинальной пункции фолликулов получено 9 ооцитов, из которых 4 находились на стадии MII, 3 – MI, 2 – GV. Все аспирированные ооциты при их оценке на световом уровне (х100) после очищения от клеток кумулюса с помощью энзимной денудации (гиалуронидаза, Cook Medical, Дания) имели выраженную центральную гранулярность (рис. 2A). Из четырех зрелых ооцитов оплодотворение произошло только в одном, который и был перенесен в полость матки на 2-е сутки на стадии 2а (фрагментация отсутствует, 2 равных бластомера). Беременность не наступила. Незрелые ооциты были зафиксированы в день аспирации и отправлены на ультраструктурное исследование, которое выявило деструктивные изменения цитоплазматических компонентов: кластеризация органелл в клетке, набухание цистерн ГЭР, исчезновение митохондрий и их вакуолизацию. Наблюдаемые ультраструктурные деформации ооцита могут отражать деструктивные процессы, связанные с начавшимся апоптозом. Пациентке рекомендована программа ЭКО в естественном цикле.
Клиническое наблюдение 2. Ооциты с деформацией цитоскелета
Пациентка, 28 лет, обратилась по поводу отсутствия беременности в течение 9 лет. Из анамнеза: менструации с 15 лет по 4 дня через 28 дней. Рост 162 см, вес 52 кг. В 2010 г. проведен дриллинг яичников по поводу синдрома поликистозного яичника (СПКЯ). Гормональный профиль по данным лабораторного исследования: ФСГ=7,87 Ед/мл; ЛГ=6,49 Ед/мл; тестостерон=1,08 нмоль/л. После обследования выставлен диагноз: Бесплодие первичное, эндокринный фактор (СПКЯ, ановуляция). Для мужа данный брак второй. В первом браке детей нет. По результатам спермограммы: концентрация сперматозоидов в эякуляте 72 мл/мл, подвижность категории а=18%, в=15%, с=7%, d=60%; живые сперматозоиды 65%, 62% морфологически аномальных форм, астенозооспермия. Супруги соматически здоровы. Стимуляции суперовуляции была выполнена по протоколу с антагонистом гонадотропин-рилизинг гормона (гонал 1350 МЕ, цетротид 1 мг, прегнил 10 000 МЕ). Получено 15 ооцитов, все клетки имели деформацию оолеммы (рис. 2В). При выполнении ИКСИ ооциты сильно деформировались, однако оплодотворение происходило, перенос осуществляли на 5-е сутки развития на стадии бластоцисты (4АА, 4АА согласно международной классификации Гарднера). Наступила клиническая беременность одним плодом, которая в настоящий момент прогрессирует.
Клиническое наблюдение 3. Ооциты с деструкцией цитоплазмы
Пациентка, 40 лет, обратилась в 2013 г. по поводу отсутствия беременности в течение 8 лет. Из анамнеза: менструации с 14 лет, по 6–7 дней через 25–27 дней, умеренные, регулярные, безболезненные. Половая жизнь с 14 лет. По данным гинекологического осмотра аномалий развития наружных половых органов не выявлено, эндометриоз (коагуляция в 2010 г.). В анамнезе спонтанное прерывание беременности на сроке 8–9 нед после 5 лет бесплодия (беременность наступила самостоятельно). Рост 162 см, вес 63 кг, оволосение по женскому типу. В 2011 г. диагностирована гиперпролактинемия, получает каберголин в дозе ¼ таблетки 2 раза в неделю. По данным лабораторного исследования: ЛГ=5,6 Ед/мл; ФСГ=5,7 Ед/мл; пролактин=139 нг/мл; тестостерон=1,87 нмоль/л; ТТГ=1,04 мкМЕ/мл; АМГ=1,79Ед/мл; кортизол=390,5 нмоль/л. Пациентке выставлен диагноз: Бесплодие II, спаечный процесс в малом тазу, множественные миомы матки, трубно-перитонеальный фактор бесплодия, поздний репродуктивный возраст. Супруг 1972 г. рождения (41 год на момент вступления в программу ЭКО/ИКСИ). В результате анализа эякулята супруга установлена астенозооспермия. Данный брак для мужчины второй, в первом браке рождена дочь (пороки развития, детский церебральный паралич).
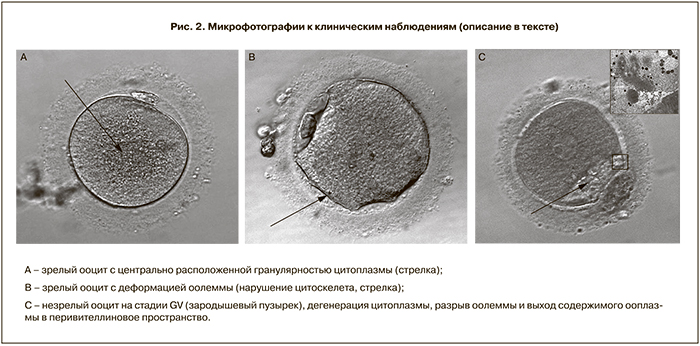
В 2013 г. проведена программа ЭКО, стимуляции овуляции по протоколу с антагонистом (гонал 1875 МЕ; цетротид 0,75 мг; прегнил 8 000 МЕ). При трансвагинальной пункции фолликулов получено 2 ооцита. После энзимного удаления клеток кумулюса была обнаружена дегенерация цитоплазмы обеих клеток (рис. 2С). Согласно данным электронно-микроскопического анализа, патология цитоплазмы представляет собой полное внутреннее разрушение ооцита: ооплазма повышенной плотности с набухшими везикулами ГЭР, дезорганизация цитоскелета, потеря микротрубочек, разброс кортикальных гранул, присутствие липофусциновых тел, гипертрофия трубочкового ГЭР. Пациентке рекомендована программа донорства ооцитов.
Заключение
Описанные клинические наблюдения показывают, что нарушения цитоплазматической организации ооцита могут влиять на процесс оплодотворения (часто делая его невозможным) и дальнейшее развитие эмбриона, которые не преодолеваются методом ИКСИ. Появление тяжелых дисморфизмов женских половых клеток часто связывают с развитием генетических, эпигенетических и метаболических нарушений. Именно поэтому для повышения эффективности программ ЭКО/ИКСИ таким пациенткам рекомендуют проведение преимплантационной генетической диагностики (скрининг) и/или программу донорства ооцитов.



