Проблема ведения беременности высокого риска продолжает оставаться актуальной во всех странах мира. Одной из причин может выступать развитие тромбоцитопенических синдромов на фоне беременности, которые представляют особый интерес, так как данная группа пациенток требует индивидуального подхода в отношении сохранения и ведения беременности.
Согласно статистическому анализу медицинской литературы, тромбоцитопения развивается у 5–10% беременных женщин [1], поэтому такие пациентки нуждаются в своевременном осуществлении диагностического поиска и лечения.
Тромбоцитопения определяется как количество тромбоцитов менее 150×109/л, что соответствует 2,5-му перцентилю нормального распределения уровня тромбоцитов, и чревата развитием геморрагического синдрома.
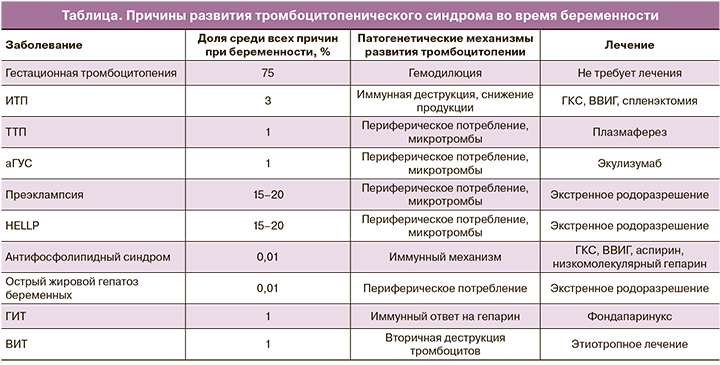
В акушерстве и гинекологии наиболее пристальное внимание уделяется гестационной тромбоцитопении (таблица). Данная тромбоцитопения считается самой распространенной причиной уменьшения количества тромбоцитов у беременных женщин, составляет около 75% всех случаев [2] и возникает чаще всего в конце II и в начале III триместра [3]. Особенно важно подчеркнуть, что патогенез еще окончательно не ясен, но может быть связан с гемодилюцией и/или ускоренным клиренсом тромбоцитов в плацентарном кровотоке [4, 5]. Как правило, пациентки чаще всего здоровы, в анамнезе отсутствуют данные о наличии каких-либо заболеваний, приводящих к геморрагическому синдрому; также нет клинических проявлений преэклампсии/HELLP-синдрома и других расстройств [1].
Необходимы серологические исследования на антинуклеарные антитела, антифосфолипидные антитела отрицательные, а физикальное обследование исключает артериальную гипертензию или другие причины тромбоцитопении, связанные с беременностью [1]. Диагноз тромбоцитопении беременных, по сравнению с иммунной тромбоцитопенической пурпурой, может быть поставлен ретроспективно, так как псевдоидиопатическая тромбоцитопеническая пурпура проходит после завершения беременности в течение 2 месяцев [3, 5]. Следует отметить, что пациентки не имеют высокого риска патологического течения беременности и родов, не требуют лечения, но нуждаются в периодическом мониторинге [3, 6].
Идиопатическая тромбоцитопеническая пурпура
В настоящее время значительный интерес представляют особенности течения, диагностики и лечения идеопатической тромбоцитопенической пурпуры (ИТП), развивающейся на фоне беременности. ИТП характеризуется наличием циркулирующих антител класса IgG к тромбоцитам, что приводит к секвестрации и деструкции тромбоцитов в селезенке и ретикулоэндотелиальной системе [3]. По имеющимся данным, ИТП выявляется у 1 из 1000 беременной женщины и составляет только 3% всех случаев тромбоцитопений во время беременности, но является наиболее распространенной причиной уменьшения тромбоцитов ниже 50×109/л, обнаруженных в I и II триместрах [1]. Количество тромбоцитов может упасть во время гестации, и от 15% до 35% матерей нуждаются в терапии до и во время родов [7, 8, 9]. ИТП редко ассоциируется с системной красной волчанкой и лекарственными средствами [10]. Клиническая манифестация у пациенток с тяжелой ИТП включает петехиальную сыпь, пурпуру или другие проявления, связанные с кровотечением [3].
На данный момент не существует золотого стандарта лабораторной диагностики ИТП, и диагноз устанавливается методом исключения [3, 11–13]. Так, рутинное измерение на наличие антител к тромбоцитам не рекомендуется, так как они могут быть обнаружены либо при ИТП, либо при гестационной тромбоцитопении. Специфичность данного исследования составляет около 80%, а чувствительность – около 60% [2]. В многочисленных работах подчеркивается, что если тесты отрицательные, то это не исключает ИТП [2, 3, 8]. Кроме того, исследования включают общий анализ крови, определение количества тромбоцитов и исследование периферической крови для исключения вторичных причин тромбоцитопении [6]. Путем анализа мочи и функциональных печеночных тестов исключают HELLP-синдром и преэклампсию, а тестирование на ВИЧ и вирусный гепатит С исключит вторичные причины [6].
Чаще всего клинической проблемой является дифференциальная диагностика между ИТП и гестационной тромбоцитопенией [6]. Это имеет особое значение для плода, так как из-за трансплацентарного прохождения антител ИТП может вызывать тромбоцитопению у плода, тогда как гестационная тромбоцитопения – нет [6]. В большинстве исследований, проведенных среди беременных женщин с ИТП, неонатальная тромбоцитопения возникает в 14% беременностей: 7,5% имеют тяжелую тромбоцитопению с количеством тромбоцитов менее 50×109/л [6, 7, 14]. Кроме того, 4% имели количество тромбоцитов менее 20×109/л, и поэтому они были подвержены высокому риску кровотечения при рождении [6].
Глюкокортикостероиды (ГКС) и внутривенные иммуноглобулины (ВВИГ) являются базисной терапией ИТП во время беременности [3, 6]. Механизм действия ГКС в лечении ИТП включает снижение продукции аутоантител и супрессию фагоцитарной функции ретикуло-эндотелиальной системы [15], а ВВИГ оказывают иммуномодулирующее действие, которое может включать нейтрализацию антитромбоцитарных антител, стимуляцию экспрессии рецептора Fc-гамма IIB, а также подавление Fc-гамма-опосредованного разрушения тромбоцитов [16]. По данным Sun D. et al., недавний ретроспективный обзор 235 беременностей и 195 женщин с ИТП показал, что лечение не требуется в 58% случаев [17]. Необходимо подчеркнуть, что половина пациенток была вылечена ВВИГ, вторая половина – ГКС [17]. Из 203 новорожденных с данными по тромбоцитам, 28% имели количество тромбоцитов при рождении менее 150×109/л и 9% – менее 50×109/л. Авторами было зарегистрировано два случая внутричерепных кровоизлияний у плода. Летальности не было [17].
С учетом того, что данные по отличию эффективности ГКС от ВВИГ отсутствуют, начальная терапия может быть основана, исходя из срока гестации и потенциальных побочных эффектов [2]. Как известно, лучше избегать использования ГКС в I триместре, так как имеется повышенный риск развития орофациальной расщелины неба [18]. На поздних сроках беременности прием матерью ГКС может усугубить течение гестационного сахарного диабета, гипертензии, ускорить развитие остеопороза [3, 19]. Оптимальная доза ГКС не определена, а начальная доза зависит от степени тромбоцитопении [2]. Важно отметить, что если нет желаемого эффекта от терапии ГКС в течение 24–72 ч, то может быть использована терапия ВВИГ. Таким образом, ожидается более быстрый подъем количества тромбоцитов, при этом терапевтический эффект непродолжителен – в среднем менее 2 недель [20]. Некоторые беременные пациентки невосприимчивы к ГКС и ВВИГ; в таком случае требуется «пульс»-терапия ГКС (метилпреднизолон) с и без ВВИГ [3]. Важно помнить, что алкалоиды, андрогены и большинство иммуносупрессивных средств не должны использоваться во время беременности. Однако применение азатиоприна, по мнению многих авторов, считается безопасным [3, 10]. Помимо базисных препаратов, в лечении ИТП используются ритуксимаб и спленэктомия. Спленэктомия применяется при рефрактерной форме ИТП, и проводить данную операцию рекомендуется во II триместре [10]. Применение ритуксимаба ограничено, так как данный препарат ведет к задержке созревания неонатальных В-лимфоцитов; в связи с этим производители рекомендуют воздерживаться от беременности во время и в течение 12 месяцев после его использования [10].
В клинической практике встречается целый спектр тромботических микроангиопатий, специфичных только для беременности, которые, как известно, обусловлены гипертензивными состояниями во время гестации. К ним относятся преэклампсия и HELLP-синдром. Рассмотрим эти нозологии отдельно, основываясь на данных литературы.
Преэклампсия и HELLP-синдром
Преэклампсия развивается приблизительно у 3–6% беременных [21, 22]. Пациентки с преэклампсией имеют высокий риск угрожающих жизни осложнений, приводящих к 10–15% материнской смертности во всем мире [23]. Преэклампсия ассоциируется с патологией и высокой смертностью плода, связанными с задержкой внутриутробного развития, маловодием и преждевременными родами [3]. Диагностические критерии для постановки диагноза преэклампсии включают в себя следующие: артериальное давление больше 140 и 90 мм рт. ст., возникшее после 20 недели гестации, у женщин с ранее нормальным артериальным давлением, протеинурия (0,3 г/сутки или 1 мг/л) и отеки, а также проявления полисистемной дисфункции [6, 24]. Как показал метаанализ Bartsch E. и соавт. [25], в который включены данные обследования более 25 миллионов беременных, к предрасполагающим факторам, ведущим к развитию преэклампсии, относят: высокий индекс массы тела, хроническую гипертензию, инсулинорезистентность, сахарный диабет, возраст <20 или >30 лет и антифосфолипидный синдром.
По данным литературы, у 15–50% пациенток с преэклампсией возникает тромбоцитопения, степень которой пропорциональна тяжести заболевания [26]. Патофизиологические механизмы развития тромбоцитопении при преэклампсии не до конца изучены. Предполагается, что тромбоциты могут активироваться при контакте с поврежденным эндотелием и/или субэндотелиальным матриксом в местах повреждения сосудов плаценты, с дальнейшим их удалением. Наиболее часто преэклампсия-ассоциированная тромбоцитопения может возникать перед другими основными клиническими проявлениями данного патологического расстройства. У пациенток с преэклампсией вместе с тромбоцитопенией может развиться и микроангиопатическая гемолитическая анемия [3]. Также эндотелиальная дисфункция ведет к снижению антитромботического потенциала в связи с нарушением образования тромбомодулина, тканевого фактора плазминогена, повышением агрегации тромбоцитов с развитием тромбоцитопении потребления с последующим развитием синдрома диссеминированного внутрисосудистого свертывания (ДВС)[27].
Стоит отметить, что в 20% случаев преэклампсия осложняется HELLP-синдромом, который также рассматривается в качестве тромботической микроангиопатии. HELLP-синдром (внутрисосудистый гемолиз, повышение уровня печеночных ферментов, тромбоцитопения) впервые был описан в 1954 г. Клинические проявления HELLP-синдрома у беременных не различаются с преэклампсией; следовательно, данный синдром рассматривают как тяжелый вариант преэклампсии. Необходимо особо выделить, что тромбоцитопения, ассоциированная с HELLP-синдромом, протекает тяжелее, чем при преэклампсии [3]. Исследователями Rinehart B. и соавт. [28] было отмечено, что скорость падения количества тромбоцитов считается предиктором возможной степени тяжести HELLP. При этом пациентки, у которых количество тромбоцитов уменьшалось более чем на 50×109/л в день, имели более высокую вероятность развития 1-го или 2-го класса HELLP. По-видимому, существует корреляция между степенью тромбоцитопении и степенью дисфункции печени у пациенток с HELLP-синдромом. Количество тромбоцитов достигает минимума примерно через 24 ч после родов, нормализация происходит в течение 6–11 дней [3].
Как и при преэклампсии, тромбоцитопения, возникшая при HELLP-синдроме, вероятно, имеет многофакторный патогенез. ДВС-синдром, который осложняет HELLP-синдром, возникает приблизительно в 6% случаев, в отличие от преэклампсии, хотя значительное снижение уровня фибриногена и повышенные уровни продуктов деградации фибрина, как правило, не наблюдаются до тех пор, пока количество тромбоцитов будет не меньше 50×109/л [29].
Актуальным вопросом остается терапия тромбоцитопении при преэклампсии и HELLP-синдроме [30]. Результаты рандомизированных исследований, проводимых Rose C. и соавт. [31], показали, что предродовое или послеродовое введение ГКС, а именно дексаметазона, приводит к более быстрой нормализации биохимических лабораторных показателей и повышению количества тромбоцитов у пациенток с HELLP-синдромом и повышает вероятность успешной индукции родов. Хотя рандомизированное исследование Chaturvedi S. и соавт. не показало преимуществ высоких доз метилпреднизолона в увеличении количества тромбоцитов у женщин с преэклампсией и тромбоцитопенией [3]. Более того, два проспективных рандомизированных плацебо-контролируемых испытания доказали, что послеродовое введение ГКС не приносило пользы пациенткам с тяжелой формой преэклампсии, у которых не было HELLP-синдрома [32], а также применение ГКС не уменьшало материнскую смертность [33].
Важно заметить, что выжидательная тактика может быть целесообразной для некоторых женщин, гестация которых менее 34 недель, и зависит от состояния матери. Однако женщины, при ведении которых применяли выжидательную тактику, оставались в группе высокого риска внезапного и тяжелого прогрессирования заболевания, включая ухудшение психического состояния, развитие ДВС-синдрома с сопутствующим кровотечением. В таком случае могут потребоваться экстренная доставка и поддерживающая терапия с переливанием эритроцитов, тромбоцитов и факторов свертывания крови. Немаловажным считается периодический мониторинг количества тромбоцитов и других лабораторных исследований, так как они могут быть полезны в определении срока и способа родовспоможения. У большинства женщин состояние улучшается вскоре после родов, а лабораторные показатели приходят в норму через некоторое время [1].
Тромботическая тромбоцитопеническая пурпура
Наиболее известным заболеванием из группы тромботических микроангиопатий является тромботическая тромбоцитопеническая пурпура (ТТП), или болезнь Мошковица. Беременность является важным провоцирующим фактором развития ТТП. Согласно данным Kentouche K. и соавт. [34] ,заболеваемость ТТП во время гестации равняется 1 на 100 000. В основе патогенеза данного заболевания лежит наследственный (синдром Апшоу–Шульмана) или приобретенный (образование антител к ADAMTS13 или ее ингибитора) дефицит протеазы ADAMTS13, участвующей в регуляции расщепления высокомолекулярных комплексов фактора фон Виллебранда на более мелкие мультимеры [35, 36].
Болезнь Мошковица характеризуется классической пентадой признаков: микроангиопатическая гемолитическая анемия, тромбоцитопения, лихорадка, флюктуирующие неврологические проявления и поражение почек [3, 10]. Тромбоцитопения чаще всего протекает крайне тяжело [33]. Следует обратить особое внимание, что с увеличением сроков беременности происходит прогрессирующее уменьшение ADAMTS13, поэтому беременность у больных болезнью Мошковица – крайне рискованная затея. Но при наличии беременности очень важна своевременная диагностика, потому что в таком случае материнская смертность может быть снижена на 80–90% [1].
Подозрение на ТТП возникает тогда, когда женщина с клиническими проявлениями тромботической микроангиопатии не соответствует критериям тяжелой формы преэклампсии или HELLP-синдрома, а также когда количество тромбоцитов ниже 20×109/л или при наличии неврологических симптомов, таких как слабость, онемение, афазия или явное нарушение психического статуса [37–39]. ТТП повышает риск развития преэклампсии, что затрудняет раннюю диагностику заболевания и может привести в итоге к летальности. Обилие шистоцитов (фрагменты эритроцитов), тромбоцитопения, повышение уровня лактатдегидрогеназы, снижение уровня ADAMTS13 в сыворотке крови способствуют диагностике ТТП, но они не всегда обнаруживаются на момент обследования [3].
Терапией выбора является применение свежезамороженной плазмы или плазмафереза и ГКС при антитело-индуцированной болезни Мошковица [1]. Нет доказательств того, что прерывание беременности улучшает состояние матери [40]. Результаты наблюдения за беременными с ТТП свидетельствуют о том, что гибель плода возникает вследствие распространенной ишемии плаценты в случае, когда ТТП развивается в I и II триместрах, а частота живорождения приближается к 75–90%, когда лечение матери от ТТП было успешным [41, 42]. Еще существуют публикации, в которых имеются рекомендации по применению ритуксимаба, азатиоприна или других супрессоров при рефрактерной к плазмаферезу антитело-индуцированной форме ТТП [42, 43].
Атипичный гемолитико-уремический синдром (аГУС)
Еще одним представителем тромботической микроангиопатии, не зависимой от беременности, но ею запущенной, является атипичный гемолитико-уремический синдром (аГУС), который, по данным литературы, развивается в 1 из 250 000 беременностей [43, 44]. Так, беременность является комплемент-активирующим состоянием, которое способствует развитию аГУС [45]. У 80% женщин, находящихся в зоне риска, развивается послеродовой аГУС, а остальные 20% распределены по всем триместрам. Центральным звеном патогенеза считается генерализованное тромбообразование в микроциркуляторном русле, связанное с неконтролируемой активацией комплемента. Диагноз аГУС становится очевидным тогда, когда в клинической картине у женщины имеют место прогрессирующая почечная недостаточность, тромбоцитопения, микроангиопатическая гемолитическая анемия, а также ишемическое повреждение тканей в отсутствие критериев преэклампсии/HELLP-синдрома [1].
Традиционно лечение аГУС комплексное, включая антикоагулянты, иммуносупрессивную терапию, плазмаферез, инфузию плазмы, но с низкой эффективностью [46]. Так, плазмаферез следует проводить сразу и продолжать до тех пор, пока ТТП не будет исключена [1]. От 55 до 80% эпизодов микроангиопатической гемолитической анемии, которая развилась из-за врожденного аГУС, отвечают на инфузию плазмы на фоне беременности, а пациентки с дефицитом фактора I часто трудно поддаются лечению [1]. Кроме того, менее убедительными считаются данные, что инфузия плазмы и плазмаферез предотвращают развитие терминальной стадии хронической почечной недостаточности при развитии аГУС на фоне беременности [46, 47]. По данным литературы, 80% матерей с аГУС требуется гемодиализ, а у 60–70% развивается терминальная стадия хронической почечной недостаточности [1]. Перспективным препаратом в лечении аГУС является экулизумаб. Механизм действия данного препарата связан с блокированием терминальной фазы комплемента при комплемент-зависимой тромботической микроангиопатии. Интересно отметить, что в исследовании применяли экулизумаб, который в итоге привел к полному восстановлению функции почек у женщин с послеродовым аГУС [48].
Острый жировой гепатоз беременных
Другой причиной возникновения тромбоцитопении, ассоциированной с беременностью, является острый жировой гепатоз беременных (ОЖГБ). ОЖГБ считается редким заболеванием с частотой 1 случай на 7000 беременностей, приводящим к материнской смертности примерно в 15% случаев [3]. Исходя из данных литературы, ОЖГБ чаще всего развивается в III триместре и проявляется тошнотой, болью в правом подреберье, недомоганием, желтухой и синдромом холестаза [49]. Первородящие женщины чаще подвержены возникновению острого гепатоза [1]. Тромбоцитопения у пациенток протекает слабо, среднее количество тромбоцитов составляет 88×109/л [49]. Так, материнские кровотечения, с одной стороны, связаны с тромбоцитопенией, а с другой – с развитием тяжелой коагулопатии на фоне снижения белково-синтетической функции печени, заключающейся в синтезе протромбина. Несмотря на то что зачастую сложно дифференцировать HELLP-синдром от острого гепатоза, сочетание печеночной недостаточности с гипогликемией, ДВС-синдромом или энцефалопатией чаще наблюдается при остром гепатозе беременных [1]. Терапия данных больных заключается в интенсивном поддерживающем уходе и лечении коагулопатии с последующим экстренным родоразрешением [3].
Гепарин-индуцированная тромбоцитопения
Гепарин-индуцированная тромбоцитопения (ГИТ) является потенциально смертельной реакцией на ведение препаратов, которая возникает в связи с терапией гепарином и представляет собой снижение тромбоцитов, а также парадоксальное увеличение тромботического риска из-за опосредованной антителами активации тромбоцитов [50]. В основе патогенеза ГИТ лежит иммунный ответ на гепарин. Патофизиологические механизмы связаны с тем, что тромбоцитарный фактор 4 выделяется из альфа-гранул и связывает гепарин и другие полианионы, образуя комплекс, против которого направлены антитела класса IgG. Также данные антитела активируют моноциты и эндотелиальные клетки, что приводит к увеличению экспрессии тканевого фактора и образования тромбина [51].
Подозрение на ГИТ может быть подтверждено с помощью традиционной и простой в использовании шкалы 4Т [52] или более новой HIT Expert Probability (HEP) [53]. Недавнее исследование не показало существенной разницы между шкалами [54]. С помощью шкалы 4Т оцениваются степень тромбоцитопении, время снижения количества тромбоцитов, тромбоз или другие осложнения, а также другие причины снижения тромбоцитов. После присвоения каждой из категорий 0, 1 или 2 балла, пациенты могут быть разделены на группы: низкий (0–3 балла), средний (4–5) и высокий (6–8) риск [55]. Как правило, лабораторное исследование включает выявление антител к тромбоцитарному фактору 4 [53], также выполняются функциональные тесты, к которым относятся тест на высвобождение серотонина и тест на гепарин-индуцированную активацию тромбоцитов [52].
Несколько факторов осложняют ГИТ и его лечение во время беременности, особенно гиперкоагуляция. Во время беременности гепарин, как известно, – препарат первой линии, и ГИТ встречается редко [56]. Клиническое подозрение на ГИТ требует немедленного прекращения приема гепарина и перехода на антикоагулянт без гепарина, что снижает риск возникновения тромбоза более чем на 50%. К альтернативным антикоагулянтам относят данапароид, фондапаринукс, аргатробан и бивалирудин. Во время беременности чаще всего обосновано использование фондапаринукса [57].
Вирус-индуцированная тромбоцитопения
Также к причинам возникновения тромбоцитопении относят вирус-индуцированную тромбоцитопению (ВИТ), которая чаще всего возникает на фоне ВИЧ-инфекции и вирусного гепатита С. ВИЧ-инфекция может индуцировать развитие тромбоцитопении за счет усиления периферической деструкции тромбоцитов из-за воздействий циркулирующих иммунных комплексов, содержащих антитела, реагирующие с аминокислотами GPIIIa, схожими с эпитопом nef-белка ВИЧ [58]. В свою очередь, вирусный гепатит С является еще одной распространенной инфекционной причиной вторичной иммунной тромбоцитопении [59].
Исходя из известных на сегодняшний день данных литературы, антифосфолипидный синдром может быть связан с развитием иммунной тромбоцитопении или микроангиопатической тромбоцитопении. Патогенетические механизмы появления тромбоцитопении, связанной с антифосфолипидными антителами, мультифакториальны и до сих пор не ясны. По-видимому, эти аутоантитела связываются с активированными тромбоцитами через b2-GP-I [60, 61]. Тромбоцитопения при антифосфолипидном синдроме также была связана с наличием антител к гликопротеидам, которые коррелируют более тесно, чем антифосфолипидные антитела и клинические проявления [62]. Лечебная тактика аналогична лечению ИТП, которое включает применение ГКС и ВВИГ, и может быть использована, когда уровень тромбоцитов ниже 30×109/л. Следует сопоставлять возможную потенциальную пользу от лечения тромбоцитопении у беременных с потенциальным риском тромбозов, а также выкидыша или преждевременных родов. Если в анамнезе есть данные о спонтанных абортах или тромбозах, пациентке следует назначить терапию в виде аспирина или низкомолекулярных гепаринов [63].
Заключение
Таким образом, вышеописанные заболевания и синдромы, объединенные между собой развитием тромбоцитопении во время беременности, представляют всеобщий научный и клинический интерес, потому что актуальным остается изучение механизмов развития тромбоцитопении и влияния беременности на данные механизмы.
Важной остается необходимость мультидисциплинарного подхода к их ведению со стороны врачей: акушеров-гинекологов, гематологов, анестезиологов, неонатологов и трансфузиологов, для снижения рисков развития осложнений со стороны матери и плода.



