Инфекции, передаваемые половым путем (ИППП), в настоящее время имеют неоспоримое социально-экономическое значение, что обусловлено высокими показателями заболеваемости и их негативным влиянием на репродуктивный потенциал населения. В Российской Федерации на первом месте по частоте выявляемости среди ИППП находятся урогенитальный трихомониаз и урогенитальная хламидийная инфекция, официальные показатели заболеваемости которыми в 2012 г. составили 94,1 и 61,4 случая на 100 000 населения соответственно [1].
Одной из причин высокой заболеваемости урогенитальными инфекциями является нерациональная фармакотерапия, а также рост устойчивости микроорганизмов к лекарственным препаратам. При этом частота развития резистентности и ее уровень существенно варьируют в зависимости от вида микроорганизма, химического состава препарата и применяемых режимов терапии.
Согласно данным современных исследователей, развитие лекарственной резистентности во многом связано со снижением активности нитроредуктаз микробной клетки и, соответственно, со снижением внутриклеточной биотрансформации препаратов. Развитие устойчивости может быть также обусловлено нарушением транспортных систем клетки (снижение проницаемости клеточной стенки у анаэробов и микроаэрофилов и клеточной оболочки у простейших), включая феномен выброса [2, 3].
C середины ХХ века и по настоящее время наиболее часто применяемым препаратом для терапии урогенитального трихомониаза являлся метронидозол, что, по данным ряда исследователей, привело к появлению метронидазол-устойчивых штаммов T. vaginalis. В последние годы все чаще описываются наблюдения неэффективности или малоэффективности терапии урогенитального трихомониаза, связанные с выработкой устойчивых форм возбудителя к данному препарату [4–6].
По мнению ряда авторов, лекарственная устойчивость T. vaginalis может быть обусловлена снижением активности пируват-ферродоксин-оксиредуктазы, что приводит к снижению накопления цитотоксических нитро-радикальных ионных интермедиатов [5, 7]. Другие исследователи утверждают, что резистентность может быть связана с нарушением транспортных систем клетки, включая феномен выброса, либо наличием в составе микробиоценоза урогенитальной системы микроорганизмов, способных захватывать нитрогруппы и тем самым снижать активность метронидазола [4, 6, 8].
В связи с появлением метронидазол-резистентных штаммов T. vaginalis представляется необходимым применение альтернативных противотрихомонадных препаратов из группы 5-нитроимидазолов, характеризующихся более высокой эффективностью, липофильностью, лучшей всасываемостью и меньшей токсичностью. Одним из таких является секнидазол, имеющий аналогичный с метронидазолом спектр действия. К основным конкурентным преимуществам препарата относятся: максимальный период полувыведения среди препаратов данной группы (около 20 ч, что значительно выше, чем у тинидазола – 12 ч и орнидазола – 14 ч), отличная переносимость и минимальные побочные эффекты.
Второе место по частоте распространенности среди ИППП в Российской Федерации занимает урогенитальная хламидийная инфекция. Неспецифичность симптомов и частое бессимптомное течение заболевания способствуют быстрому распространению C. trachomatis в популяции в связи с несвоевременностью обращения больных за медицинской помощью.
Попытки определения чувствительности хламидий к антибактериальным препаратам предпринимались с момента установления роли микроорганизма в патогенезе инфекционных заболеваний. Однако уникальность биологических особенностей C. trachomatis, а также наличие целого ряда методик выполнения исследований, отличающихся по виду используемых культур клеток, срокам инфицирования культуры клеток, процедурам оценки жизнеспособности хламидий после воздействия на них антимикробных препаратов, существенно влияют на результаты проводимых исследований. Кроме того, экспериментальные данные о чувствительности хламидий к разным группам антибактериальных препаратов, как правило, не коррелируют с клинической и лабораторной эффективностью терапии [9, 10, 11].
Многочисленными исследованиями установлено, что макролидные и тетрациклиновые антибактериальные препараты обладают высокой активностью против хламидий как in vitro, так и in vivo, и истинная резистентность C. trachomatis к препаратам данных фармакологических групп практически не наблюдается [9, 12]. Данный феномен связывают с тем, что появление генов резистентности у хламидий оказывает неблагоприятное влияние на способность мутантных микроорганизмов к выживанию, и клиническая неэффективность терапии хламидийной инфекции связана только с высокой частотой реинфицирования и низкой комплаентностью пациентов [13–16].
Препаратами выбора для лечения неосложненных форм урогенитальной хламидийной инфекции в настоящее время являются доксициклин, азитромицин и джозамицин. Азитромицин, обладающий способностью проникать внутрь клеток и создавать в них высокие концентрации, обеспечивает высокую эффективность терапии неосложненных форм хламидиоза при однократном применении.
Современными исследователями сообщается, что в последние годы возрастает роль условно-патогенных микроорганизмов в патогенезе воспалительных заболеваний мочеполового тракта. Нарушению микробиоценоза урогенитальной системы могут способствовать как эндогенные (гормональные нарушения, патологические изменения кишечного микробиоценза и др.), так и экзогенные факторы, в первую очередь инфицирование патогенными микроорганизмами. Одними из наиболее часто выявляемых условно-патогенных агентов при воспалительных заболеваниях мочеполовой системы являются грибы рода Candida. При этом, несмотря на внедрение в клиническую практику высокоактивных и малотоксичных антимикотических препаратов, в последние годы все чаще появляются сообщения о неудачах терапии, которые стали связывать с этиологической неоднородностью, увеличением частоты выявления более редких видов грибов (C. glabrata, C. krusei, C. parapsilosis) и их резистентностью к применяемым препаратам.
А.С. Анкирская и соавт. в исследовании чувствительности дрожжеподобных грибов, выделенных у женщин репродуктивного возраста, к противогрибковым препаратам установили, что за 6-летний период наблюдения число изолятов, чувствительных к изучаемым антимикотическим препаратам (флуконазолу, амфотерицину В, миконазолу, кетоконазолу, итраконазолу), среди C. albicans снизилось с 71,6 до 47,2%, а среди не-albicans видов – с 60 до 19,2% [17]. Однако многочисленные исследования, проведенные в различных странах, продемонстрировали отсутствие резистентности C. albicans к флуконазолу [18, 19], либо ее наличие у небольшого процента штаммов (2,1–3,6%) [20, 21].
Таким образом, в современных условиях роста резистентности патогенных и условно-патогенных микроорганизмов к лекарственным препаратам выбор схем терапии должен базироваться как на данных изучения клинической эффективности и безопасности препарата, так и на показателях устойчивости того или иного инфекционного агента к лекарственному средству. С учетом современных исследований показателей резистентности инфекционных агентов, комбинированный лекарственный препарат сафоцид, содержащий в своем составе азитромицин 1,0 г, секнидазол 2,0 г и флуконазол 150 мг, является оптимальным выбором в терапии ассоциированных неосложненных урогенитальных инфекций.
Цель исследования: изучение эффективности, безопасности и переносимости комбинированного препарата сафоцид в терапии ассоциированных урогенитальных инфекций.
Материал и методы исследования
С целью изучения эффективности, безопасности и переносимости препарата сафоцид проведено открытое прямое несравнительное исследование, в которое были включены 50 пациентов в возрасте от 18 до 45 лет. Все пациенты были разделены на 4 группы: 1-я группа – 8 больных бактериальным вагинозом и урогенитальным кандидозом, 2-я группа – 6 больных урогенитальным трихомониазом и бактериальным вагинозом и/или урогенитальным кандидозом, 3-я группа – 24 больных хламидийной инфекцией и бактериальным вагинозом и/или урогенитальным кандидозом, 4-я группа – 12 больных уретритами и/или цервицитами, вызванными M. genitalium и бактериальным вагинозом и/или урогенитальным кандидозом.
Основным критерием включения пациентов в исследование было наличие инфекционного процесса урогенитальной системы, вызванного ассоциацией патогенных и/или условно-патогенных микроорганизмов.
Комплекс лабораторных исследований включал проведение аминотеста и рН-метрии вагинального отделяемого, микроскопическое исследование материала, полученного из уретры, боковых и заднего сводов влагалища, цервикального канала; бактериологическое исследование для идентификации N. gonorrhoeae, T. vaginalis, условно-патогенных микроорганизмов; исследование методом полимеразной цепной реакции для идентификации C. trachomatis и M. genitalium; исследование на сифилис и ВИЧ методом иммуноферментного анализа. Лабораторные критерии бактериального вагиноза («ключевые клетки») и урогенитального кандидоза (преобладание вегетирующих форм грибов Candida – псевдомицелия и почкующихся дрожжевых клеток) оценивались при микроскопическом исследовании.
Результаты исследования и обсуждение
На момент обращения за медицинской помощью длительность заболевания у пациентов, включенных в исследование, составляла от 6 дней до 1,5 месяцев. Средний возраст больных составил 32±1,4 года, при этом все группы были сопоставимы по возрастному критерию.
Основными субъективными проявлениями урогенитальных заболеваний у обследованных являлись: патологические выделения из половых путей – у 47 (94%) больных, дизурия – у 21 (42%), диспареуния – у 29 (58%), зуд и/или жжение в области наружных половых органов – у 24 (48%) больных.
При физикальном обследовании клинические признаки уретрита (гиперемия, отек слизистой оболочки наружного отверстия уретры, патологические уретральные выделения) были выявлены у 18 (36%) больных, вульвовагинита (гиперемия, отек слизистой оболочки вульвы и/или влагалища, патологические вагинальные выделения) – у 21 (42%), цервицита (гиперемия, отек, кровоточивость слизистой оболочки экто- и/или эндоцервикса, патологические выделения из цервикального канала) – у 22 (44%) больных.
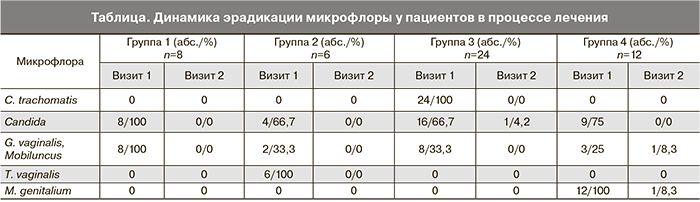
У 19 (38%) пациенток при проведении аминного теста были получены положительные результаты; значение рН вагинального экссудата превышало 4,5. По результатам лабораторных исследований у всех пациенток 1-й группы был диагностирован урогенитальный кандидоз в ассоциации с бактериальным вагинозом. У 2 (33,3%) пациенток 2-й группы урогенитальный трихомониаз был выявлен в ассоциации с бактериальным вагинозом и у 4 (66,7%) пациентов – в ассоциации с урогенитальным кандидозом; у 8 (33,3%) пациенток 3-й группы была диагностирована хламидийная инфекция нижних отделов мочеполового тракта в ассоциации с бактериальным вагинозом и у 16 (66,7%) пациенток – в ассоциации с урогенитальным кандидозом; у 3 (25%) пациентов 4-й группы – заболевания, вызванные M. genitalium, в ассоциации с бактериальным вагинозом и у 9 (75%) – в ассоциации с урогенитальным кандидозом. Было установлено, что у 2 больных возбудителем урогенитального кандидоза являлась Candida krusei, у остальных – Candida albicans (таблица).
Комбинированный препарат сафоцид назначали перорально однократно для всех 4 таблеток, входящих в состав блистера, за 1 час до еды или через 2 часа после еды. Визитом 1 считался день получения результатов лабораторных анализов, и в этот же день пациентка получала терапию препаратом сафоцид.
Оценка эффективности и безопасности применения препарата проводилась через 7–10 дней после окончания терапии для пациентов 1-й и 2-й групп (визит 2) и через 28 дней – для пациентов 3-й и 4-й групп (визит 2). Профиль безопасности определялся по совокупности показателей клинических анализов крови и мочи и биохимического исследования крови.
При контрольном обследовании клиническая эффективность терапии (отсутствие субъективных и объективных симптомов заболевания) была достигнута у 87,5% пациентов 1-й группы, у 100% – 2-й, у 95,8% – 3-й и у 91,6% – 4-й. Субъективные проявления в виде диспареунии у пациентки 4-й группы были расценены как поствоспалительные симптомы, при повторном обследовании через 1 неделю пациентка не предъявляла жалоб со стороны урогенитальной системы. У 1 пациентки 3-й группы при контрольном обследовании были выявлены клинические признаки кандидозного вульвовагинита, у 1 пациентки 4-й группы – клинические признаки бактериального вагиноза, аналогичные таковым до назначения терапии.
Эрадикация возбудителей ИППП (T. vaginalis, С. trachomatis, M. genitalium) была достигнута у 49 (98%) обследованных (у 100% пациентов произошла эрадикация T. vaginalis, С. trachomatis, у 1 пациента из 4-й группы при контрольном обследовании была выявлена M. genitalium). При контрольном обследовании ни в одном наблюдении у пациенток 1-й и 2-й групп не было выявлено отклонений от нормы при микроскопическом и микробиологическом исследованиях. У 1 (4,2%) пациентки 3-й группы были выявлены лабораторные признаки кандидозного вульвовагинита, таким образом, эффективность терапии урогенитального кандидоза составила 97,3% (на 1-м визите урогенитальный кандидоз был у 37 пациентов, на 2-м визите – только у 1 пациента). У 1 (8,3%) пациентки 4-й группы были выявлены клинико-лабораторные признаки бактериального вагиноза (положительный аминотест, рН>4,5, «ключевые клетки» при микроскопическом исследовании), таким образом, эффективность терапии бактериального вагиноза составила 95,3% (на 1-м визите бактериальный вагиноз был у 21 пациентки, на 2-м визите – только у 1 пациента) (таблица).
При мониторинге показателей жизненных функций, анализов крови и мочи и биохимических анализов крови клинически значимых отклонений от нормальных показателей не было выявлено ни у одной из обследованных. У 1 (2%) пациентки были зарегистрированы нежелательные лекарственные явления в виде тошноты, которые самопроизвольно разрешились в течение 1 дня после приема препарата.
Комплаентность проведенной терапии была зарегистрирована в 100% наблюдений.
Заключение
В настоящем исследовании комбинированный препарат сафоцид показал выраженную эффективность в терапии урогенитальных инфекционных заболеваний, ассоциированных с патогенными и условно-патогенными микроорганизмами. Согласно полученным данным, применение секнидазола, входящего в состав препарата, позволило достичь эрадикации T. vaginalis у 100% больных трихомонадной инфекцией. Благодаря антианаэробному действию компонента эффективность терапии бактериального вагиноза, составила 95,3%. Азитромицин также продемонстрировал высокие показатели клинико-лабораторной эффективности в отношении возбудителя хламидийной инфекции и M. genitalium.
В настоящем исследовании был установлен единичный случай неэффективности терапии урогенитального кандидоза флуконазолом – третьим компонентом препарата сафоцид, при этом необходимо отметить, что в данном случае этиологическим агентом заболевания являлась C. krusei, которая, в отличие от других представителей грибов рода Candida, в большом количестве различных наблюдений демонстрировала устойчивость к препаратам азолового ряда.
В результате проведенной терапии удалось достичь эрадикации патогенных возбудителей у 98% пациентов. Сафоцид может быть рекомендован для терапии ассоциированных неосложненных урогенитальных инфекций как препарат, показавший низкую частоту развития побочных эффектов, удобство в применении и обеспечивающий высокие показатели комплаентности.



