Рак шейки матки (РШМ) остается одной из самых распространенных форм злокачественных новообразований и занимает 2-е место в структуре онкогинекологической заболеваемости после рака эндометрия. Ежегодно в мире регистрируется 528 000 новых случаев РШМ и 266 000 смертей от этого заболевания. В России за 2017 г. выявлено 17 587 первичных пациенток. Это почти на 50% больше, чем 20 лет назад. Показатели смертности от РШМ растут в среднем на 4,5% за год и составляют 8,2 на 100 000 женского населения [1]. Также в последнее время отмечен рост заболеваемости у женщин молодого возраста (15–39 лет). Смертность в данной группе за 20 лет также выросла на 85,2% [2]. Связано это, вероятно, с распространенностью вируса папилломы человека (ВПЧ) и недостаточно хорошо внедренным скринингом РШМ.
Значительная часть женщин (62%) на момент постановки диагноза имеют II–IV стадии РШМ [3]. Лечение этих больных, согласно рекомендациям NCCN 5.2019 [4], должно проводиться с использованием сочетанной химиолучевой терапии. Несмотря на положительный эффект от проводимой терапии, двойное токсическое воздействие со стороны химиопрепаратов и ионизирующего излучения зачастую ведет к осложнениям со стороны здоровых органов и тканей. Химиопрепараты могут способствовать угнетению миелопоэза, оказывать гепато-, нейро-, нефро- и кардиотоксичность, снижая тем самым качество жизни пациентки [5]. В последнее время в развитых странах все шире используется метод химиоэмболизации (ХЭ).
Первые попытки внутрисосудистых вмешательств были предприняты в нейрохирургии в середине 1920-х гг. для лечения сосудистой мальформации, при которой ни перевязка шейных сосудов, ни лучевая терапия не были эффективны. Существенный вклад в развитие интервенционной хирургии внес Dr. Seldinger [6] – шведский радиолог, который в 1953 г. предложил способ катетеризации артерий по проводнику.
В 1930 г. Brooks [7] сообщил об успешной эмболизации каротидно-кавернозной фистулы, что может считаться первым случаем терапевтической эмболизации. До начала 1970-х годов методику Сельдингера использовали во многих перспективных направлениях. Например, при чрескожной селективной ангиографии с внутриартериальной инфузией вазопрессина при желудочно-кишечных кровотечениях [8].
В 1972 г. Rosch [9] с той же целью впервые применил селективную артериальную эмболизацию, которая в дальнейшем активно развивалась при кровотечениях из органов малого таза.
В гинекологии селективную артериальную эмболизацию маточных артерий (ЭМА) для остановки послеродовых кровотечений впервые применил Oliver J. [10] в 1979 г., после чего данный метод стал использоваться повсеместно. Первые попытки эмболизации с использованием химиопрепарата были предприняты в 1973 г. Regensberg C. и соавт. [11]. Авторы сообщили об успешном применении смеси кариолизина, гемостатической губки и тромбовара для ХЭ печеночной артерии.
В 1974 г. Doyon [12] во Франции выполнил первую эмболизацию печеночной артерии именно для лечения злокачественной опухоли печени. Тогда же появились сообщения об успешной перевязке печеночной артерии после введения 5-фторурацила в воротную вену у пациентов с метастатическим поражением печени. Методика была признана безопасной, так как на фоне значимых положительных эффектов (уменьшение боли, уменьшение размеров метастатических узлов, некроз опухоли по данным биопсии) не было зафиксировано ни одного случая инфаркта печени [13].
С конца 1970-х гг. широко используется введение адриомицина, митомицина, 5-фторурацила в печеночную артерию с последующей ее эмболизацией, а в начале 1980-х гг. методика получает название «химиоэмболизация».
В онкогинекологии первые внутрисосудистые вмешательства выполнили Yong-Song Guan и соавт. в 1992 г., использовав внутриартериальную химиотерапию для лечения РШМ [14].
Эффект от ХЭ реализуется двумя путями: нарушение питания опухоли за счет прекращения ее кровоснабжения и химиотерапевтическое воздействие, при котором отсутствует фактор лимитирования дозы ввиду отсутствия системного воздействия. Повышенная концентрация химиопрепарата в опухоли способствует более выраженному цитотоксическому эффекту, снижая общую токсичность для организма.
В современной онкологии для ХЭ применяются специальные частицы-носители – микросферы (созданные в 2000 г. на основе суперабсорбирующего полимера (ShinichiHori)), которые способны сначала накапливать химиопрепарат, а потом высвобождать его в течение длительного времени. Наиболее распространенные препараты – HepaSpheres (Biosphere Medical, France), DC Bead (Biocompatibles, UK), Contour (Boston scientific), Bead Block (Terumo, Japan).
В настоящее время не существует единого мнения о том, какой препарат лучше использовать при проведении интраартериальной химиотерапии либо ХЭ. В литературе чаще обсуждается эффективность следующих цитостатиков: гемцитабин, доксорубицин, таксотер, карбоплатин, цисплатин, оксалиплатин [15]. При проведении ХЭ логичным представляется рассматривать препараты, имеющие агрегатную форму лиофилизата, что обусловлено необходимостью их разведения в рентгеноконтрастном препарате. Согласно рекомендациям общества National comprehensive cancer network NCCN [16], препаратами первой линии для лечения рака РШМ являются цисплатин, паклитаксел, карбоплатин, топотекан. Из вышеперечисленных необходимое агрегатное состояние имеет лишь топотекан.
Учитывая высокую эффективность препаратов платины, целесообразно будет рассмотреть альтернативные режимы, в частности алкилирующий агент оксалиплатин. К сожалению, на сегодняшний день еще не накоплен достаточный опыт, позволяющий сделать однозначное заключение об эффективности данного цитостатика при проведении внутриартериальной химиотерапии или ХЭ у больных первичным РШМ. С другой стороны, данный препарат широко используется для лечения рецидивирующего РШМ в качестве второй линии терапии при развитии резистентности к цисплатину и карбоплатину.
Интраартериальное введение химиопрепаратов должно быть более эффективным по сравнению с внутривенным, так как большинство злокачественных опухолей шейки матки на момент установки диагноза имеет локализованную форму. При этом селективное введение препарата непосредственно в сосуды, питающие опухоль, позволяет обеспечить сравнительно лучшую биодоступность при нивелировании токсичности, которой подвергаются здоровые ткани при внутривенном введении. Выбор концентрации также остается спорным вопросом. Исследований, подтверждающих эффективность той или иной дозировки, нами обнаружено не было.
Цель нашего исследования – оценить эффективность методики суперселективной химиоэмболизации (СХЭ) при местнораспространенном РШМ.
Материалы и методы
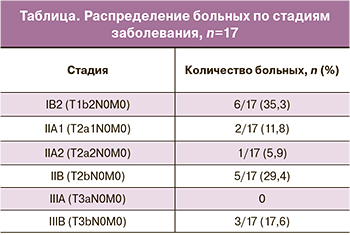 В исследование вошли 17 женщин в возрасте от 34 до 63 лет (средний возраст составил 55,4 года), получавшие лечение в ГБУЗ «Санкт-Петербургский клинический научно-практический центр специализированных видов медицинской помощи (онкологический)» в период с 2015 по 2018 гг. Все пациентки имели плоскоклеточную форму РШМ различной степени дифференцировки. Стадирование производили по системе TNM восьмого пересмотра. Распределение по стадиям представлено в таблице.
В исследование вошли 17 женщин в возрасте от 34 до 63 лет (средний возраст составил 55,4 года), получавшие лечение в ГБУЗ «Санкт-Петербургский клинический научно-практический центр специализированных видов медицинской помощи (онкологический)» в период с 2015 по 2018 гг. Все пациентки имели плоскоклеточную форму РШМ различной степени дифференцировки. Стадирование производили по системе TNM восьмого пересмотра. Распределение по стадиям представлено в таблице.
Большую часть составили пациентки с IB2 и IIB стадиями (35,3 и 29,4% соответственно). Имели IIIB стадию 3 (17,6%) пациентки за счет наличия инфильтратов до стенок таза. Больных с метастазами в лимфатических узлах, а также с IV стадией заболевания в исследование не включали.
В постменопаузе РШМ был диагностирован у 14/17 (82,4%), в репродуктивном возрасте – у 3/17 (17,6%) пациенток.
Значительная часть больных имела сопутствующие заболевания. Сахарным диабетом страдали 4/17 (23,5%), гипертонической болезнью – 17/17 (70,5%), ожирением – 9/17 (53,1%) больных. Отчасти именно распространенностью терапевтической патологии в старших возрастных группах продиктована необходимость поиска новых подходов к лечению местнораспространенных форм РШМ, которые позволили бы минимизировать последствия радикального лечения.
Для ХЭ применяли лекарственно-насыщаемые микросферы Hepaspheres. Их размер в ненасыщенном состоянии составляет 50–100 мкм, после насыщения препаратом – 200–400 мкм. Химиопрепаратом выбора послужил оксалиплатин в дозировке 100 мг. Во-первых, препараты платины традиционно считаются группой выбора для лечения плоскоклеточного РШМ. Во-вторых, его агрегатное состояние (лиофилизат) позволяет добиться необходимой концентрации при насыщении эмбосфер. Разведение оксалиплатина в контрастном препарате необходимо для ангиографического контроля распределения микросфер, насыщенных лекарственным препаратом, в ходе выполнения СХЭ опухолевых сосудов шейки матки.
На наш взгляд, одним из недостатков ряда методик эмболизаций является недостаточно высокая эффективность доставки лекарственно-насыщаемых микросфер в опухоль шейки матки. При ХЭ непосредственно маточных артерий лекарственный препарат попадает через обширную сеть коллатералей в здоровые отделы тела матки, маточных труб и яичников, что может приводить к развитию ишемии и некроза их тканей, а также последствиям, связанным с токсическим действием цитостатиков. Особенностью нашей методики является то, что на первом этапе проводится ХЭ цервикальных артерий с целью создания локального депо лекарственно-насыщаемых микросфер, которые в дальнейшем мигрируют в мельчайшие сосуды, питающие опухоль шейки матки. Далее с целью предотвращения попадания лекарственно-насыщаемых микросфер в правую яичниковую артерию и здоровые отделы тела матки производят суперселективную перераспределительную эмболизацию восходящей ветви правой маточной артерии (дистальнее отхождения правой цервикальной артерии) фрагментами гемостатической губки до полной окклюзии. После этого выполняется ХЭ ствола маточных артерий до субокклюзии. Завершающим этапом проводится контрольная ангиография из бассейна внутренних подвздошных артерий с целью оценки адекватности ХЭ. В месте пункции бедренной артерии осуществляется гемостаз в течение 10 мин и на 8 ч накладывают давящую асептическую повязку.
Оценку распространенности опухолевого процесса на догоспитальном этапе, а также через 3 недели после ХЭ выполняли по результатам магнитно-резонансной томографии (МРТ) с контрастированием с использованием критериев RECIST 1.1. Пациентки с признаками вторичного поражения лимфатических узлов в исследование не включались.
Результаты
Уменьшение размеров опухоли отмечено у всех больных. Стабилизации удалось добиться в 4/17 случаев у больных с IB2 стадией. Частичный ответ зафиксирован у 2/17 больных. Это позволило всем пациенткам выполнить хирургическое вмешательство в объеме радикальной гистерэктомии С1 в соответствии с классификацией Querleu–Morrow. Следует отметить, что операции сопровождались сравнительно незначительной кровопотерей, что, по-видимому, обусловлено снижением перфузии после эмболизации.
При IIA стадии частичный ответ наблюдали в 2/17 случаях. Данным пациенткам также удалось выполнить радикальную гистерэктомию через 3 недели после ХЭ. У 1 больной установлена стабилизация процесса. Ей был проведен радикальный курс сочетанной химиолучевой терапии без хирургического вмешательства. Суммарная очаговая доза от дистанционной и брахитерапии составила 60 Гр. По результатам гистологического исследования рестадирование произведено в 1 случае. У 1/17 пациентки на догоспитальном этапе по данным МРТ лимфоузлы были интактны. По данным окончательного гистологического исследования выявлен метастаз в одном лимфатическом узле. Таким образом, стадия была изменена c IIA2 на IIIB (pT2a1N1M0).
При IIIB стадии во всех случаях отмечена стабилизация процесса (уменьшение размеров опухоли на 13, 5 и 6% соответственно). Хирургическое вмешательство данной группе больных не проводилось. Лечение было дополнено радикальным курсом сочетанной химиолучевой терапии. Суммарная очаговая доза составила 60 Гр. В 1/17 случае удалось добиться ремиссии заболевания, в остальных 2/17 отмечен частичный ответ.
Применение описанной методики во всех случаях позволило избежать системной токсичности химиотерапии, что объясняется крайне низкой концентрацией оксалиплатина в крови.
Адъювантное лечение проводили в соответствии с рекомендациями Европейского общества онкогинекологов (ESGO, 2018 г.).
Медиана наблюдения составила 29 месяцев. На момент написания статьи 14/17 пациенток были живы. Погибли от прогрессирования 3/17 пациентки. Все они на момент постановки диагноза имели IIIB стадию заболевания.
В нашем исследовании не было отмечено осложнений, связанных с самой процедурой интервенционного вмешательства, хотя известно, что их частота может достигать 3% [17]. Благодаря вышеописанным особенностям методики, полностью удалось избежать осложнений, связанных с нарушением питания органов малого таза (матки, придатков).
Болевой синдром различной интенсивности, связанный с развитием ишемических изменений в зоне вмешательства, развился в раннем послеоперационном периоде у 16/17 (94%) больных. Продолжительность болевого синдрома составила 3–7 дней с пиком интенсивности на 4–5-е сутки. В большинстве случаев его удавалось купировать нестероидными противовоспалительными средствами, однако 2/17 пациентам потребовалось назначение наркотических анальгетиков. Кроме того, в течение первых суток после операции у 3/17 пациенток отмечали вегетативные реакции в виде тошноты, сопровождаемой рвотой, 1–3 раза в сутки. Данная симптоматика легко купировалась назначением метоклопрамида и инфузионной терапией. Лейкоцитоз в первые 24 ч после операции развился у 13/17 (76,5%), при этом клинически значимые изменения (более 12×1012) зафиксированы у 4/17 больных. Суммарно постэмболизационный синдром развился примерно в половине (47%) случаев.
Также применение описанной методики во всех случаях позволило избежать системной токсичности.
Обсуждение
Мы представили наш небольшой опыт лечения больных местнораспространенным РШМ. Все пациентки хорошо перенесли интервенционное вмешательство, без выраженной токсичности или тяжелых осложнений. Частота рецидивов не превышала таковую при альтернативных методах лечения, таких как сочетанная лучевая или химиолучевая терапия.
Традиционно химиотерапия при РШМ назначается системно. Это позволяет уменьшить размер опухоли и, в ряде случаев, перевести неоперабельную форму РШМ в операбельную. Однако в литературе в последнее время встречается все больше публикаций о преимуществе внутриартериального введения, позволяющего воздействовать непосредственно на опухоль [18]. Так, например, Scarabelli и соавт. [19] сообщают о частоте ответа на лечение 84–92%. Ряд авторов утверждают, что неоадъювантная интраартериальная химиотерапия не увеличивает общую выживаемость, а лишь только в некоторых случаях снижает необходимость адъювантного лечения [20]. Это можно объяснить невысокой концентрацией цитостатиков в крови и, как следствие, отсутствием системного воздействия. Таким образом, отдаленные микрометастазы не подвергаются воздействию химиотерапии.
К недостаткам ХЭ можно отнести необходимость находиться в вынужденном положении в течение нескольких часов после вмешательства, частая необходимость в адекватной анальгетической терапии, сравнительно частое развитие постэмболизационного синдрома. Но следует заметить, что данные недостатки сложно назвать существенными, а осложнения без труда купируются даже в амбулаторных условиях.
В нашем исследовании недостаточный эффект от лечения зафиксирован в группе пациенток с IIIB стадией. Это может быть связано с развитием обширной системы коллатералей по мере распространения опухолевого процесса.
Клинический пример
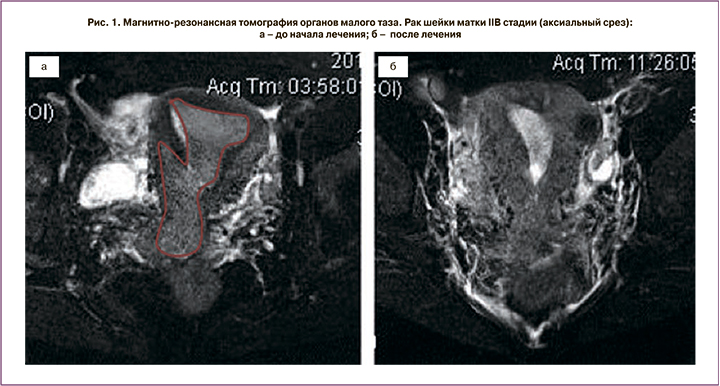
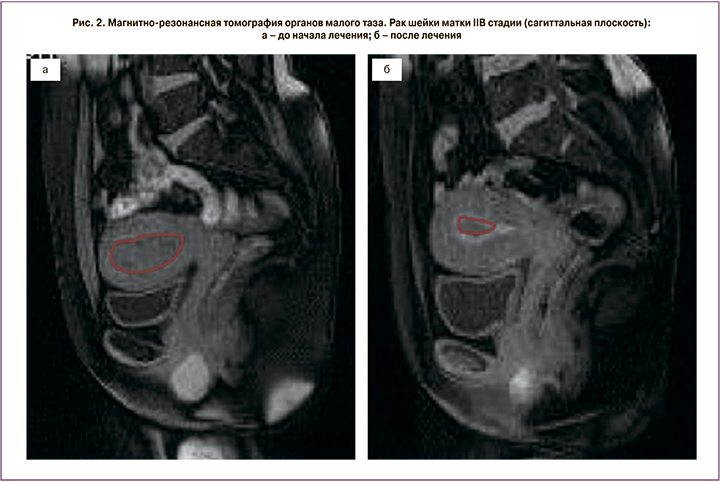
Пациентка Д., 43 лет, обратилась с жалобами на боли внизу живота, кровянистые выделения из половых путей различной интенсивности. При обследовании установлен диагноз РШМ IIB стадии. Биопсия подтвердила плоскоклеточный гистотип опухоли. По данным МРТ малого таза опухоль максимальным размером 67 мм распространялась на тело матки и инвазировала клетчатку параметрия справа. Была выполнена двусторонняя ХЭ маточных сосудов лекарственно-насыщаемыми микросферами Hepaspheres. В качестве цитостатика использовали препарат оксалиплатин в дозировке 100 мг.
В послеоперационном периоде болевой синдром купировали применением нестероидных противовоспалительных средств. В лабораторных показателях отмечался лейкоцитоз до 14×1012. Пациентка была выписана домой спустя 3 дня после вмешательства.
Через 3 недели после операции выполнена МРТ малого таза с контрастированием. Эффект от лечения расценен как частичный ответ (рис. 1, 2), что позволило провести хирургическое лечение в объеме операции Вертгейма, после чего пациентка получила адъювантный курс лучевой терапии. По настоящее время рецидива не зарегистрировано, время наблюдения составило 26 месяцев.
Заключение
В настоящее время еще не накоплен достаточный опыт, позволяющий сделать однозначные выводы об эффективности СХЭ. Однако известен тот факт, что данная методика включает все преимущества интраартериальной химиотерапии, одновременно позволяя избегать негативного влияния последней и рассчитывать на положительный результат.



