Как известно, миома матки является доброкачественной опухолью, которая развивается в мышечном слое, представлена клетками гладкомышечной ткани и относится к гормонозависимым опухолям [1, 2]. Известно, что на скорость роста миомы матки влияют эстрогены и прогестерон, которые имеют в опухоли специфические рецепторы: α и β-рецепторы к эстрогенам, А и В-рецепторы к прогестерону [3]. Миомы матки возникают у каждой второй женщины после 30 лет [2, 4–6]. Среди женщин репродуктивного возраста частота миомы составляет до 40%, а в возрасте постменопаузы увеличивается до 50% и выше [1, 2].
Для правильного выбора тактики лечения и получения желаемого результата необходимо учитывать имеющиеся факторы риска: возраст, репродуктивный анамнез, фенотип и генотип. Анализ факторов риска в группах пациенток с миомой матки позволяет создать «портрет пациентки, имеющей миому матки» и правильно подойти к выбору тактики и метода терапии.
Целью нашего исследования стало создание «портрета» пациентки, имеющей миому матки для выбора адекватной ее терапии, направленной на сохранение яичникового резерва.
Материал и методы исследования
Обследованы 79 пациенток с миомами матки. Возраст обследуемых был в широких пределах от 24 до 53 лет, что в среднем составило 40,5±3,7 года. В возрасте от 20 до 29 лет было 2 пациентки (2,5%); 30–39 лет – 32 пациентки (40,5%); 40–49 лет – 37 пациенток (46,8%); в возрасте 50 лет и старше – 8 пациенток (10,2%). У всех обследуемых выяснялся соматический, гинекологический и репродуктивный анамнез. Всем пациенткам проводился осмотр шейки матки в зеркалах и двуручное влагалищно-брюшностеночное исследование, при необходимости дополняющееся двуручным прямокишечно-влагалищным исследованием органов малого таза. В качестве дополнительного метода исследования использовался лучевой метод диагностики: ультразвуковое исследование (УЗИ) на аппаратах экспертного класса. При этом определяли толщину эндометрия до начала терапии и после ее окончания, подсчитывали число антральных фолликулов на 2–3-й дни менструального цикла с целью определения овариального резерва, определяли объем тела матки и миоматозных узлов, а также размеры тела матки и диаметр миоматозных узлов. Кроме этого, проводились клинико-лабораторные исследования, включающие общий анализ крови, биохимический анализ крови: печеночные пробы, липиды крови, коагулограмму, которые определяли натощак после 12 часов голода. Также определяли в динамике показатели гормонального фона: лютеинизирующий гормон (ЛГ), фолликулостимулирующий гормон (ФСГ), антимюллеровый гормон (АМГ), ингибин В с целью выяснения овариального резерва до начала терапии улипристала ацетатом и после завершения лечения. Гормоны определяли согласно протоколу на 2–3-й дни менструального цикла, натощак, после 12 часов голодания, с 08.00 до 09.00 часов.
Всем пациенткам в качестве терапии первой линии назначалась эсмия (улипристала ацетат) в стандартной дозе 5 мг ежедневно, начиная с 1–7-го дней менструального цикла, в разных режимах. Из 79 обследованных пациенток у 12 (15,2%) эсмия назначалась в качестве предоперационной подготовки в течение 3 месяцев (I группа). Только прием эсмии без оперативного вмешательства был у 67 (84,8%) пациенток: 45 (57,0%) из них принимали эсмию в течение двух последовательных курсов по 3 месяца с перерывом в течение 2 месяцев (II группа); 22 (27,8%) пациентки – в течение 3 месяцев по одной таблетке ежедневно (III группа).
Результаты исследования и обсуждение
Как указано в материалах и методах, средний возраст обследованных пациенток с миомой матки составил 40,5±3,7 года. При этом средний возраст в группе от 20 до 29 лет был 26,0±1,0 года; в возрасте от 30 до 39 лет – 35,2±1,7 года; в возрасте 40–49 лет – 44,1±1,4 года и в возрасте 50 лет и старше – 51,5±0,9 года. Надо сказать, что наиболее часто среди обследованных нами миома матки выявлена в возрасте 36–38 лет (25,0% обследованных) и в возрасте 40–45 лет (34,4% обследованных пациенток). Согласно данным научной литературы, частота миомы повышается с возрастом, особенно после 40 лет, что может быть обусловлено стимуляцией стероидными гормонами за предшествующий репродуктивный период [7–10].
Средний возраст российских женщин, которым проведено оперативное лечение по поводу миомы матки, составляет 40 лет. Среди жительниц Краснодарского края частота миом матки увеличивается после 40 лет в 1,7 раза. Доказано снижается частота диагностирования миом матки в постменопаузальном периоде [7]: среди наших землячек показатель снижения составил 42,5%, что, возможно, связано с отсутствием гормональной стимуляции после наступления менопаузы.
Нами проанализировано становление менструальной функции среди обследованных женщин. Оказалось, что средний возраст наступления менархе составил среди них 12,2±1,7 года. При этом в группе 20–29-летних менархе начались в 11,9±0,3 года; у 30–39 летних – в 12,0±1,2 года; у 40–49 летних – в 12,2±1,7 года; у 50 летних и старше – в 13,0±1,4 года. Таким образом, чем моложе пациентка с миомой матки, тем раньше у нее начинается первая менструация. Ранняя менструация повышает число клеточных делений, характерное для миометрия в репродуктивный период, что способствует повышенному риску мутаций в генах, которые отвечают за пролиферацию миометрия [7]. При этом для обследованных с миомами матки характерным является наличие маточных кровотечений: у 53 пациенток (67,1%) были обильные менструации, а у 17 (21,5%) – ациклические кровотечения. Проведенные нами ранее исследования выявили нарушения менструального цикла у 79,1% среди пациенток с миомой матки в возрасте перименопаузы [11–13].
Число пациенток, имеющих в анамнезе беременности, было 67 (84,8%). Рожали из них 49 пациенток, что составило из общего числа обследованных 62,0%, а из числа имеющих беременности в анамнезе – 73,1%. Считают, что число родов влияет на частоту миом матки обратно пропорционально. Риск возникновения миом матки у рожавших снижается на 50% [7, 14]. По данным литературы у нерожавших частота ановуляторных циклов бывает выше, чем у рожавших, что способствует усилению выработки эстрогенов в повышенном количестве и ведет к росту миом [15]. Артифициальные аборты, которые увеличивают частоту ановуляторных циклов, среди обследованных были у 51 пациентки – 64,6%. Это в основном женщины в возрасте 40 лет и старше – 44 пациентки (55,7% всех обследованных и 86,3% сделавших артифициальные аборты). Вовсе не было родов у 30 пациенток (38,0%). Среди имеющих в анамнезе беременности не рожали 26,9%.
В своих исследованиях G.P. Flake и соавт. (2003) обнаружили взаимосвязь повышения массы тела и индекса массы тела (ИМТ) с увеличением частоты диагностирования миомы матки: риск миомы повышается на 21% при увеличении массы тела на 10 кг (при повышении ИМТ на единицу – увеличение массы тела происходит на 6%). Среди обследованных нами пациенток повышенная масса тела выявлена у 74,2%, что, возможно, связано с метаболизмом эстрогенов [7]. При этом у 27 (34,2%) пациенток была повышенная масса тела: ИМТ от 25,0 кг/м2 до 29,9 кг/м2; а у 20 (25,3%) было ожирение: ИМТ был от 30,0 кг/м2 до 34,9 кг/м2. Только одна пациентка (1,3%) имела ИМТ ниже 18,5 кг/м2. Таким образом, нормальный ИМТ имели 39,2% – 31 пациентка с миомами матки. Важным моментом в изучении патогенеза миом матки является тот факт, что физические нагрузки сокращают риск развития миом матки на 40% [14]. Из числа опрошенных пациенток только 5 (6,3%) регулярно занимались спортом.
Нельзя обойти стороной семейный анамнез: среди пациенток – жительниц Краснодарского края отягощенная наследственность выявлена у 47,3%.
Экстрагенитальная патология, особенно артериальная гипертензия, атеросклероз и сердечно-сосудистые заболевания за счет общей патологии гладкомышечной ткани, способствующей пролиферации гладкомышечных клеток матки и сосудов [14], повышают частоту повреждения миометрия или сосудистых структур. Частота сердечно-сосудистых заболеваний среди наших обследованных составила 54,4%. При этом чаще всего встречалась артериальная гипертензия разной степени тяжести: у 38 из 43 пациенток, страдающих данной патологией (88,4%). Кроме этого, часто встречались заболевания желудочно-кишечного тракта и печени – у 37 пациенток (46,8%), а также эндокринные заболевания – у 17 (21,5%) пациенток. Полученные нами ранее данные о наличии экстрагенитальной патологии у пациенток с миомой матки в перименопаузальном возрасте полностью соответствуют полученным результатам [11–13].
Гинекологическая патология среди наших пациенток была выявлена в 100%. При этом частота сочетания миомы матки и хронических воспалительных процессов органов малого таза составила 70,9% (56 пациенток), что совпадает с нашими данными, полученными в 2006–2007 гг. [11–13].
В своих работах и G.P. Flake и соавт. (2003), M. Viswanathan и соавт. (2007) [7, 14] связывают курение женщин со снижением риска возникновения миом матки за счет уменьшения продукции и уровня циркулирующих в организме эндогенных эстрогенов. Мы в своем исследовании отметили следующее: курящих женщин среди обследованных было 47 (59,5%), а страдающих сердечно-сосудистыми заболеваниями среди них – 37 (46,8%). Среди 43 страдающих сердечно-сосудистыми заболеваниями не курили только 6 пациенток. С нашей точки зрения, развивающийся эндотелиоз сосудов на фоне курения способствует росту сердечно-сосудистой патологии и, соответственно, увеличению частоты диагностирования миом матки, несмотря на то, что курение большого числа сигарет снижает продукцию и уровни циркулирующих эндогенных эстрогенов. По данным G.P. Flake и соавт. (2003), M. Viswanathan и соавт. (2007), так может проявляться двойственный эффект прямого торможения никотином [7, 14].
Таким образом, «портрет» пациентки с миомой матки, проживающей на территории Краснодарского края, можно представить следующим образом: это женщина старше 36 лет (средний возраст 40,5±3,7 года); с началом функционирования менструальной функции в 12,2±1,7 года; с увеличением частоты диагностирования миомы матки после 40 лет практически в 2 раза; снижением частоты ее диагностирования в постменопаузе на 42,5%; большинство обследованных имеют беременность в анамнезе (84,8%) и повышенную массу тела (74,2%); страдают в 54,4% сердечно-сосудистыми заболеваниями; в большинстве своем – курящие (59,5%).
Несомненно, при любом методе лечения миомы основным является возможность сохранения матки и фертильности пациентки. Известно, что с этой целью используют как хирургические методы, так и консервативные. Выбор лечения зависит от выраженности симптомов, объема узла/узлов, их локализации, возраста пациентки, желания сохранить репродуктивную функцию. К хирургическим методам относится миомэктомия, к консервативным – медикаментозная терапия, эмболизация маточных артерий, миолиз или криомиолиз, фокусированная ультразвуковая аблация опухоли под контролем МРТ, допплер-контролируемая окклюзия маточных артерий, лапароскопическая окклюзия маточных артерий. Совсем недавно для медикаментозного лечения и профилактики миомы были доступны практически только агонисты гонадотропин-рилизинг гормонов (аГнРГ), антагонисты гонадотропин-рилизинг гормонов, внутриматочная рилизинг-система, комбинированные гормональные контрацептивы, прогестины, антигестагены. Все перечисленные препараты имеют и преимущества, и недостатки, которые могут привести к таким грозным осложнениям, как остеопения, остеопороз (при использовании аГнРГ). Эта терапия не рассматривается в качестве долгосрочной и необходимы ограничения ее использования при нерешенной генеративной функции. Консервативное лечение сегодня – это воздействие препарата на рецепторы прогестерона, которые существуют в двух изоформах: А и В и широко распространены в половых органах, в молочных железах, костной и сердечно-сосудистой системах, в мозге, что приводит к активации транскрипции [15–18]. Сегодня есть доказательства, что клетки миоматозных узлов экспрессируют функциональные рецепторы прогестерона, уровень несвязанных рецепторов прогестерона в узлах выше, чем в миометрии и связывание их в 3 раза выше, чем в миометрии. При этом клетки миомы чувствительны к прогестерону [19].
Имеющийся собственный двухлетний опыт терапевтического воздействия на миому матки иновационного препарата улипристала ацетата, позволяет нам говорить об изменении подходов к терапии миом. Улипристала ацетат обладает антагонистическими и агонистическими свойствами по своему воздействию на рецепторы прогестерона в зависимости от ткани-мишени [15, 17, 20–23], воздействуя путем активации и подавления транскрипции. Этот препарат относят к классу селективных модуляторов прогестероновых рецепторов (СМПР).
СМПР подавляют овуляцию, сохраняя физиологическую концентрацию эстрадиола, что способствует сохранению яичникового резерва за счет отсутствия эстроген-дефицитных состояний. Частично снижаются гонадотропные гормоны, при этом влияния на другие гормоны гипофиза не происходит [16].
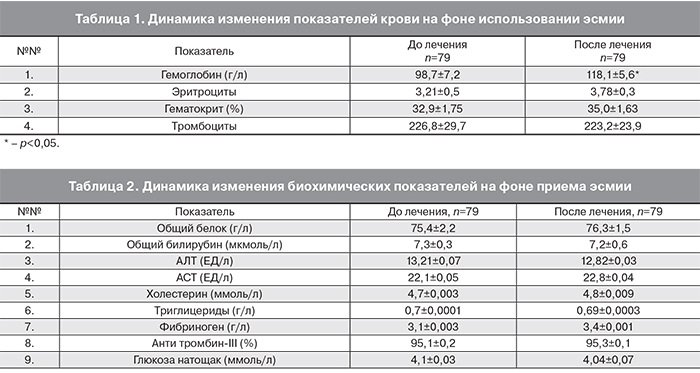
Наблюдение за пациентками, составившими 3 группы исследования, показало следующие результаты. Отмечено достоверное улучшение показателей общего анализа крови среди всех пациентов (79 обследованных) через 3 месяца использования эсмии, что нашло отражение в табл. 1. При исходной анемии у 67 пациенток (84,8%) назначалась противоанемическая терапия препаратами 3-валентного железа Fe3+.
Анализ приведенных в таблице данных позволяет сделать следующий вывод: использование эсмии в сочетании с противоанемической терапией, приводит к нормализации показателей крови и лечению анемии: имеется достоверная разница в показателях гемоглобина до и после лечения.
Сравнение биохимических показателей до и после лечения продемонстрировало отсутствие негативного влияния приема эсмии в течении 3 месяцев на печеночные пробы, липиды крови и показатели свертывающей системы, а также уровень глюкозы натощак (табл. 2).
Анализ полученных данных не выявил достоверных изменений биохимических показателей, что позволяет нам сделать вывод о безопасности использования эсмии у пациенток с миомами матки.
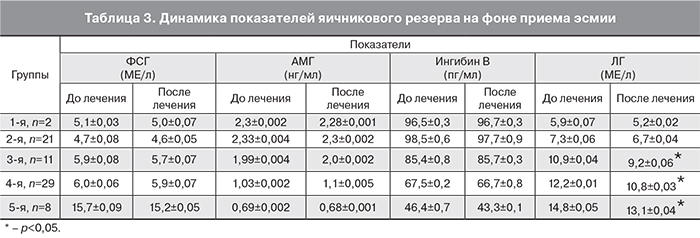
Наибольший интерес, с нашей точки зрения, имели исследования яичникового резерва: показателей ФСГ, ЛГ, АМГ, ингибина В. Так как среди обследованных нами 79 пациенток 8 были в возрасте 50 лет и старше, из исследования они были исключены. Всего в динамике мы обследовали 71 пациентку (89,9%). Согласно приведенным выше данным, в возрасте от 20–29 лет было 2 пациентки, 30–39 – 32 пациентки и 40–49 лет – 37 пациенток. По возрасту мы их разделили на 5 групп: 1-я группа (20–29 лет) – 2 пациентки (2,8%); 2-я группа (30–34 года) – 21 пациентка (29,6%); 3-я группа (35–39 лет) – 11 пациенток (15,5%); 4-я группа (40–44 года) – 29 пациенток (40,8%), и 5-я группа (пациентки 45–49 лет) – 8 пациенток (11,3%). В табл. 3 приведены данные об изменении показателей яичникового резерва среди разновозрастных женщин, принимающих в течение 3 месяцев эсмию. Уровень гормонов определяли перед началом приема эсмии и после ее окончания.
Проведенный нами анализ не выявил достоверной разницы внутри возрастных групп в уровне гормонов, определяющих яичниковый резерв, а именно ФСГ, АМГ и ингибин В. Изначально нормальные их показатели не изменялись на фоне 3-месячной терапии улипристала ацетатом. Таким образом, мы можем сделать вывод, что остающиеся достоверно неизмененными данные гормоны среди обследованных нами пациенток, указывают на отсутствие негативного влияния эсмии на уровень яичникового резерва среди разновозрастных пациенток с миомами матки. При этом в 3-й, 4-й и 6-й группах, то есть в возрасте от 35 до 50 лет, достоверно изменился уровень ЛГ. Это указывает на влияние ЛГ за счет прямого антипролиферативного и апоптотического действия на процесс развития аменореи. Отсутствие клинических данных, указывающих на дефицит эстрогенов, подчеркивает преимущество СМПР в лечении миомы матки.
Интенсивность боли у пациенток до и после терапии определялась по визуальной аналоговой шкале (ВАШ): до начала терапии боль оценивалась в 5,7±1,4 балла, после окончания приема эсмии боль не беспокоила – 0 баллов по ВАШ.
Данные УЗИ подтвердили полученные нами результаты: уменьшение объема матки произошло от 5,2 до 73,3%. Только у одной пациентки снижение объема матки произошло в 3,75 раза: с 53,2 до 14,2 см3 – на 73,3%. Среднее уменьшение объема матки составило среди всех обследованных 11,8±2,7%, что подтверждается данными УЗИ (рис. 1 и 2, см. на вклейке).
На представленных рисунках узел уменьшился в объеме через 3 месяца терапии на 45,9%: размеры узла первоначально составляли 151,93 см3, а после терапии улипристала ацетатом в течение 3 месяцев его объем стал 82,25см3.
Подсчет числа антральных фолликулов показал, что оно в процессе терапии у пациенток репродуктивного возраста (1–4-е возрастные группы) не изменилось, что также подтверждает отсутствие негативного эффекта на яичниковый резерв и расширяет возможности терапии эсмией у пациенток раннего и позднего репродуктивного периодов, особенно у не решивших свою детородную функцию.
Также отмечали уменьшение толщины эндометрия: если до начала приема эсмии толщина эндометрия на 25–27-й дни менструального цикла составляла 12,1±1,2 мм, то после 3 месяцев терапии – 6,4±1,4 мм.
У 12 пациенток, которым была сделана операция после 3-месячной подготовки эсмией, уменьшение размеров миоматозных узлов произошло на 37,4±4,7% у 9 пациенток (75,0%), у 2 (16,7%) размер узлов не изменился, а у одной пациентки отмечен рост миоматозных узлов на 3,7%. Двенадцати пациенткам произведена миомэктомия: у 5 – путем лапаротомии (41,7%), у 4 – путем лапароскопии (33,3%). Кровопотеря при лапароскопическом доступе составила в среднем 14,6±3,8 мл; при лапаротомическом – 57,4±9,3 мл. Послеоперационный период протекал без осложнений. Трем пациентам по совокупности показаний произведена гистерэктомия (25,0%), также без осложнений послеоперационного периода.
45 пациенткам без оперативного лечения назначался повторный курс эсмии после 2-месячного перерыва. При этом отмечено снижение объема матки еще на 4,7±1,5%, что в среднем от начала лечения составило 16,5%. Контроль показателей гормонов: АМГ, ФСГ и ингибина В после повторного курса эсмии не выявил отклонений в показателях яичникового резерва у пациенток репродуктивного возраста.
Заключение
Таким образом, пациентки с миомой матки сегодня – это женщины репродуктивного возраста со своевременным началом менструальной функции. Они характеризуется в большинстве случаев наличием беременности в анамнезе (84,8%), не имеют родов (38,0%), имеют повышенную массу тела (74,2%). Большинство из них страдает сердечно-сосудистыми заболеваниями (54,4%) и курят (59,5%).
Возможность использования при этом терапевтических методов лечения снижает риски послеоперационных осложнений, а в отдельных случаях – позволяет отказаться от операции.
При необходимости проведения миомэктомии предварительная терапия эсмией позволяет снизить кровопотерю и препятствовать развитию послеоперационных осложнений.
Отсутствие негативного влияния эсмии на состояние яичникового резерва позволяет рекомендовать СМПР в качестве терапии выбора у пациенток с нерешенной репродуктивной функцией.



