Многоводие – это патологическое состояние, сопровождающееся увеличением объема амниотической жидкости. Диагноз ставится на основании измерения высоты дна матки (при превышении размера на 3 недели от нормы) и данных ультразвукового исследования (УЗИ). Критерием диагностики является увеличение индекса амниотической жидкости (ИАЖ) ≥24 см или глубины наибольшего кармана ≥8 см. В зависимости от глубины кармана выделяют легкое (ИАЖ 25–29,9 см или величина максимального кармана 8,0–11,0 см), умеренное (ИАЖ 30–34,9 см или размер максимального кармана 12–15 см) и тяжелое (ИАЖ более 35 см или величина кармана более 16 см) многоводие [1].
Распространенность многоводия в общей акушерской популяции колеблется от 1 до 2% [1–5]. Частота встречаемости зависит от гестационного возраста на момент проведения УЗИ, выборки и различий в используемых критериях. Например, в исследовании 93 000 одноплодных беременностей многоводие было выявлено в 0,7% случаев, а по степени тяжести было легким, средним или тяжелым в 66, 22 и 12% соответственно [1].
Объем амниотической жидкости отражает баланс между ее образованием и абсорбцией, которая реализуется за счет транс- и внутримембранного транспорта (перенос через амнион в кровоток матери и плода), глотания и мочеиспускания плода [1–3]. В I триместре амниотическая жидкость представлена секретом амниотической оболочки, а после 16 недель – преимущественно мочой плода и полностью обновляется каждые 3 ч.
Среди причин многоводия выделяют материнские (сахарный диабет, инфекционные заболевания, изоиммунизация), плацентарные (хорионангиома), плодовые (фето-фетальный трансфузионный синдром, врожденные пороки развития, хромосомные аномалии, наследственные болезни) и идиопатические.
Приблизительно 40% всех случаев многоводия, диагностированного в антенатальном периоде, относят к идиопатическому; однако после родов у 25% детей выявляются те или иные аномалии (анемия, синдром Барттера, инфекции и нервно-мышечные расстройства) [6, 7].
По характеру течения многоводие может быть острым и хроническим. Острое встречается крайне редко, примерно в 1 случае на 3888–14 383 родов, возникает в сроках 16–27 недель беременности и чаще всего является проявлением развития фето-фетального трансфузионного синдрома или воздействия вирусной инфекции [7]. Хроническое многоводие диагностируется от 0,17 до 2,8% случаев, чаще развивается в III триместре беременности и имеет более стертую клиническую картину.
Идиопатическое легкое многоводие чаще всего разрешается спонтанно и имеет доброкачественное течение [8, 9].
Роль инфекционного фактора в этиологии многоводия обсуждается очень широко и актуализирована в связи с пандемией новой коронавирусной инфекции. До 30% женщин с многоводием перенесли ранее инфекционные заболевания, а по данным гистологического исследования у них в плацентах присутствуют признаки перенесенного воспаления (децидуит, виллузит, интервиллузит, хорионит) [7].
Стойкое многоводие связано с повышенным риском развития таких акушерских осложнений, как дыхательная недостаточность у матери, преждевременный разрыв плодных оболочек, преждевременные роды, неправильное положение плода, выпадение петель пуповины, преждевременная отслойка плаценты, слабость родовой деятельности и послеродовое гипотоническое кровотечение [10–12].
Идиопатическое многоводие повышает риск неонатальной заболеваемости и смертности [13]. Лечение многоводия зависит от срока беременности, тяжести осложнения и наличия акушерских симптомов. При легком и умеренном многоводии проводится динамическое наблюдение (кардиотокография, допплерометрия) каждые 1–2 недели до 37 недель, а затем еженедельно с 37 недель до родов. При тяжелом многоводии рекомендовано наблюдение в условиях акушерского стационара. Согласно рекомендациям общества медицины матери и плода (SMFM), антенатальное наблюдение за плодом при легком идиопатическом многоводии не требуется [14].
При тяжелом многоводии (ИАЖ≥35 см или наибольший карман ≥16 см) проводится декомпрессионный амниоцентез (амниоредукция) с целью снижения дискомфорта у матери, риска отслойки плаценты и преждевременных родов. Однако нет доказательств того, что процедура снижает риск спонтанных преждевременных родов [15].
В крупнейшем опубликованном исследовании, включившем 138 беременных с многоводием и амниоредукцией, у 46% пациенток потребовалось проведение более 1 процедуры, средняя продолжительность от первой процедуры до родов составила 26 дней, а в 4% случаев в течение 48 ч произошли преждевременные роды [15].
В сроке до 32 недель и при отсутствии выраженных симптомов у матери проводится курс терапии индометацином в сочетании с профилактикой респираторного дистресс-синдрома (РДС) у плода. Стандартная схема составляет 25 мг перорально 4 раза в день в течение 48 ч. Препарат разрешен к применению в сроке до 32 недель [16].
При наличии одышки или тяжелого многоводия проводится амниоредукция. SMFM рекомендует рассматривать амниоредукцию только как процедуру для облегчения дискомфорта и одышки у матери и воздержаться от использования индометацина с единственной целью уменьшения количества амниотической жидкости [16].
С 32 до 34 недель индометацин не рекомендован, поэтому назначается токолиз нифедипином в сочетании с курсом профилактики РДС плода. После 34 недель при высоком риске преждевременных родов целесообразно проведение поздней профилактики РДС до 36+6 недель.
Амниоредукция (декомпрессионный амниоцентез) не требует проведения антибиотикотерапии, но при тяжелом многоводии проводится профилактический курс терапии препаратами пенициллинового ряда. Единовременно не рекомендовано удаление более 2–2,5 л и быстрее чем 1000 мл за 20 минут [17]. Процедуру прекращают при достижении показателя ИАЖ 15–20 см или глубины максимального кармана <8 см [18]. Частота осложнений (преждевременные роды, преждевременный разрыв плодных оболочек, отслойка плаценты, внутриамниотическая инфекция, гипопротеинемия) составляет от 1 до 10% [15, 17].
После амниоредукции проводятся мониторинг ИАЖ, кардиотокография и допплерометрия 1 раз в неделю. Повторные процедуры можно выполнять с любым интервалом. В среднем для стойкого снижения объема околоплодных вод необходимы две процедуры с интервалом не менее 7 дней [17].
У пациенток с легким и умеренным идиопатическим многоводием роды индуцируют в сроке от 39+0 до 40+0 недель [14, 18]. Американский колледж акушеров-гинекологов рекомендует родоразрешение в сроки от 39+0 до 40+6 недель [19]. Пациенткам с тяжелым идиопатическим многоводием проводят индукцию родов в 37+0 недель, чтобы свести к минимуму риск отслойки плаценты, выпадения пуповины и антенатальной гибели плода.
Целью исследования явилась оценка эффективности комбинированной терапии пациенток с вирус-индуцированным многоводием.
Материалы и методы
Было проведено наблюдательное исследование, включившее 82 пациентки. Критериями включения явились следующие.
1. Наличие умеренного многоводия по данным УЗИ при одноплодной беременности в сроке 24–32 недели.
2. Спонтанное наступление беременности.
3. Отсутствие пороков развития и хромосомных аберраций у плода.
4. Перенесенная вирусная инфекция в период за 1–4 недели до появления многоводия.
5. Отсутствие у матери значимой соматической патологии (ожирение, истинный и гестационный сахарный диабет, аутоиммунные заболевания, патология щитовидной железы).
6. Отсутствие резус-сенсибилизации.
7. Подписанное информированное согласие пациентки на участие в исследовании.
8. Отсутствие известных аллергических реакций и непереносимости компонентов препарата «Суперлимф».
Пациентки были разделены на основную группу (n=52), в которой проводилось комплексное лечение с применением индометацина 25 мг 4 раза в сутки 3 дня и свечей «Суперлимф» 10 ЕД 2 раза в сутки (ректально) 10 дней, и группу сравнения (n=30), сформированную на основании архивного материала Видновского перинатального центра за период 2021–2022 гг., в которой проводилась антибактериальная терапия амоксициллином или цефалоспоринами I поколения. Все пациентки группы сравнения на время лечения были госпитализированы. В основной группе терапия проводилась амбулаторно у 88,46% (46/52) пациенток.
Активным веществом препарата «Суперлимф» является белково-пептидный комплекс свиных лейкоцитов (Центр Иммунотерапии «Иммунохелп»), представляющих собой универсальный стимулятор иммунной системы с активностью фактора, угнетающего миграцию макрофагов, интерлейкина-1, интерлейкина-6, фактора некроза опухоли, трансформирующего фактора роста, секретируемых лейкоцитами периферической крови свиньи. Препарат зарегистрирован как иммуномодулятор, обладает противовирусным и противомикробным действием, стимулирует функциональную активность клеток фагоцитарного ряда, активирует фагоцитоз, выработку цитокинов, индуцирует противоопухолевую цитотоксичность макрофагов, регулирует миграцию клеток в очаг воспаления и увеличивает активность естественных киллеров, обладает антиоксидантной активностью, снижает развитие воспалительных реакций, стимулирует регенерацию и эпителизацию раневых дефектов. Препарат разрешен к применению во время беременности (код EAN: 4640008270034 № ЛС-000148, 2010-06-02).
Частота многоводия, согласно данным Видновского перинатального центра, в 2021 г. составила 4,36% (273/6256 родов), а в 2022 г. – 4,42% (268/6059 родов), что свидетельствует о стабильных показателях за исследуемый период.
Комплексное обследование пациенток включало: сбор анамнеза, оценку соматического и гинекологического статуса, выявление специфики менструальной и репродуктивной функции, а также характера течения и исходы данной беременности. Всем женщинам были проведены антропометрические измерения на медицинских электронных весах «Seca 766/767» с расчетом индекса массы тела с последующей интерпретацией согласно рекомендациям ВОЗ.
УЗИ являлось основным методом диагностики многоводия; его проводили всем пациенткам при поступлении и в динамике на фоне терапии. УЗИ выполняли на аппарате WS80A-RUS компании Samsung Medison. Использовали конвексный датчик CA1-7A (1–7 МГц, угол обзора 70°, монокристальный), внутриполостной датчик EA2-11В (2–11 МГц, угол обзора 150°) и линейный датчик L3-12A (3–12 МГц, апертура 50 мм).
Морфологическое исследование последов проводилось на базе отделения патоморфологии перинатального центра. На исследование направлялся послед с пуповиной целиком. Для гистологического исследования из центральной части плаценты вырезали участок 2×2 см и фиксировали в 10% растворе нейтрального формалина. После стандартной гистологической проводки изготавливались срезы, которые окрашивались гематоксилином Майера и эозином с последующей оценкой гистологического строения плаценты.
Статистический анализ
Статистическая обработка выполнялась с использованием пакета программ Statistica for Windows 10.0 (StatSoft Inc., США). Количественные показатели представляли средним значением (М). Качественные признаки указывали в виде абсолютных чисел и относительных величин (в процентах). Полученные данные проходили проверку на нормальность распределения. Результаты считались значимыми при уровне вероятности ошибки р<0,05.
Результаты
Возраст пациенток основной группы был от 24 до 40 лет (М=31), в группе сравнения – от 22 до 41 лет (М=33), р=0,24. Данные о гинекологическом, соматическом и акушерском анамнезе приведены в таблице 1.
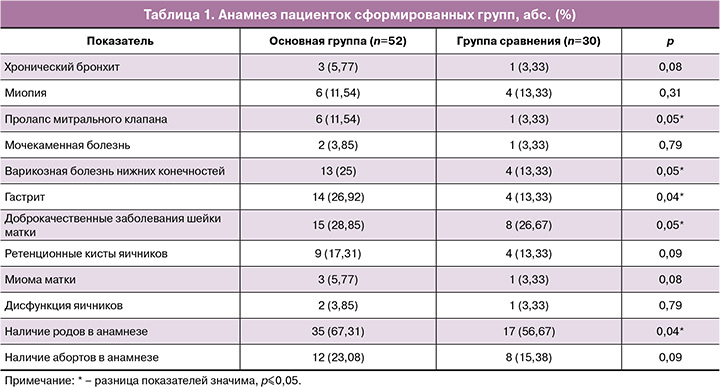
Соматический анамнез у пациенток сформированных групп был отягощен преимущественно за счет патологии органов желудочно-кишечного тракта и варикозным расширением вен нижних конечностей. При сравнении между группами значимых отличий выявлено не было.
Большинство женщин в обеих группах были повторнобеременными (88,46 и 70% соответственно, р=0,12) и повторнородящими (67,31 и 56,57% соответственно, р=0,04).
В таблице 2 приведены особенности течения настоящей беременности у пациенток сформированных групп.
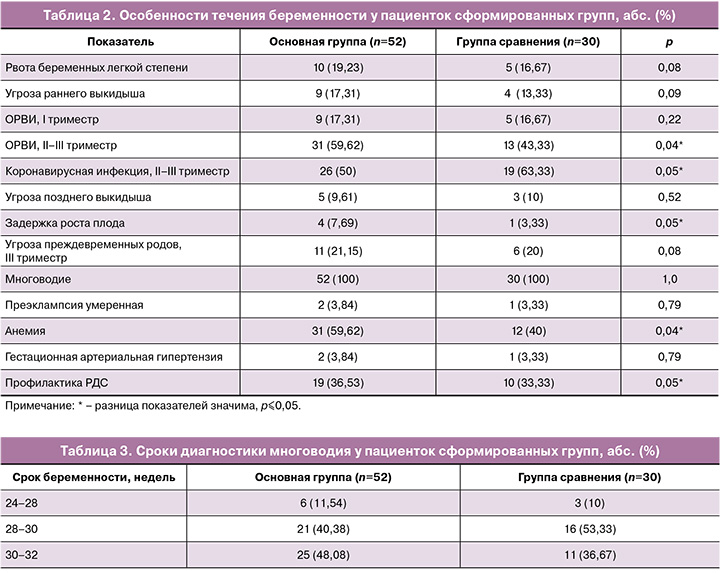
Течение настоящей беременности значимо чаще осложнялось у пациенток основной группы развитием поздней формы задержки роста плода (7,67 и 3,33% соответственно, р=0,05) и анемией легкой степени (59,67 и 40% соответственно, р=0,04). Угроза прерывания беременности развивалась у каждой 4-й пациентки как в основной группе, так и в группе сравнения. Пациентки получали стандартную терапию микронизированным прогестероном.
Угроза преждевременных родов развилась у каждой пятой беременной в обеих группах; во всех случаях были проведены токолитическая терапия нифедипином, профилактика РДС плода и магнезиальная терапия с целью нейропротекции.
Согласно критериям включения, все пациентки во II триместре беременности перенесли вирусную инфекцию, которая была идентифицирована как новая коронавирусная инфекция COVID-19 у 50 и 63,33% пациенток (р=0,05), как ОРВИ – у 59,62 и 43,33% соответственно (р=0,04). У 9,62% (5/52) и 6,67% (2/30) соответственно группам во II триместре вирусное заболевание развилось дважды (р=0,06).
Новая коронавирусная инфекция во всех случаях носила легкое течение, не требовала проведения госпитализации и терапии антикоагулянтами.
Согласно критериям включения, в 100% случаев присутствовало умеренное многоводие, диагностированное в сроках 24–32 недели беременности. В таблице 3 приведены сроки первичной диагностики многоводия.
У большинства пациенток сформированных групп значимо чаще многоводие диагностировалось в III триместре беременности: в основной группе – у 46/52 (88,46%), в группе сравнения – у 27/30 (90%) (р=0,78).
Основной жалобой пациенток при обращении было ощущение повышенной активности плода (у 30/52 (57,69%) в основной группе и 14/30 (46,67%) в группе сравнения), наличие одышки при незначительной нагрузке (у 21/52 (40,38%) в основной группе и 9/30 (30%) в группе сравнения) и дискомфорта внизу живота (у 23/52 (44,23%) в основной группе и 11/30 (36,67%) в группе сравнения).
С момента постановки диагноза пациенткам основной группы был назначен индометацин по 25 мг перорально 4 раза в сутки, который применялся в течение 3 дней. Совместно с индометацином применяли свечи «Суперлимф» по 10 ЕД 2 раза в сутки с ректальным способом введения препарата в течение 10 дней.
В группе сравнения 76,67% (23/30) пациенток получали курсовую терапию комбинацией амоксициллина с клавулановой кислотой (по 1,0 г 3 раза в сутки 5 дней) и 23,33% (7/30) – терапию цефазолином по 500 мг 3 раза в сутки 5 дней.
Терапия многоводия была эффективной у 92,31% (48/52) пациенток основной группы и у 60% (18/30) в группе сравнения. Критерием эффективности служило уменьшение объема околоплодных вод до полной нормализации ИАЖ. Объем околоплодных вод в основной группе оценивался с помощью УЗИ на 3–4-й день от начала лечения и далее каждую неделю в течение 3 недель. В группе сравнения УЗИ проведено дважды с интервалом 7–10 дней.
У пациенток основной группы средний размер максимального кармана на старте лечения составил 12,42 см (12 см – у 61,53%, 13 см – у 34,62% и 14 см – у 3,85%). На 3-и сутки от начала комбинированной терапии величина максимального кармана снизилась в среднем до 10,5 см и нормализовалась у 19,23% (у 76,92% – до 11 см, у 3,85% – до 13 см, у 19,23% – до 8 см). На 10-й день от начала терапии нормализация объема околоплодных вод отмечена у 51,92% (27/52), легкое многоводие сохранялось у 44,23% (23/52), умеренное многоводие – у 3,85 (2/52) пациенток.
На рисунке представлена динамика изменения объема амниотической жидкости у пациенток основной группы.
Через 2 недели от начала лечения полная нормализация объема околоплодных вод зафиксирована у 78,85% (41/52), легкое многоводие сохранялось у 15,38% (8/52), умеренное – у 5,77% (3/52).
Через 3 недели диагноз многоводия был снят у 92,31% (48/52) пациенток основной группы.
У 7,69% (4/52) беременных сохранялось легкое многоводие, величина максимального кармана составила 10,2 см. Необходимо отметить, что у 3 из 4 пациенток на период наблюдения был зарегистрирован еще один эпизод ОРВИ.
В группе сравнения, согласно данным архивного материала, УЗИ в динамике проводилось на момент госпитализации и далее дважды с интервалом 7–10 дней. Эффективность лечения составила 60% (18/30), что при сравнении с показателями основной группы имело статистически значимое различие (р≤0,001). Средняя величина максимального кармана на момент начала лечения была 12,57 см (у 56,67% – 12 см, у 33,33% – 13 см, у 6,67% – 14 см и у 3,33% – 15 см). При контрольном УЗИ, выполненном на 7-й день, средний размер максимального кармана составил 10,2 см. У 26,67% (8/30) пациенток количество околоплодных вод уменьшилось до нормы, у 73,33% (22/30) сохранялось многоводие (у 36,67% – умеренное и у 36,67% – легкое). Через 14 дней от окончания терапии нормализация объема околоплодных вод произошла у 60% (18/30) пациенток, при этом легкое многоводие сохранялось у 23,33% (7/30), а умеренное – у 16,67% (5/30).
Подгрупповое сравнение динамики уменьшения объема околоплодных вод на фоне проводимой терапии показало, что исходно средние показатели максимального кармана околоплодных вод не имели значимых различий и составили в основной группе 12,42 см, в группе сравнения – 12,57 см (р=0,89). Через 7–10 дней от начала лечения у пациенток основной группы уровень амниотической жидкости был в 1,26 раза меньше, чем в группе сравнения (8,08 и 10,2 см, соответственно, р=0,05), через 2 недели средние показатели не имели значимой разницы (7,48 и 8,27 см, р=0,74).
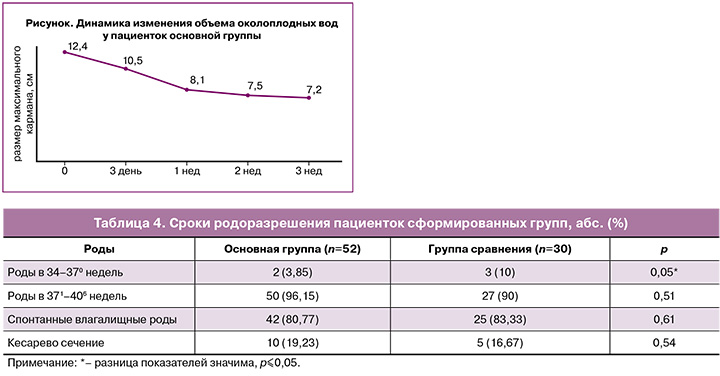
В таблице 4 приведены сроки и методы родоразрешения пациенток сформированных групп.
Родоразрешение в срок произошло у 96,15 и 90% пациенток соответственно группам. Значимых различий в частоте спонтанных влагалищных и оперативных родов по группам выявлено не было. Отмечена более высокая частота преждевременных родов у пациенток группы сравнения, составившая 10% (р=0,05).
В таблице 5 приведены данные по состоянию новорожденных.

При сравнении исходов родов и состояния новорожденных значимых различий выявлено не было, за исключением частоты рождения здоровых маловесных детей, которые чаще выявлялись в группе сравнения (р=0,05).
Морфологическое исследование последа было проведено у 40 (76,92%) пациенток основной группы и у 15 (50%) группы сравнения (табл. 6).
Нормальное строение последа отмечено у 42,5 и 26,67% пациенток сформированных групп; значимо чаще состояние плаценты соответствовало нормальному у беременных основной группы (р≤0,05).
В плацентах пациенток группы сравнения значимо чаще выявлены дистрофические нарушения (в каждом 3-м случае), виллузит и интервиллузит (в каждом 5-м случае). Хронический интервиллузит (очаговое поражение части ворсин с наличием клеток воспалительного ряда в межворсинчатом пространстве) ассоциируется с перенесенными вирусными и бактериальными инфекциями [20].
Обсуждение
Многоводие является проявлением дисбаланса между объемом образующейся жидкости и фильтрационными свойствами амниотических оболочек. В связи с этим разработка способов воздействия на факторы, приводящие к избыточной ее продукции (пороки развития у плода, гипоплазия легких, фето-фетальный трансфузионный синдром, анемия, парвовирусная инфекция) или нарушению реабсорбции (сахарный диабет, внутриутробные инфекции), является актуальным.
В исследовании Dashe J.S. et al. на основании ретроспективного исследования 672 пациенток с многоводием было показано, что до 79% всех случаев связаны с пороками развития плода. Кроме того, была выявлена прямая корреляционная связь с выраженностью многоводия – чем более тяжелая форма многоводия выявлена, тем выше была вероятность наличия у плода тяжелых пороков развития [1]. При исключении пороков развития многоводие может быть отнесено к идиопатическому.
Abele H. et al. в ретроспективном исследовании 272 пациенток с многоводием за период с 2004 по 2010 гг. показал, что до 43,3% всех случаев многоводия являются идиопатическими, а еще 30% связаны с воздействием вирусной инфекции [6]. При умеренном и тяжелом многоводии повышен риск антенатальной гибели плода, отслойки плаценты, преждевременных родов и преждевременного разрыва плодных оболочек. В связи с чем целесообразно проведение терапии, направленной на уменьшение объема околоплодных вод. В нашей стране наиболее распространенным является назначение антибактериальных препаратов, которые неэффективны в случае вирусной этиологии многоводия. В странах западной Европы и Америки препаратом выбора для сроков до 32 недель является курс терапии индометацином.
В проведенном нами исследовании была продемонстрирована эффективность комбинированного подхода к терапии вирус-ассоциированного многоводия у беременных в сроке 24–32 недели с использованием индометацина и иммуномодулятора «Суперлимф».
При сравнении с классическим лечением комбинированная терапия позволила повысить частоту излечения до 92,31% к концу 3-й недели наблюдения. Уже через 3 дня от начала лечения средние показатели величины максимального кармана уменьшились на 2 см (с 12,42 до 10,5 см). На 10-й день лечения у 51,92% беременных объем околоплодных вод полностью нормализовался. Через 3 недели у 4 пациенток (7,69%), повторно перенесших ОРВИ, сохранялось легкое многоводие, не причиняющее субъективного дискомфорта.
Заключение
По нашему мнению, при аллергической реакции на антибиотики/отсутствии показаний к приему антибиотиков и многоводии возможно применение комбинированной терапии, включающей индометацин и иммуномодулятор «Суперлимф». Наши результаты показали уменьшение околоплодных вод по данным УЗИ и не ухудшили перинатальные исходы.



