Геморрагическая форма апоплексии яичника (ГФАЯ) является второй по частоте после внематочной беременности причиной возникновения внутрибрюшного кровотечения у женщин, примерно в половине случаев требующего экстренного хирургического лечения. Безопасность методов гемостаза с точки зрения сохранения физиологической функции яичника у больных с ГФАЯ недостаточно изучена [1–4]. Так как это патологическое состояние возникает у женщин репродуктивного возраста, представляется актуальным поиск методов оперативного лечения, позволяющих снизить негативное воздействие применяемого с целью гемостаза источника энергии на ткань яичника и сохранить овариальный резерв (ОР). Это особенно важно у больных с нереализованной репродуктивной функцией. Главными критериями оценки ОР на сегодняшний день являются: возраст пациентки, уровень антимюллерова гормона (АМГ) в сыворотке крови и количество антральных фолликулов (КАФ), оцениваемое с помощью трансвагинального ультразвукового исследования (ТВУЗИ) [5, 6].
АМГ является ключевым биохимическим маркером оценки ОР, «генетическим паспортом», отражая истинный примордиальный пул яичника и характеризуя возможный овариальный ответ [7–9].
Поэтому целью настоящего исследования было изучение влияния различных методов хирургического гемостаза у больных ГФАЯ на резерв овариальной ткани.
Материалы и методы исследования
Были обследованы 72 больные апоплексией яичника, находившиеся на стационарном лечении в период с октября 2011 г. по март 2013 г. в гинекологическом отделении ГКБ № 15 им. О.М. Филатова г. Москвы. Исследуемую группу составили 47 пациенток с ГФАЯ со стабильными показателями гемодинамики до вмешательства и давностью заболевания не более 24 часов, подвергшиеся лапароскопическим операциям. Все больные давали письменное согласие на участие в исследовании. Больные исследуемой группы были разделены на две подгруппы в зависимости от использованного во время операции метода гемостаза. В 1-ю подгруппу вошли 25 больных, гемостаз которым осуществлялся с помощью биполярной коагуляции, во 2-ю – 22 пациентки, кровотечение у которых было остановлено с помощью наложения швов. В ту или иную подгруппу больные отбирались «слепым» методом. Группу сравнения составили 25 больных с подтвержденной лапароскопически болевой формой апоплексии яичника, получивших консервативное лечение. Критериями исключения из исследования были: внутрибрюшное кровотечение вследствие разрыва доброкачественной опухоли или эндометриоидной кисты яичника; наличие в анамнезе оперативных вмешательств на яичниках; прием комбинированных оральных контрацептивов или применение методов стимуляции суперовуляции экзогенными гонадотропинами менее чем за 3 месяца до операции.
Всем больным операции проводили в условиях комбинированного эндотрахеального наркоза. Все больные получали интраоперационную антибиотикопрофилактику путем внутривенного введения цефалоспоринов II–III поколения в дозе 1 г. Лапароскопию осуществляли стандартным «закрытым» методом с наложением первичного пневмоперитонеума иглой Вереша и использованием трехпрокольной методики. Троакар для оптической системы (диаметр 11 мм) вводили через пупочное кольцо, 2 вторичных троакара (диаметром 5 и 12 мм) устанавливали в подвздошных областях справа и слева соответственно, латеральнее нижних эпигастральных сосудов. Рабочее давление пневмоперитонеума во время операции составляло 15 мм рт. ст. Операцию начинали с выявления источника кровотечения и осуществления гемостаза. В случаях наличия спаечного процесса, не позволяющего визуально определить источник кровотечения, сначала производили разделение спаек в объеме, необходимом для проведения гемостаза. В 1-й подгруппе кровотечение останавливали при помощи точечного воздействия стандартным биполярным инструментом типа Клеппингер с шириной бранш 3 мм непосредственно на кровоточащий сосуд. Мощность тока составляла 35 Вт. При неэффективности точечной коагуляции капсулу кисты вылущивали с последующим дополнительным точечным гемостазом кровоточащих участков в ложе кисты. Во второй подгруппе во всех случаях для остановки кровотечения проводили энуклеацию кисты и наложение на рану яичника 1–3 отдельных швов № 2/0 рассасывающейся полигликолидной нитью с интракорпоральным завязыванием узла. По окончании проведения гемостаза проводили санацию брюшной полости физиологическим раствором. Для удаления сгустков крови и жидкости из верхних этажей брюшной полости больную переводили в положение Фоулера. Окончательный контроль гемостаза осуществляли в положении Тренделенбурга после заполнения полости малого таза физиологическим раствором. Длительность операции и отдельных ее этапов оценивали по записям, осуществляемым на цифровой носитель. Величину послеоперационной кровопотери определяли путем подсчета разницы между объемом введенной в брюшную полость жидкости и объемом жидкости в банке вакуумного отсоса после операции. Удаленные макропрепараты во всех случаях подвергали гистологическому исследованию.
Длительность наблюдения за больными после операции составила от 6 до 12 месяцев.
Исследование уровня АМГ осуществляли в лаборатории Центра иммунологии и репродукции (Москва). Уровень АМГ в сыворотке венозной крови измеряли однократно до операции и на 3-й день первого, третьего и шестого менструальных циклов после операции методом иммуноферментного анализа с чувствительностью 0,08 нг/мл. Уровень АМГ трактовали при уровне 0,01–0,9 нг/мл как низкий, 1,0–2,5 нг/мл – как средний, более 2,5 нг/мл – как высокий.
ТВУЗИ для определения КАФ проводил у всех больных с использованием датчика с частотой 7,5 МГц один и тот же специалист на 3-й день первого, третьего и шестого менструальных циклов после операции. Подсчет антральных фолликулов производили при продольном и поперечном сканировании, определяя не менее 2 перпендикулярных друг другу величин диаметра фолликула и учитывая наибольший из них. Антральными считались фолликулы диаметром не менее 2, но не более 10 мм.
Статистический анализ проведен с использованием программы Statistica 6 (Stat Soft). Параметры, приводимые далее, имеют следующие обозначения: М – среднее, s – стандартное (среднее квадратичное) отклонение, n – объем анализируемой подгруппы, p – полученный уровень значимости. Для анализа количественных данных в двух независимых подгруппах и группе сравнения использовали двусторонний критерий Стьюдента. Для анализа динамики количественных данных внутри подгрупп использовали критерий Стьюдента для зависимых выборок. Для оценки меры линейной связи между парами показателей использовали коэффициент корреляции Пирсона. Критическое значение уровня значимости принимали равным 5% (p≤0,05).
Исследование было одобрено к проведению на заседании этического комитета ГБОУ ВПО МГМСУ им. А.И. Евдокимова.
Результаты исследования и обсуждение
 Средний возраст пациенток в обеих подгруппах исследуемой группы и группы сравнения (25,7±6,3, 28,3±5,3, и 26,7±7,0 года соответственно) статистически не различался (p>0,05).
Средний возраст пациенток в обеих подгруппах исследуемой группы и группы сравнения (25,7±6,3, 28,3±5,3, и 26,7±7,0 года соответственно) статистически не различался (p>0,05).
24 (33,3%) больные были рожавшими, из них 3 (12,5%) родоразрешены путем операции кесарева сечения. Около четверти больных (17 (23,6%)) ранее подвергались чревосечениям (тубэктомии с одной стороны по поводу трубной беременности или аппендэктомии), в том числе 7 (38,8%) перенесли оба этих вмешательства. При лапароскопии спаечный процесс был обнаружен у 41 (58%) больной, ни в одном из случаев спаечный процесс не был оценен как выраженный.
Большинство больных были доставлены в стационар службой скорой помощи: 18 (25%) – в первый час, 31 (43%) – в первые 12 часов, 7 (9,7%) – позже 12 часов от начала заболевания. Только 5 (6,9%) пациенток самостоятельно обратились в приемное отделение больницы в сроках от 12 до 24 часов от момента ухудшения самочувствия.
При оценке длительности операции, а также длительности этапа осуществления гемостаза были выявлены статистически значимые различия между исследуемыми подгруппами. Так, длительность оперативного вмешательства в 1-й подгруппе составляла от 20 до 45 мин, в среднем 26,9±8,7 мин, тогда как во 2-й подгруппе она колебалась от 25 до 60 мин и в среднем была значительно большей – 39,4±9,5 мин (p<0,05). Следует отметить, что средняя длительность осуществления гемостаза во 2-й подгруппе (10,8±2,7 мин) была большей, чем в 1-й подгруппе (6,3±3,8 мин), что и отражалось на различиях в общей продолжительности операции (p<0,05). Объем операционной кровопотери варьировал в 1-й подгруппе от 150 до 1800 мл (в среднем 489,5±382,8 мл) и от 100 до 1900 мл во 2-й подгруппе (в среднем 415,4±139,0 мл). Различия в объеме кровопотери не имели ни клинического, ни статистического значения (p>0,05). В случаях кровопотери, превышавшей 1000 мл, использовалась технология возврата собственной крови с помощью системы Cell-Saver. Реинфузия отмытых эритроцитов аппаратом в количестве 800–1100 мл была произведена только 5 (6,9%) больным. Переливание препаратов крови ни одной больной в подгруппах не проводилось. Все операции были выполнены только лапароскопическим доступом. Интраоперационных осложнений не было. Дренирование брюшной полости осуществлено только 2 (2,8%) больным. Наркотические анальгетики с целью обезболивания не использовались ни у одной больной. Послеоперационных осложнений не было. Эпизодическая лихорадка в послеоперационном периоде наблюдалась лишь у 2 (2,8%) пациенток.
Гистологическое исследование макропрепарата было произведено у 15 (60%) пациенток первой и у всех 22 (100%) больных второй исследуемых подгрупп. У большинства по данным гистологического исследования обнаружено кровоизлияние в кисту желтого тела – 30 (81,1%) либо кровоизлияние в фолликул – 7 (18,9%). Апоплексия левого яичника отмечена у 19 (26,4%) пациенток, правого – у 53 (73,6%).
Выписка больных из стационара осуществлялась в соответствии с существующими стандартами обязательного медицинского страхования. Средний послеоперационный койко-день составил 4,2 ±2,2 суток.
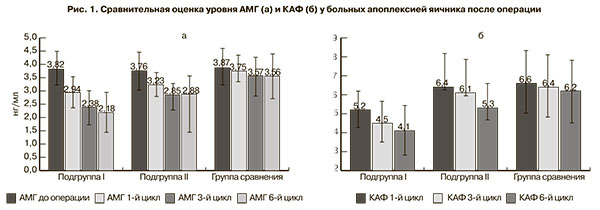
Данные об уровне АМГ, полученные в ходе исследования, представлены на рис. 1а. Статистически значимых различий среднего уровня АМГ в предоперационном периоде в 1-й и 2-й исследуемых подгруппах и группе сравнения не было (p>0,05). Во всех группах уровень АМГ оценивался как высокий. Средний уровень АМГ, определенный на 1-й, 3-й и 6-й циклы после операции, был ниже предоперационных в обеих исследуемых подгруппах и группе сравнения. Снижение уровня АМГ в группе сравнения на протяжении всех трех исследований после операции, хотя и не имеющее статистической значимости (p>0,05), позволяет предполагать, что сама апоплексия яичника, сопровождающаяся кровоизлиянием в строму и локальной ишемией паренхимы яичника с последующим развитием воспаления и рубцевания, приводит к некоторой, хотя и небольшой, потере ОР.
Средний уровень АМГ в 1-й подгруппе был статистически значимо ниже, чем во 2-й подгруппе и группе сравнения, и значительно снижался на протяжении шести менструальных циклов после операции (p<0,05). Во второй исследуемой подгруппе средний уровень АМГ был статистически значимо ниже, чем в группе сравнения, однако превышал соответствующие показатели в первой подгруппе (p<0,05), а тенденция к снижению, начиная с 3-го менструального цикла после операции, отсутствовала.
Данные о потере ОР, полученные в процессе исследования АМГ, полностью подтвердились и при исследовании КАФ. Наименьшим этот показатель был в 1-й исследуемой подгруппе, а во 2-й – значительно ниже, чем в группе сравнения (p<0,05) (рис. 1б). Имевшее место уменьшение КАФ в группе сравнения не имело статистической значимости (p>0,05).
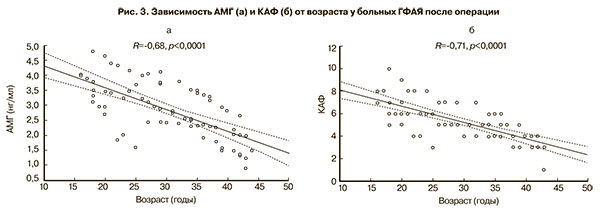
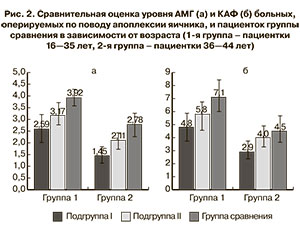
Представляло интерес изучение изменения показателей ОР после хирургического лечения в зависимости от возраста. Все включенные в исследование больные были разделены на 2 возрастные группы. В первую вошли 46 пациенток в возрасте от 16 до 35 лет, во вторую – 26 пациенток в возрасте от 36 до 44 лет. Средний возраст пациенток в 1-й группе составил 25,0±5 лет, а во 2-й – 39,2±2 года. Данные о состоянии ОР у больных в зависимости от возраста и метода гемостаза показаны на рис. 2. В 1-й группе уровень АМГ и КАФ после операций был статистически значимо выше, чем во 2-й группе (p<0,05). Снижение уровня АМГ у больных 1-й возрастной группы, оперированных с использованием биполярного гемостаза, составляло 34%, а показателя КАФ – 32%. У больных этой же группы в возрасте 36 лет и старше отмечено снижение уровня АМГ на 48%, а КАФ на 36%. У больных, гемостаз которым осуществлялся путем наложения швов, в 1-й возрастной группе отмечено снижение уровня АМГ на 19% и КАФ на 18%; во 2-й группе – снижение на 24 и 11%, соответственно. При анализе зависимости уровня АМГ и КАФ от возраста выявлена умеренная отрицательная корреляционная связь между этими показателями (рис. 3).
Заключение
Таким образом, анализируя полученные данные, можно сказать, что сама апоплексия яичника способствует хоть незначительному, но снижению ОР. Неизбежное снижение ОР происходит в ходе энуклеации желтого тела или капсулы кисты из яичника, что приводит к потере некоторого количества фолликулов вследствие механического удаления части объема овариальной ткани [10]. Несмотря на то что биполярный гемостаз осуществляется значительно быстрее (p<0,05) и не требует от хирурга владения техникой наложения швов, он приводит к более выраженным изменениям ОР [11]. Это, возможно, объясняется тепловым повреждением стромальных сосудов и паренхимы яичника вследствие латерального распространения энергии из точки электрохирургического воздействия, что, в свою очередь, ведет к ослаблению микроциркуляции вокруг доминантных фолликулов и перераспределению циркулирующих гонадотропинов [12–21].
Таким образом, одним из критериев выбора объема оперативного вмешательства и метода гемостаза должен быть возраст пациентки. Увеличение возраста ведет к снижению числа примордиальных фолликулов и большим потерям ОР при хирургическом лечении ГФАЯ. Это особенно важно у больных с нереализованной генеративной функцией. Эта категория пациенток должна подвергаться вмешательствам, направленным на максимальное сохранение ОР. Тем не менее, проблема требует дальнейшего изучения на более широком клиническом материале, что позволит эффективно и безопасно выполнять подобные вмешательства широкому кругу оперирующих гинекологов и тем самым улучшить репродуктивный потенциал таких больных.



