Склерозирующий лихен вульвы (СЛВ) – неизлечимый хронический воспалительный дерматоз [1]. Основными симптомами СЛВ являются зуд, боль, жжение и диспареуния. СЛВ на поздних стадиях может привести к атрофии малых половых губ, обструкции мочевыводящих путей, скрытию клитора и другим дисфункциям. СЛВ является фактором риска развития вульварной интраэпителиальной неоплазии и инвазивного плоскоклеточного рака [2].
Патогенез СЛВ неизвестен, однако в некоторых исследованиях сообщается, что в 12% случаев он является генетически обусловленным [3–5]. Было подтверждено, что человеческий лейкоцитарный антиген класса DQ7 ассоциирован с патогенезом СЛВ [6]. Два пика встречаемости СЛВ у женщин (препубертатный и постменопаузальный) также свидетельствуют о том, что эстрогены могут играть важную роль в этиологии СЛВ [7]. Кроме того, результаты исследований [8] указывают на связь местных и инфекционных факторов, таких как инфекция, вызванная Borrelia burgdorferi, вирусом папилломы человека, Эпштейна–Барр вирусом, с этиопатогенезом СЛВ, однако это не было подтверждено. Высокоэффективный кортикостероидный крем (0,05% клобетазола пропионат) является препаратом первой линии терапии, ингибиторы кальциневрина – второй [9].
В последние годы терапевтический эффект фотодинамической терапии (ФДТ) на СЛВ привлекает все большее внимание [10]. Данная методика создает внутриклеточные активные формы кислорода либо за счет поглощения экзогенного фотосенсибилизатора (ФС), либо за счет эндогенной продукции [11]. ФС обладают более высоким сродством к патологическим клеткам и клеткам, играющим роль в воспалительных процессах, главным образом к антигенпрезентирующим клеткам и к фиброзу [12, 13], следовательно, повреждение окружающих здоровых тканей сводится к минимуму. В исследовании Mazdziarz et al. [14] при субъективной оценке эффективности ФДТ у 89 пациентов через 3 месяца наблюдения выявлено улучшение, которое было либо частичным, либо полным. При вульвоскопии отмечено снижение субэпителиальных экхимозов и телеангиэктазий у 78,95% больных, тогда как у 70,97% больных отмечалось уменьшение эрозий и трещин. Imbernon-Moya et al. [15] сообщили о снижении ответа по визуальной аналоговой шкале (ВАШ) и Индекса Качества Жизни у всех пациентов, в то время как объективно врачи не обнаружили никаких признаков улучшения клинического состояния в пораженной области. В исследовании Shi et al. [16] у 14 из 20 пациентов после ФДТ был зарегистрирован хороший ответ по ВАШ, также было отмечено значительное уменьшение размеров поражения (Р<0,001). Osiecka et al. [17] представили значительное улучшение в отношении зуда, жжения, эрозии и боли, оцениваемых по Вербальной Рейтинговой Шкале. Olejek et al. [18] субъективно сообщили о значительном снижении средней тяжести симптомов, связанных с СЛВ, после применения ФДТ (Р<0,001). В исследовании Skrzypulec et al. [19] 37 пациентов сообщили об отсутствии симптомов после применения ФДТ. То же самое было сообщено Zawislak et al., [20], которые показали значительное облегчение симптомов через 6 месяцев после терапии у 6 из 9 пациентов. Sotiriou et al. [21] опубликовали две серии клинических случаев пациентов, получавших ФДТ. В первом исследовании, которое было основано на результатах 5 пациентов, было обнаружено значительное снижение ВАШ в отношении ощущения жжения и зуда [21]. Biniszkiewicz et al. [22] сообщили об облегчении зуда у 23 пациентов после ФДТ; только у 1 пациента сохранились симптомы. Наконец, Hillemanns et al. [23] отметили облегчение симптомов, в частности, уменьшение зуда у 10 из 12 пациентов. Olejek et al. [18] наблюдали исчезновение проявлений СЛВ при гистологическом исследовании после лечения (Р<0,001).
В то же время Biniszkiewicz et al. [22] провели фотодинамическую диагностику, которая выявила патологические изменения у 14 из 24 пациентов после ФДТ. Skrzypulec et al. [19] оценили эффективность ФДТ в отношении сексуальной функции и депрессии. Не было обнаружено уменьшения симптомов депрессии, в то время как индекс женской сексуальной функции был значительно ниже после лечения (Р=0,009), что не выявило положительного влияния ФДТ на сексуальную функцию.
Нежелательные эффекты фотодинамической терапии
В 8 исследованиях сообщается о незначительных симптомах жжения, дискомфорта, зуда или боли во время терапии, которые исчезли вскоре после процедуры [24]. В частности, в обоих исследованиях Sotiriou et al. [21] все пациенты сообщили о жжении во время терапии, что, однако, не привело к прерыванию терапии. Кроме того, 5 пациентов в исследовании Hillemans et al. [23] жаловались на легкий дискомфорт от жжения в течение 4–8 ч после лечения. 39 пациентов в исследовании Madziarz et al. [14] жаловались на парестезии во время процедуры, но никто не решил прервать терапию. Легкая местная эритема и/или отек также были зарегистрированы в 6 исследованиях [17, 18, 21–24]. Moya et al. сообщили, что у 6 и 2 из включенных пациентов наблюдались эритема и отек через 1–3 и 7–10 дней после терапии соответственно [15]. У всех пациентов в исследовании Sotiriou et al. [21] развилась эритема без отека или волдырей в течение 1 недели после терапии, в то время как отек, который уменьшился, был зарегистрирован у 12 из 102 пациентов Mazdiarz et al. [14]. Только 1 серьезное осложнение было отмечено у 1 пациента Shi et al. [16]; оно включало эрозию на коже и было успешно пролечено мазью с мупироцином.
Цель исследования: оценить эффективность и безопасность ФДТ в лечении СЛВ.
Материалы и методы
В группу нашего исследования, проведенного на базе официального московского филиала израильского госпиталя Hadassah Medical (Территория инновационного центра «Сколково»), вошли 15 пациенток с диагнозом «склерозирующий лихен вульвы».
Критерии включения: (1) типичные клинические проявления СЛВ; (2) гистопатологическое исследование, подтверждающее диагноз СЛВ; (3) возраст старше 18 лет; (4) срок наблюдения не менее 6 месяцев; (5) отсутствие применения кортикостероидов или препаратов, влияющих на иммунную функцию в течение 3 месяцев до проведения ФДТ.
Критерии исключения: (1) вирус папилломы человека, грибковые или бактериальные инфекции вульвы; (2) опухоли половых органов или предраковые поражения вульвы, влагалища или матки; (3) беременность или кормление грудью; (4) лечение местными кортикостероидами во время ФДТ и последующего наблюдения; (5) прием системной гормональной терапии.
Все пациенты подписали добровольное информированное согласие на проведение процедур ФДТ.
В нашем исследовании в качестве ФС использовался хлорин Е6 в форме 1% крема; в качестве источника облучения – аппарат фототерапевтический светодиодный красного излучения АФС «Гармония».
Протокол процедуры: (1) на очаг поражения (с захватом 1 см здоровой ткани) наносили 1% крем, содержащий хлорин Е6, сверху накладывали полиэтиленовую пленку для улучшения пенетрации ФС и предотвращения смазывания; (2) время экспозиции составляло 40 минут; (3) далее мы убирали пленку и облучали участок поражения длиной волны 660 нм в течение 30 минут, энергия 100 Дж/см2, мощность 100 мВ/см2. Не было необходимости в анестезии. Процедуру проводили 1 раз в 7 дней в среднем 5–7 раз, в зависимости от достигаемого эффекта. Перед процедурой пациенткам было рекомендовано опорожнить мочевой пузырь и не пить жидкость до и вовремя процедуры. Срок наблюдения составил 6 месяцев. Контрольный осмотр проводили через 6 месяцев.
Для оценки эффективности была использована ВАШ. Зуд, жжение, болезненность, диспареуния оценивались по шкале от 0 до 4 (0 – отсутствие симптомов, 1 – легкие, 2 – средние, 3 – тяжелые). Также проводили оценку Дерматологического Индекса Качества Жизни (ДИКЖ). ДИКЖ – одна из первых субъективных дерматологических специализированных методик обследования, которая активно применяется в современной практике; состоит из 10 вопросов, позволяющих определить степень влияния дерматологического заболевания на различные аспекты жизни и, следовательно, ее качество. Минимальный балл (0) свидетельствует об отсутствии влияния СЛВ на различные аспекты жизни, а максимальный (30) – о чрезвычайно сильном ухудшении ее качества [25].
Кроме того, проводилась вульвоскопия. Оценивали следующие показатели: лихенификация с гиперкератозом, атрофия, субэпителиальные экхимозы и телеангиэктазии, эрозии и трещины, подозрение на интраэпителиальную неоплазию вульвы (VIN). Также пациентов просили оценить общую удовлетворенность от курса процедур (0 – полностью не удовлетворена, 1 – немного удовлетворена, 2 – удовлетворена, 3 – полностью удовлетворена).
Результаты
Все 15 пациенток завершили весь курс лечения и наблюдались в течение 6 месяцев. В исследование были включены 15 пациентов в возрасте от 18 до 62 лет со средним возрастом 49 лет. Анамнез заболевания составлял от 2 до 6 лет, а средняя продолжительность заболевания – 46,38 месяца. Клиническая характеристика больных представлена в таблице 1.
Пациенты после лечения продемонстрировали значительную регрессию зуда, жжения, боли и диспареунии. Перед процедурами ФДТ все пациентки жаловались на умеренный и сильный зуд вульвы. Средняя оценка зуда составила 2,9 балла на первом сеансе. С увеличением числа процедур показатели зуда постепенно снижались. После третьей процедуры зуд полностью исчез у 12 пациенток, у 2 пациенток наблюдалось уменьшение симптомов зуда от тяжелых до легких. Все пациенты изначально жаловались на легкое или сильное жжение и боль, а 8 пациенток – на умеренную или тяжелую диспареунию. Боль и диспареуния полностью разрешились после 3–4 процедур (рис. 1). В течение 6 месяцев наблюдения рецидив возник у 1 пациентки. Ей была назначена поддерживающая терапия 1 раз в месяц в течение еще 6 месяцев.
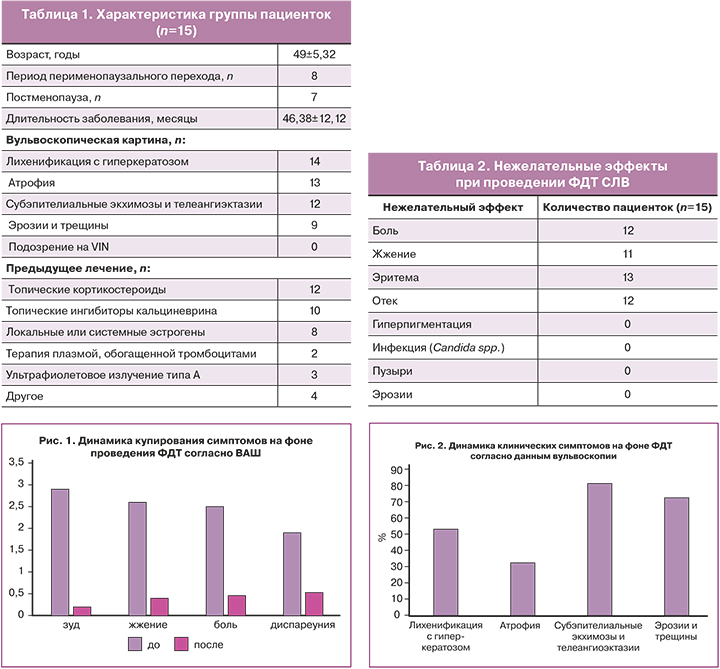
Наибольший эффект по результатам вульвоскопии был в отношении субэпителиальных экхимозов и телеангиэктазий (81,32%), а также эрозий и трещин (72,54%). Частичная ремиссия лихенификации с гиперкератозом наблюдалась в 53,23% случаев. Наименьший ответ наблюдался в отношении атрофических поражений (32,45% случаев) (рис. 2). При 6-месячном наблюдении вульвоскопическая оценка не выявила ни одного случая прогрессирования заболевания или трансформации в VIN или рак.
Процедуры оценки удовлетворенности показали, что 11 пациентов были «очень удовлетворены», 4 пациента были «удовлетворены» из-за остаточного легкого зуда. Ни один пациент не был недоволен клиническим ответом на лечение. Средний балл удовлетворенности терапевтическими результатами составил 2,7 при последнем наблюдении.
Никаких серьезных нежелательных реакций не возникало ни во время лечения, ни после него (табл. 2). При лечении основными побочными эффектами были боль и жжение во время процедуры, которые постепенно исчезали в течение 3 ч. Все пациенты могли терпеть боль, и ни один пациент не прекращал лечение и не нуждался в обезболивании.
Обсуждение
СЛВ – это хроническое воспалительное заболевание кожи, которое проявляется в основном в генитальной и перианальной областях и может вызывать сильный дискомфорт и зуд. Кроме того, он может приводить к стенозу влагалищного и уретрального входов, что клинически проявляется жгучей болью при мочеиспускании и диспареунией. Это заболевание может серьезно повлиять на качество жизни и сексуальное благополучие пациентов, а также может быть связано с повышенным риском злокачественной трансформации, такой как плоскоклеточный рак вульвы. Поэтому лечение необходимо проводить для купирования симптомов и предотвращения возникновения осложнений. Многочисленные методы лечения были опробованы с различными результатами относительно эффективности. В настоящее время первой линией терапии являются топические высокоэффективные кортикостероиды, а 0,05% крем клобетазола пропионат считается золотым стандартом. Однако местное лечение кортикостероидами может вызвать не только рецидив симптомов, но и побочные эффекты, включая раздражение, сухость, жжение, атрофию кожи и гипопигментацию [26–28]. Следовательно, необходимы более эффективные методы лечения с более низкой частотой побочных эффектов и меньшим количеством рецидивов.
В последнее время ФДТ широко применяется для лечения обширного спектра кожных заболеваний и немеланомных опухолей кожи [26]. Механизм ФДТ основан на взаимодействии ФС, видимого света и кислорода, в результате чего образуются цитотоксические активные формы кислорода, которые повреждают клеточные органеллы, вызывают разрушение клеток и тканей, способствуют окклюзии микрососудов и стимулируют иммунные реакции [26].
Наше исследование показало, что ФДТ с хлорином Е6 в качестве ФС и длиной волны 660 нм с воздействием в течение 30 минут, энергией 100 Дж/см2, мощностью 100 мВ/см2, 1 раз в 7 дней 5–7 раз является эффективным и безопасным методом лечения СЛВ. В ходе лечения или после него не возникало серьезных побочных реакций, все пациенты хорошо переносили терапию.
Заключение
Хотя наше исследование имеет весьма удовлетворительный результат лечения, основными ограничениями являются: небольшой размер выборки и короткий период наблюдения. Поэтому мы предполагаем более масштабные исследования по оценке эффективности и безопасности ФДТ при СЛВ, с более длительным сроком наблюдения, большим количеством пациентов и качественной объективной оценкой клинических поражений. До сих пор нет единого мнения относительно методологии таких параметров, как концентрация ФС, время экспозиции ФС, источник света (мощность и длина волны), время воздействия источником света (энергия и мощность), а также количество и частота повторений курсов для лечения СЛВ.
Поэтому, учитывая большую потенциальную пользу для пациентов, необходимо масштабное клиническое исследование для достижения оптимальных параметров ФДТ и внедрения ее в практическое здравоохранение.



