Синдром Элерса–Данло (СЭД) объединяет группу наследственных заболеваний с преимущественным поражением кожи, опорно-двигательного аппарата и сосудов, наличием нарушений в других органах и тканях, обусловленных генерализованными проявлениями дисплазии соединительной ткани вследствие мутации разных генов, ответственных за структуру и функцию коллагена. Признаки заболевания впервые описаны в виде реферата А.Н. Черногубовым в 1891 г., синдром назван в честь дерматологов Edvard Ehlers из Дании и Henri-Alexandre Danlos из Франции, опубликовавших свои наблюдения, соответственно в 1901 и 1908 гг. [1–3]. Выделяют 13 клинических форм СЭД, которые различаются по типам наследования, биохимическим дефектам коллагена и клиническим признакам [3–5]. Частота встречаемости составляет от 1:5000 до 1:250 000 населения в зависимости от формы и степени тяжести заболевания, чаще фиксируют легкие формы заболевания; стертые формы в детском возрасте диагностируются не всегда, а обычно – при появлении специфических осложнений [6–8]. Наиболее распространенными являются классический, гипермобильный и сосудистый типы СЭД; другие типы (классически-подобный, клапанно-сердечный, артрохалазийный, дерматоспараксисный, кифосколиотический, спондилодиспластический, мышечноконтрактурный, миопатический, периодонтальный типы и синдром хрупкой роговицы) встречаются значительно реже. В диверсификации форм заболевания ведущее значение имеют клиническая картина, генеалогическое обследование и методы молекулярно-генетической диагностики [9–11]. Многие клинические признаки встречаются практически при всех формах заболевания в различных сочетаниях, прогноз в основном зависит от типа, степени тяжести заболевания, наличия коморбидной патологии, травм, осложнений и последствий СЭД. Диагностические клинические критерии СЭД подразделяются на большие и малые, из больших признаков чаще встречаются повышенная растяжимость кожи, наличие на ней широких атрофических рубцов и гипермобильность суставов. Для постановки определенного диагноза типа СЭД достаточно наличия 2 больших признаков [9–12]. Первые признаки СЭД (перерастяжение кожи, гипермобильность суставов и хрупкость тканей) можно выявить при внимательном обследовании сразу после рождения ребенка. Ранняя постановка диагноза во многом позволяет улучшить качество жизни, социальную адаптацию и трудоспособность больных [11–14].
Наибольшее значение в практике акушера-гинеколога имеет сосудистый СЭД, так как именно он сопровождается различными акушерскими и общемедицинскими проблемами, часто угрожающими жизни. При этом заболевании имеется дефект III типа коллагена, являющегося важнейшим компонентом сосудистой стенки и стенок желудочно-кишечного тракта. Повреждения артерий включают в себя разрывы, расслоения, артерио-венозные фистулы. Разрывы артерий часто возникают без какой-либо определенной причины. Наиболее опасные осложнения связаны с угрожающими кровотечениями, а также с перфорацией кишечника. Так как хирургические вмешательства ограничены в связи с ломкостью тканей, эти кровотечения часто приводят к летальному исходу. Риск подобных осложнений возрастает с возрастом. В детстве их частота невелика, в то время как в возрасте до 20 лет они встречаются у 25% больных и более чем у 80% больных в возрасте до 40 лет. Даже незначительные травмы у пациентов с сосудистым типом СЭД приводят к образованию гематом, иногда довольно обширных. Около 50% всех сосудистых повреждений составляют артерии груди и живота. Как правило, вовлекаются артерии среднего калибра. Часто кровотечения требуют неотложного хирургического вмешательства. Однако трудность заключается в том, что само хирургическое вмешательство может привести к массивным летальным кровотечениям из других артерий. Вовлечение артерий верхних и нижних конечностей составляет около 25% среди различных сосудистых осложнений у пациентов с васкулярным типом СЭД. Разрывы артерий в анатомически закрытых пространствах приводят к образованию обширных гематом и часто заканчиваются летально. Предпочтительным является лигирование артерий, так как более сложные хирургические манипуляции могут привести к дальнейшим повреждениям [8–11, 15].
Молекулярная диагностика сосудистого типа СЭД основана на определении маркеров полиморфизма в локусе гена, расположенного в длинном плече 2-й хромосомы (2q24.3-q31) и кодирующего III тип коллагена (COL3A1). Анализ этой последовательности позволяет идентифицировать генные аномалии и лежит в основе генетического консультирования и пренатальной диагностики заболевания. Однако данное исследование проводится лишь в ограниченном числе лабораторий [11–15].
По данным M. Pepin, осложнения беременности привели к смерти 12 из 81 женщин, страдающей IV типом СЭД. Большинство смертельных случаев связано со спонтанным разрывом артерий, матки или кишечника. У пациенток с IV типом СЭД во время беременности могут присутствовать случаи разрыва матки в сочетании с некрозом кишечника, расслоения коронарной артерии с развитием инфаркта миокарда, разрыва аорты, подвздошной артерии и тощей кишки, расслоения аорты, наблюдались случаи задержки роста плода [9–13].
Ввиду трудности прогнозирования фатальных осложнений СЭД у пациенток акушерского профиля любое описание клинического случая полезно для врачей акушеров-гинекологов, ангиохирургов и анестезиологов-реаниматологов. В последнее десятилетие акушеры-гинекологи Свердловской области столкнулись с двумя случаями фатальных осложнений СЭД, закончившимися летальными исходами.
Клиническое наблюдение № 1
Пациентка М., 35 лет, жительница Свердловской области, поступила 05.06.2019 в акушерское отделение на дородовую госпитализацию с диагнозом: Беременность 38–39 недель. Хроническая плацентарная недостаточность. Врожденный порок сердца: расширение ствола легочной артерии с трикуспидальной недостаточностью, регургитацией I ст. НК0. Хроническая анемия легкой степени тяжести. Варикозная болезнь вен нижних конечностей.
Пациентка родилась доношенным ребенком в сроке 36 недель, в семье молодых родителей. Росла и развивалась соответственно возрасту. Мать пациентки погибла в 45 лет от инсульта. Первая беременность наступила самостоятельно после эпизода первичного бесплодия в течение 5 лет и в 2015 г. закончилась срочными родами здоровым ребенком массой 3900 г. Ранний послеродовый период осложнился гипотоническим кровотечением (объем кровопотери 1000 мл), проводилось ручное обследование полости матки, инфузия свежезамороженной плазмы. Вторая беременность в 2017 г. – неразвивающаяся, проводилось выскабливание полости матки. Настоящая беременность третья по счету, наступила после эпизода вторичного бесплодия, после медикаментозной стимуляции клостилбегитом. В сроке гестации 24 недели впервые диагностирован порок сердца по данным эхокардиографии: выявлено расширение легочной артерии, аортальная, митральная регургитация 1 степени и трикуспидальная регургитация 2 степени с давлением в правом желудочке 41 мм.рт.ст. Изменений по электрокардиографии выявлено не было. Артериальной гипертензии за время наблюдения не отмечено. Дважды, в 24 и 35 недель, была проведена консультация кардиолога, рекомендовано родоразрешение по акушерской ситуации в условиях перинатального центра 3 уровня, противопоказаний для родов через естественные родовые пути со стороны сердечно-сосудистой системы выявлено не было.
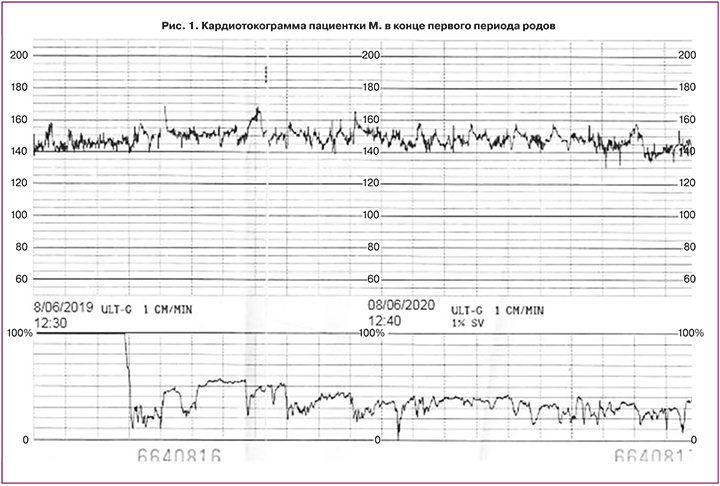
При поступлении в отделение патологии беременности в сроке 38–39 недель жалоб пациентка не предъявляла. По данным ультразвукового исследования, плод соответствовал сроку, показатели допплерометрии в норме. При первичном осмотре кожных покровов обращало на себя внимание наличие на передней брюшной стенке ниже пупка экхимоза, диаметром 2–3 см. При дополнительном расспросе установлено, что пациентка отмечала появление синяков на коже при минимальном физическом воздействии. Пациентке было проведено полное клинико-лабораторное обследование, согласно приказу № 572: отклонений от референсных значений не выявлено. Был составлен консервативный план ведения родов. 08.06.2019 в сроке беременности 38–39 недель у пациентки было зафиксировано спонтанное начало родовой деятельности, в связи с чем женщина переведена в родовое отделение. При динамическом наблюдении за состоянием пациентки и внутриутробного плода до потужного периода отклонений от физиологического течения не зарегистрировано. Проводился постоянный фетомониторинг вплоть до потужного периода – без патологии (рис. 1). Общая продолжительность первого периода родов составила 5 ч 45 мин. Период изгнания продолжался 10 минут. В связи с угрозой разрыва промежности по рубцу в потугах произведена левосторонняя эпизиотомия. Ребенок родился самостоятельно – живой, доношенный, масса 3710 г, длина 53 см, в состоянии тяжелой гипоксии, с оценкой по шкале Апгар 2/5/6 баллов, что потребовало проведения искусственной вентиляции легких и управляемой гипотермии в раннем неонатальном периоде с хорошим эффектом. В настоящее время мальчику 1 год, растет и развивается в соответствии с возрастом.
В третьем периоде родов, через 5 минут после рождения плода, при отсутствии признаков отделения последа у родильницы было отмечено резкое ухудшение состояния с угнетением сознания и развитием гипотонии. Под внутривенным наркозом проведено ручное обследование полости матки, при котором диагностирован полный линейный вертикальный разрыв матки по передней стенке, ближе к левому ребру. Через 10 минут проведена нижнесрединная лапаротомия, в брюшной полости обнаружено около 1000 мл жидкой крови. Начато проведение гемотрансфузии. Операция проводилась в условиях развернутого «Cell-saver».
При ревизии органов малого таза выявлен отрыв матки от переднего свода влагалища. В связи с продолжающимся кровотечением выставлены показания к гистерэктомии и лигированию внутренних подвздошных артерий. Общая кровопотеря составила 4000 мл. К операции присоединился сосудистый хирург.
При ушивании культи влагалища выявлен разрыв левого свода и левой боковой стенки влагалища, уходящий в паравагинальную клетчатку. Обнаружен разрыв наружной подвздошной вены слева. Сосудистым хирургом вскрыт задний листок брюшины, выделены подвздошные сосуды. Выявлено, что источником кровотечения является линейный дефект левой наружной подвздошной вены на протяжении 7 мм, на 2 см ниже места слияния с внутренней. Попытки ушивания дефекта неэффективны – нити прорезают истонченную стенку с формированием дефектов еще больших размеров.
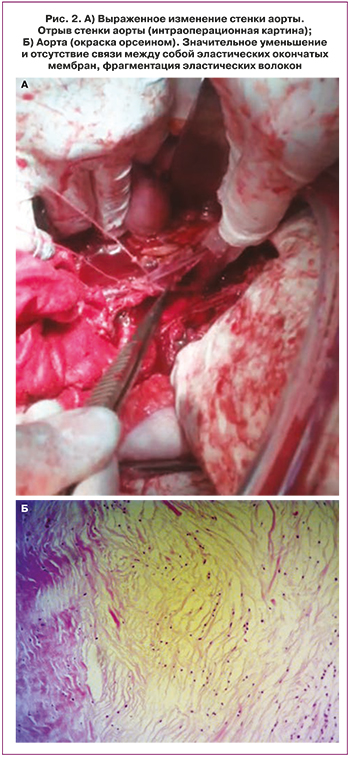 Учитывая тяжесть состояния больной (клиническая смерть с эффективной сердечно-легочной реанимацией), принято решение о лигировании наружной подвздошной вены, что и было выполнено. Однако, при дальнейшей ревизии выявлено кровотечение из продольного линейного дефекта до 3 мм левой внутренней подвздошной артерии в 0,5 см от ее устья. При наложении лигатуры на проксимальный отдел вышеуказанного сосуда произошел отрыв артерии от устья. Бифуркация общей подвздошной артерии была отсечена, выполнен циркулярный шов между общей и наружной подвздошными артериями. В дальнейшем, на фоне часто продолжающихся реанимационных мероприятий, выявлено массивное кровотечение в верхнем углу раны из забрюшинного пространства (вне зоны прямых хирургических манипуляций). Выделен источник кровотечения – бифуркация подвздошных артерий справа по медиальной стенке. Затем диагностирован отрыв устья правой общей подвздошной артерии в месте наложения «держалок»: артерии пережаты клеммами Дебейки. Обнаружено обильное венозное кровотечение справа от аорты. Выделена нижняя полая вена на протяжении, обнаружено 2 линейных сквозных дефекта нижней полой вены размером до 0,5 см. Предпринятые попытки ушивания дефектов неэффективны – снова прорезывание стенки нитями, выполнено лигирование нижней полой вены на протяжении. Далее обнаружен линейный дефект длиной до 0,5 см ниже устья нижней брыжеечной артерии, аорта взята в периферические зажимы; попытка ушивания закончилась отрывом фрагмента ее стенки (рис. 2).
Учитывая тяжесть состояния больной (клиническая смерть с эффективной сердечно-легочной реанимацией), принято решение о лигировании наружной подвздошной вены, что и было выполнено. Однако, при дальнейшей ревизии выявлено кровотечение из продольного линейного дефекта до 3 мм левой внутренней подвздошной артерии в 0,5 см от ее устья. При наложении лигатуры на проксимальный отдел вышеуказанного сосуда произошел отрыв артерии от устья. Бифуркация общей подвздошной артерии была отсечена, выполнен циркулярный шов между общей и наружной подвздошными артериями. В дальнейшем, на фоне часто продолжающихся реанимационных мероприятий, выявлено массивное кровотечение в верхнем углу раны из забрюшинного пространства (вне зоны прямых хирургических манипуляций). Выделен источник кровотечения – бифуркация подвздошных артерий справа по медиальной стенке. Затем диагностирован отрыв устья правой общей подвздошной артерии в месте наложения «держалок»: артерии пережаты клеммами Дебейки. Обнаружено обильное венозное кровотечение справа от аорты. Выделена нижняя полая вена на протяжении, обнаружено 2 линейных сквозных дефекта нижней полой вены размером до 0,5 см. Предпринятые попытки ушивания дефектов неэффективны – снова прорезывание стенки нитями, выполнено лигирование нижней полой вены на протяжении. Далее обнаружен линейный дефект длиной до 0,5 см ниже устья нижней брыжеечной артерии, аорта взята в периферические зажимы; попытка ушивания закончилась отрывом фрагмента ее стенки (рис. 2).
Учитывая выраженные изменения стенки магистральных сосудов, неэффективность длительной сердечно-легочной реанимации, констатирована биологическая смерть. За время проведения оперативного вмешательства общий объем кровопотери составил 12 000 мл, проводилась донорская эритроплазмотрансфузия: эритроцитарная взвесь 3117 мл, свежезамороженная плазма 5220 мл, аутоинфузия крови с помощью аппарата «Cell Saver» – 3000 мл, криопреципитат 10 доз. Общая инфузия составила 16 837 мл (в том числе кристаллоиды 5000 мл и коллоиды 1000 мл). Общая продолжительность операции составила 6 ч 35 мин., общая продолжительность сердечно-легочной реанимации составила 1 ч 40 мин.
В патологоанатомическом заключении описаны имеющиеся у пациентки клинические признаки из группы малых критериев сосудистого типа СЭД, на которых не принято акцентировать внимание в истории болезни при отсутствии анамнестических данных: бледная, тонкая, полупрозрачная, легко растяжимая кожа с видимым кожным рисунком вен (на грудной клетке, животе) и характерный вид лица (крупные глаза, заостренный нос, тонкие губы). На аутопсии в органах и тканях визуализированы изменения, характерные для острого малокровия, гиповолемического шока, также обнаружены некоторые макроскопические признаки дисплазии сердечно-сосудистой системы: гипоплазия трикуспидального клапана, расширение легочной артерии, удвоение устья ствола левой коронарной артерии, резкое истончение стенок магистральных сосудов при нормальном их диаметре (толщина стенки аорты на уровне почечных артерий 1 мм, верхняя и нижняя полые вены также с очень тонкой, практически прозрачной стенкой). Локализация лигатур и сосудистых швов соответствовала описанию протокола хирургического вмешательства. Удаленная матка нормальных размеров, стенка толщиной 2–2,5 см, с мелкими миоматозными узлами, по левому ребру сквозной линейный дефект стенки длиной до 15 см с переходом на шеечную часть.
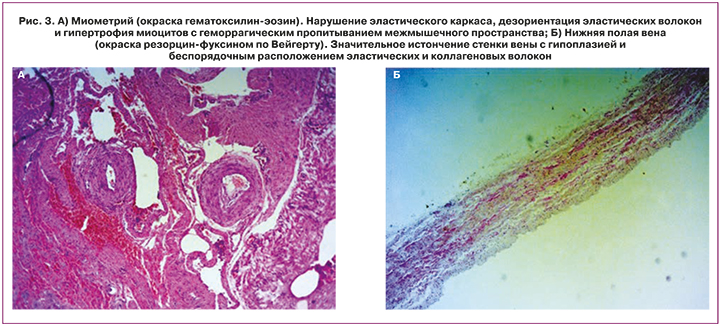
При изучении гистологической структуры также были выявлены признаки соединительнотканной дисплазии: гипоплазия эластических волокон кожи, сосудов матки, аорты и нижней полой вены (фрагментация коллагеновых и эластических волокон, нарушение целостности эластической мембраны), склероз и миксоматозная дегенерация митрального клапана и легочной артерии (рис. 3). При молекулярно-генетическом типировании фибробластов кожи выявлена аномальная миграция α1(III)-цепей проколлагена при электрофорезе белков в полиакриламидном геле в присутствии додецилсульфата натрия по методу Лэммли. Методом клинического высокопроизводительного секвенирования (NGS) проведено исследование генов, ассоциированных с СЭД. Выявлена гетерозиготная мутация в гене COL3A1 (транскрипт NM_000090.3), имеющая признаки патогенности.
Клиническое наблюдение №2
Пациентка Г., 29 лет, повторнобеременная, первородящая. В анамнезе: медицинский аборт в 11–12 недель с осложнениями в постабортном периоде (гипертермия до 38°С). Экстрагенитальные заболевания: варикозная болезнь, нарушение жирового обмена 2 ст., гестационная артериальная гипертензия. Из осложнений настоящей беременности отмечается токсикоз первой половины до 15 недель. В сроке 40 недель поступила на дородовую госпитализацию в городской родильный дом (учреждение второго уровня) для подготовки к родам и родоразрешения. После полного клинико-лабораторного обследования пациентке был составлен консервативный план ведения родов. Через 2 дня была переведена в родовое отделение в связи с началом родовой деятельности и ранним излитием околоплодных вод. С целью обезболивания проведена эпидуральная анестезия. В родах проводился фетомониторинг: без патологических изменений. В потужном периоде зафиксировано страдание плода с резким снижением частоты сердечных сокращений до 50 ударов в минуту, в связи с чем выполнена эпизитомия, и через 3 минуты пациентка родоразрешилась самостоятельно мертвым плодом мужского пола массой 2927 г, длиной 53 см. Общая продолжительность родов составила 11ч 50 мин. Через 10 минут при осмотре родовых путей под внутривенной анестезией зарегистрировано снижение артериального давления до 80–60 мм.рт.ст., при частоте сердечных сокращений 112 в 1 минуту. Наружная кровопотеря на данном этапе составила 300 мл. В связи с продолжающейся артериальной гипотонией решено провести ручное обследование полости матки, при котором диагностирован неполный разрыв матки. Проведена нижнесрединная лапаротомия. Выполнена экстирпация матки с трубами. В связи с диффузной кровоточивостью параметриев, необходимостью обеспечения эффективного гемостаза после формирования культи влагалища показана перевязка внутренних подвздошных артерий. Вызваны сосудистые хирурги. Начат сосудистый этап, проведена перевязка левой внутренней подвздошной артерии. Справа при обхождении внутренней подвздошной артерии выявлено активное венозное кровотечение. Источник – правая подвздошная вена. Кровотечение из вены остановлено с большими техническими трудностями. При отведении наружной подвздошной артерии произошел ее разрыв. Проведено протезирование наружной подвздошной артерии. Было проведено ушивание промежности. При ревизии брюшной полости обнаружено активное венозное кровотечение, для остановки которого лапаротомия расширена до срединной. В течение 3 часов проведены попытки ушивания линейного дефекта нижней полой вены: без эффекта. Попытки ушить спонтанные дефекты стенки нижней полой вены сопровождались появлением новых дефектов вследствие крайне тонкой и слабой стенки вены. Этап завершен перевязкой нижней полой вены. Далее проведено дренирование брюшной полости, ушивание лапаротомного разреза. Общая кровопотеря составила 7000 мл. Объем инфузионно-трансфузионной терапии составил 13 297 мл, в т.ч. эритроцитарная масса – 2527 мл, плазмозаменители – 2000 мл, кристаллоиды – 6050 мл. Через 2 часа с момента завершения операции зарегистрирована остановка сердца, затем при неэффективности реанимационных мероприятий, выполненных в полном объеме, констатирована биологическая смерть.
Патологоанатомический диагноз: основное заболевание: СЭД, «сосудистый» (IV) тип: варикозная болезнь вен нижних конечностей (обменно-уведомительная карта беременной и родильницы, история родов), самопроизвольный трансмуральный разрыв матки во время срочных родов мертвым плодом мужского пола, массой 2927 г, длиной 53 см; спонтанные разрывы правой подвздошной вены, правой наружной подвздошной артерии и нижней полой вены.
Осложнения: массивная кровопотеря с геморрагическим шоком. Обширная геморрагическая инфильтрация забрюшинной и подбрюшинной клетчатки. Острое малокровие внутренних органов. Следует отметить, что пациентка родоразрешалась в 2013 г., анализ проведен ретроспективно по медицинской документации).
Обсуждение
При сопоставлении клинического течения и данных патологоанатомического заключения можно отметить, что у обеих пациенток имеются признаки дисплазии соединительной ткани, преимущественно затрагивающие сердечно-сосудистую систему: у обеих пациенток имеется варикозная болезнь. У пациентки М. при беременности выявлен порок сердца без серьезных гемодинамических нарушений. К сожалению, имеющиеся у пациентки М. клинические признаки из группы «малых» критериев сосудистого типа СЭД, на которых не принято акцентировать внимание в истории болезни при отсутствии анамнестических данных: бледная, тонкая, полупрозрачная, легко растяжимая кожа с видимым кожным рисунком вен (на грудной клетке, животе) и характерный вид лица (крупные глаза, заостренный нос, тонкие губы), были описаны только постмортально, а у пациентки Г. в медицинской документации вообще не отражены (анализ случая проводился ретроспективно). Обращает на себя внимание описанный при поступлении экхимоз на передней брюшной стенке у пациентки М., что является косвенным подтверждением неполноценности сосудистой стенки у данной пациентки. В литературе описано, что даже банальное измерение артериального давления у данной категории пациенток может вызвать гематомы в месте наложения манжеты. Кроме описанного, факт гибели матери пациентки в молодом возрасте от инсульта свидетельствует о наследственно-обусловленной сосудистой патологии. Следует отметить, что на данном этапе молекулярно-генетическое типирование генетических дефектов не внедрено в широкую практику, это вопрос будущего.
Беременность и роды у больных с СЭД сопряжены с высоким риском осложнений со стороны матери и плода. Однако, серьезных осложнений течения беременности у обеих пациенток не отмечено. Имеется также факт относительно благополучного течения первых родов у пациентки М. (роды осложнились только гипотоническим кровотечением, с которым докторам удалось справиться консервативно). Однако, по данным литературы известно, что изменения сосудов у пациентов с СЭД усугубляются после 30 лет, о чем свидетельствует и данное клиническое наблюдение. У обеих женщин самостоятельно началась родовая деятельность, никаких предикторов и клинических признаков угрозы разрыва матки до этапа родоразрешения выявлено не было. Обращает внимание резкое ухудшение состояния плодов в периоде потуг, которое закончилось интранатальной гибелью плода у пациентки Г. и рождением ребенка в состоянии тяжелой асфиксии у пациентки М.
Очевидно, что катастрофа произошла уже на финальном этапе родового акта, в обоих случаях разрывы матки диагностированы уже после рождения плода. Множественные спонтанные разрывы сосудов, выявленные при оперативном лечении, – свидетельство фатальной неполноценности сосудистой стенки. Их хирургическая коррекция, предпринятая квалифицированными сосудистыми хирургами, к сожалению, не привела к успеху в обоих случаях.
В литературе нет единого мнения о безопасном родоразрешении пациенток с СЭД, поскольку любое оперативное вмешательство у данной категории пациенток чревато кровотечением, связанным со спонтанными разрывами неполноценной сосудистой стенки.
Заключение
По результатам анализа двух вышеописанных случаев мы считаем, что для успешного исхода беременности у таких больных следует обращать внимание на «большие» и «малые» фенотипические признаки СЭД и при малейшем подозрении на него рекомендовать пациентке молекулярно-генетическое исследование генов III типа коллагена на этапе планирования беременности, а также консультацию сосудистого хирурга и клинического генетика для определения плана молекулярно-генетического обследования.
У пациенток с подтвержденным диагнозом следует рекомендовать плановое абдоминальное родоразрешение в перинатальном центре третьего уровня с участием мультидисциплинарной бригады: квалифицированные акушеры-гинекологи, бригада сосудистых хирургов, бригада врачей-реаниматологов и трансфузиологов. Во время оперативного родоразрешения должны быть использованы кровесберегающие технологии («Cell-saver»).
В связи с высокой частотой осложнений послеродового периода у пациентов с СЭД считаем целесообразным увеличение длительности наблюдения за такими пациентками в послеродовом периоде.



