В последние десятилетия отмечается четкая тенденция роста аномалий органов мочевыделительной системы (МВС) [1]. Данное обстоятельство обусловлено как большим разнообразием форм указанной патологии, так и увеличением общего количества врожденных пороков развития (ВПР) [2].
Среди врожденных аномалий мочевыделительных органов наиболее часто встречаются различные варианты обструктивных уропатий (ОУ), достигая 87% [3]. Затруднение оттока мочи, обусловленное наличием препятствия по ходу мочевых путей, может локализоваться на различных их уровнях и отличаться вариабельностью степени поражения почек и как следствие – тяжестью клинических проявлений и прогнозом заболевания.
Наиболее частым проявлением обструкции мочевыводящих путей является гидронефроз, который характеризуется стойким расширением чашечно-лоханочного комплекса (ЧЛК). Основными эхографическими критериями врожденного гидронефроза являются увеличение переднезаднего размера лоханки (ПЗРЛ) почки более 7 мм, увеличение показателя ПЗРЛ к паренхиме почки более 0,5 или наличие каликопиелоэктазии. Однако данные параметры не всегда точно отражают функциональные резервы почек плода при ОУ. К важным параметрам, определяющим прогноз для жизни новорожденных при последних, относятся срок беременности, на котором порок сформировался, отдел мочевыводящих путей, вовлеченных в процесс, состояние контралатеральной почки, степень расширения ЧЛК, толщина паренхимы.
 Несмотря на данные, приведенные выше, пренатальная ультразвуковая диагностика пороков МВС сводится к их выявлению, однако прогнозирование постнатального исхода на основании этих параметров не всегда представляется возможным.
Несмотря на данные, приведенные выше, пренатальная ультразвуковая диагностика пороков МВС сводится к их выявлению, однако прогнозирование постнатального исхода на основании этих параметров не всегда представляется возможным.
В настоящее время большой интерес у исследователей вызывает применение трехмерной (3D) эхографии при ВПР плода [4, 5]. В первую очередь 3D-сканирование нашло свое применение в качестве метода уточняющей диагностики после обнаружения при скриннинговом ультразвуковом исследовании в двухмерном режиме изменений анатомии плода [6]. Появление новых 3D-эхографических технологий, таких как VOCAL и SonoAVC, интегрированных в современные ультразвуковые системы, открывает новые горизонты в пренатальной диагностике аномалий МВС плода.
В режиме VOCAL использованы определенные алгоритмы для автоматического определения контуров структур и расчета их объема в пределах области, определяемой пользователем. Режим SonoAVC представляет собой программное обеспечение, разработанное для автоматического расчета объема заполненных жидкостью (анэхогенных) структур. С помощью данной программы они идентифицируются, определяются их количество, а также высчитываются абсолютные размеры, средний диаметр и объем [7].
В доступной к изучению литературе нам не встретились сообщения о комплексном применении 3D-эхографии в разные сроки беременности у плодов с неизмененными почками и при ОУ.
Цель данного исследования состояла в определении роли 3D-эхографии (режимы VOCAL и SonoAVC) в оценке степени поражения почек при врожденных ОУ у плода.
Материал и методы исследования
Исследование выполнялось на базе отделений функциональной диагностики и хирургии, реанимации и интенсивной терапии новорожденных ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России в период с 2011 по 2012 г. Критериями включения в исследование были: одноплодная беременность, отсутствие экстрагенитальной патологии и отягощенного акушерско-гинекологического анамнеза у беременной, срок беременности от 20 до 40 недель. В основу данной работы положен проспективный анализ методом случай-контроль. Основная группа – 45 плодов с антенатально выявленными ОУ (с увеличением ПЗРЛ более 7 мм). Контрольную группу составили 45 здоровых плодов без каких-либо пороков развития. Критерии исключения – отказ пациентов от исследования и/или невозможность наблюдения.
Обследование беременных проводили на ультразвуковом приборе Voluson-Е8 (General Electric, США) с использованием трансабдоминального конвексного мультичастотного датчика 4–8 МГц. Для исключения влияния разных настроек ультразвуковой системы при проведении всех исследований они устанавливались одни и те же, и были следующими: gain − 5; speckle reduction imaging (SRI) – 2; CrossXBeam CRI (Compound Resolution Imaging) – 3; CRI filter – high; enhance – 2; reject – 25; harmonics – high. Участие в исследовании двух независимых специалистов отделения Центра придавало объективность полученным данным пренатальной ультразвуковай диагностики.
В обеих группах были проанализированы линейные размеры почек, степень расширения ЧЛК – ПЗРЛ и размер чашечек и мочеточника при его дилатации, толщина сохраненной паренхимы (рис. 1 cм. на вклейке).
3D-сканирование каждой почки выполнялось раздельно. В ходе исследования при помощи приложения VOCAL был определен объем почки, а режима SonoAVC – объем ЧЛК (рис. 2, 3 см. на вклейке).
Объем паренхимы почки рассчитывался путем вычитания значения объема ЧЛК, полученного в режиме SonoAVC, из показателей объема всей почки, полученного в режиме VOCAL (рис. 4 см. на вклейке).
В комплекс обследования новорожденных входили общие клинические исследования, для оценки функции почек применялась магнитно-резонансная томография с контрастированием.
Полученные данные были обработаны методами описательной статистики и представлены в виде среднего ± стандартного отклонения, а также с использованием программ Excel (Microsoft Office 2007) и STATISTICA 6 (StatSoft). Математические методы обработки данных включали статистический и корреляционный анализы. Для определения значимости различий сопоставляемых величин использовали Kruskal–Wallis ANOVA тест и χ2-тест. За уровень статистической достоверности принято значение коэффициента Пирсона менее 0,05.
Результаты исследования
 При проведении ультразвукового исследования среди 45 плодов с ОУ (с 59 измененными почками) одностороннее поражение почки было установлено у 29 (64,4%), двустороннее – у 16 (35,6%). В зависимости от степени расширения ПЗРЛ все 59 измененных почек были разделены на три группы: незначительное расширение (ПЗРЛ 7–9 мм) было выявлено в 25,4% случаях, умеренное расширение (ПЗРЛ 9–15 мм) – в 39% и выраженное расширение (ПЗРЛ >15 мм) – в 35,6%.
При проведении ультразвукового исследования среди 45 плодов с ОУ (с 59 измененными почками) одностороннее поражение почки было установлено у 29 (64,4%), двустороннее – у 16 (35,6%). В зависимости от степени расширения ПЗРЛ все 59 измененных почек были разделены на три группы: незначительное расширение (ПЗРЛ 7–9 мм) было выявлено в 25,4% случаях, умеренное расширение (ПЗРЛ 9–15 мм) – в 39% и выраженное расширение (ПЗРЛ >15 мм) – в 35,6%.
В процессе исследования объем почек рассчитывался по формуле объема эллипса на основании трех линейных размеров, и при 3D-сканировании с помощью режима VOCAL. В табл. 1 представлены результаты измерения объектов неизмененных почек и при ОУ, рассчитанные в разные сроки беременности.
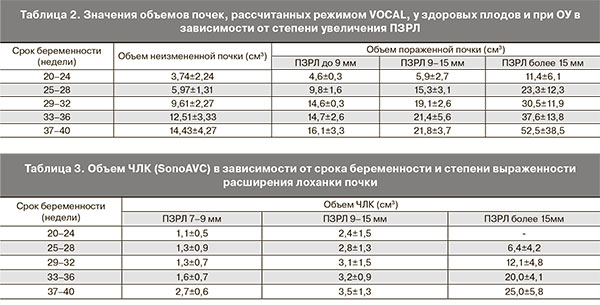
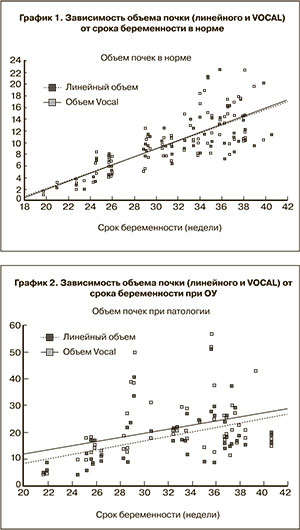
При проведении сравнительного анализа объемов неизмененных почек, рассчитанных по двум перечисленным выше методам, статистически значимых различий выявлено не было (табл. 1, график 1).
В то же время у плодов с ОУ объем почек, измеренный указанными методами, различался статистически (р<0,01) (график 2, табл. 1).
Из приведенных в табл. 1 и на графике 2 данных видно, что объем пораженных почек, измеренный при 3D-сканировании с помощью режима VOCAL, оказался больше.
В ходе корреляционного анализа было установлено, что на значения объема пораженного органа влияние оказывает степень расширения собирательной системы почки. В табл. 2 представлена зависимость объема пораженной почки от выраженности расширения ЧЛК.
Данные проведенных расчетов (табл. 2) свидетельствуют о том, что начиная с 20 недель беременности отмечалось увеличение объема почки, особенно выраженное при расширении ПЗРЛ более 15 мм, а начиная с 25 недель – и при расширении ПЗРЛ более 9 мм (р<0,01).
В ходе исследования во всех 59 измененных почках при помощи приложения SonoAVC был определен объем ЧЛК, результаты которого представлены в табл. 3.
Представленные в табл. 3 данные наглядно демонстрируют изменение объема ЧЛК со сроком беременности и степенью увеличения ПЗРЛ. Также в ходе корреляционного анализа установлена прямая зависимость объема ЧЛК с объемом почки, ПЗРЛ, размером чашечек, толщиной паренхимы (р<0,01).
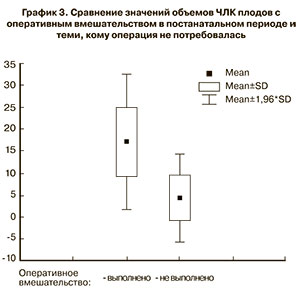
В постнатальном периоде оперативное вмешательство потребовалось 22 из 45 (48,9%) новорожденным основной группы. При анализе объема ЧЛК, измеренного в III триместре беременности, у данной группы пациентов было установлено значительное увеличение этого показателя, который колебался от 9,1 до 30,2 см3 и в среднем составил 17,2±7,8 см3. В то же время объем ЧЛК почек плодов, которым хирургическое лечение не проводилась, был значительно меньше и составлял в среднем 4,4±5,1 (0,5–21,9) см3 (p<0,001) (график 3).
У 20% (9) новорожденных с врожденной обструкцией мочевыводящих путей было выявлено нарушение функции почки. Как показали результаты проведенного анализа, у данного контингента пациентов объем ЧЛК почек в антенатальном периоде был достоверно больше, чем у новорожденных с нормальной функцией почек, и составил соответственно 19,9±7,3 (12,8–30,2) см3 и 5,7±6,3 (0,5–22,8) см3 (р<0,01).
В процессе данного исследования у плодов основной и контрольной групп был произведен расчет объема паренхимы почек (табл. 4).
Результаты, представленные в табл. 4, наглядно демонстрируют увеличение объема паренхимы почки как в контрольной, так и основной группах в зависимости от срока беременности. По данным корреляционного анализа, объем паренхимы зависел от степени расширения ЧЛК (р<0,01).
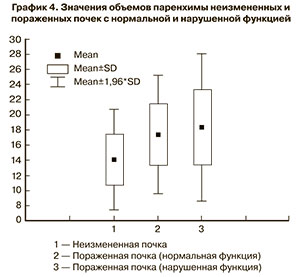
При сравнении значений объемов паренхимы почки, измеренных антенатально в III триместре у беременных с ОУ у плодов и без таковых, было установлено, что данный параметр в основной группе составил 18,0±4,6 (10,1-31,9) см3 и был достоверно больше, чем в контрольной – 14,1±3,4 (10,3–19,4) см3 (р<0,01). Также был произведен анализ показателей объема паренхимы почки с нарушенной ее функцией у 9 новорожденных (график 4).
При этом необходимо отметить, что статистически значимой разницы значений объема паренхимы пораженной почки при ее нормальном функционировании и нарушении выявлено не было. Так, объем паренхимы в первом из указанных случаев колебался от 10,3 до 31,9 см3 и в среднем составил 18,3±5,0 см3, а во втором – от 10,1 до 26,5 см3, в среднем – 17,4±4,1 см3.
Таким образом, приведенные выше данные указывают на то, что расчет объема паренхимы почки при ОУ нельзя использовать в качестве прогностического параметра, отражающего функцию почки в постнатальном периоде. Однако, несмотря на вышесказанное, проведенный анализ показал, что применение значений, полученных с помощью 3D-сканирования, и в первую очередь объем ЧЛК необходимо в оценке степени поражения почек при врожденных ОУ у плода.
Обсуждение
В настоящее время благодаря широкому использованию и совершенствованию пренатальной ультразвуковой диагностики наметилась тенденция к улучшению выявления аномалий развития плода. Новые эхографические технологии способствуют более тонкой детализации особенностей и топической диагностике ВПР, в частности аномалий органов МВС [8]. Последнее имеет большое прогностическое значение и во многом определяет тактику ведения беременности. По данным A. Sciarrone и соавт., применение 3D-эхографии в пренатальной оценке состояния почек весьма перспективно, особенно при различных формах обструктивных поражений [9].
Одной из главных возможностей 3D-сканирования является определение объема любой структуры, которая реализована и в акушерской практике. Так, F.A. Gerards и соавт. определяли объем легких у плодов с врожденной диафрагмальной грыжей для прогнозирования гипоплазии легких и состояния новорожденных [10].
В ходе настоящего исследования был измерен объем неизмененных почек и при ОУ, расчет которого производился по формуле объема эллипса на основании трех линейных размеров, и при 3D-сканировании с помощью режима VOCAL. По результатам корреляционного анализа увеличение объема пораженного органа напрямую зависело от степени выраженности расширения ЧЛК почки. Полученные данные свидетельствуют об увеличении объема пораженной почки, начиная с 20 недель беременности при выраженном расширении ПЗРЛ (более 15 мм), а с 25 недель – и при умеренном (ПЗРЛ от 9 до 15 мм) (р<0,01).
 При сравнении объемов неизмененных почек, рассчитанных как по формуле эллипса на основании трех линейных размеров, так и при объемной эхографии, значимых различий выявлено не было. Однако статистически достоверное различие объемов почек, измеренных двумя указанными методами, выявлено при ОУ (р<0,01). При этом объем почек, рассчитанный с помощью 3D–эхографии, оказался больше, что было также подтверждено в последующем у новорожденных при магнитно-резонансной томографии. Последнее указывает на то, что наиболее точное измерение объема патологически измененного органа возможно при 3D-сканировании с применением режима VOCAL. Так, по данным М. Riccabona и соавт., объем почки и ее паренхимы, полученный антенатально с использованием 3D-эхографии, у пациентов с ОУ сопоставим с данными, полученными при сцинтиграфии в неонатальном периоде [11]. Полученные нами результаты также согласуются с данными Y.Y. Hsieh и соавт., которые считают, что расчет объема органа в режиме VOCAL обладает высокой воспроизводимостью и точностью, сопоставимой с таковыми в двухмерном режиме [12].
При сравнении объемов неизмененных почек, рассчитанных как по формуле эллипса на основании трех линейных размеров, так и при объемной эхографии, значимых различий выявлено не было. Однако статистически достоверное различие объемов почек, измеренных двумя указанными методами, выявлено при ОУ (р<0,01). При этом объем почек, рассчитанный с помощью 3D–эхографии, оказался больше, что было также подтверждено в последующем у новорожденных при магнитно-резонансной томографии. Последнее указывает на то, что наиболее точное измерение объема патологически измененного органа возможно при 3D-сканировании с применением режима VOCAL. Так, по данным М. Riccabona и соавт., объем почки и ее паренхимы, полученный антенатально с использованием 3D-эхографии, у пациентов с ОУ сопоставим с данными, полученными при сцинтиграфии в неонатальном периоде [11]. Полученные нами результаты также согласуются с данными Y.Y. Hsieh и соавт., которые считают, что расчет объема органа в режиме VOCAL обладает высокой воспроизводимостью и точностью, сопоставимой с таковыми в двухмерном режиме [12].
В исследовании N. Raine-Fenning и соавт. была продемонстрирована высокая степень точности измерения in vitro объема объектов с помощью приложения VOCAL [13].
Согласно данным литературы, для повышения точности измерения объема органа при помощи приложения VOCAL необходимо использовать небольшой шаг вращения, так как в результате этого формируются несколько плоскостей, в каждой из которых производится очерчивание интересующей структуры. Однако данная техника измерения объема занимает больше времени, чем с небольшим количеством шагов. В нашем исследовании для расчета объема почки в режиме VOCAL был выбран шаг вращения в 90, в результате мы получали 20 контуров каждой почки, очерчивание которых и проводили.
В процессе данного исследования определялся объем ЧЛК плода при ОУ, который может быть использован в качестве нового маркера состояния органов МВС. По данным ряда исследователей, получение объема ЧЛК почек при помощи 3D-эхографии и магнитно-резонансной томографии является высоко воспроизводимым и точным как в исследованиях в in vitro, так и в естественных условиях [12, 14, 15]. Однако в литературных источниках, приведенных выше, подчеркивалась важность получения 3D-эхограмм высокого качества, воспроизводимость которых бывает затруднительной при ожирении беременной, наличии акустических теней от костей плода, при его двигательной активности. Кроме того, как упоминалось выше, для точного определения объема структур в режиме VOCAL требуется больше времени и имеется зависимость от шага вращения, который определяется исследователем.
Поэтому применение в качестве новой методики для определения объема анэхогенных структур режима SonoAVC, лишенного основных недостатков режима VOCAL, является весьма перспективным. Впервые в акушерско-гинекологической практике данное программное обеспечение было использовано в исследовании N. Raine-Fenning и соавт. для оценки объема фолликулов при стимуляции яичников в программе ЭКО и показана высокая степень его достоверности [16]. По данным G. Rizzo и соавт., расчет объема анэхогенных структур плода с помощью режима SonoAVC является более точным как по сравнению с приложением VOCAL, так и на основании трех линейных размеров [17]. Данное обстоятельство объясняется тем, что объем в приложении SonoAVC вычисляется на основании подсчета количества цветовых вокселов в интересующей структуре. Также еще одним существенным преимуществом расчета объема в указанном режиме по сравнению с режимом VOCAL является значительное сокращение времени получения результата.
В процессе нашего исследования с помощью режима SonoAVC производилась оценка объема ЧЛК и расчет объема паренхимы почки. По данным корреляционного анализа было установлено, что объем ЧЛК связан с объемом почки, ПЗРЛ, размером чашечек, толщиной паренхимы (р<0,05). Аналогичные результаты были получены в исследовании G. Tedesco и соавт. [18, 19].
Особый интерес представляют сравнительные данные о новорожденных с ОУ, которым было выполнено оперативное лечение (48,9%) и тех, кому оно не потребовалось. Так, у первых отмечено выраженное (более чем в 4 раза) увеличение объема ЧЛК, измеренного в III триместре беременности, по сравнению со вторыми. Также следует отметить, что у 9 новорожденных с нарушением функции почки объем ЧЛК, измеренный антенатально, был значительно увеличен (почти в 3,5 раза) по сравнению с теми, у которых функция была не изменена (p<0,001).
Таким образом, можно предположить, что клиническое применение данной методики возможно в дифференциальной диагностике нормы и патологии почек, а также для прогнозирования исхода в неонатальном периоде, а именно необходимости в последующем лечения и наблюдения.
В настоящем исследовании с помощью 3D-эхографии была предпринята попытка расчета объема паренхимы почки. При этом в процессе корреляционного анализа было установлено, что объем паренхимы зависел от срока беременности и степени расширения ЧЛК (р<0,001). Причем значения данного параметра у плодов с ОУ составили 18,0±4,6 (10,1–31,9) см3 и были достоверно больше, чем у таковых контрольной группы – 14,1±3,4 (10,3–19,4) см3 (p<0,001). Также был произведен анализ объема паренхимы почки у 9 новорожденных с нарушением ее функции. Однако статистически значимой разницы значений при нормальной функции почки и при ее нарушении установлено не было – 18,3±5,0 (10,3–31,9) см3 и 17,4±4,1 (10,1–26,5) см3 соответственно.
В заключении следует отметить, что применение 3D-эхографии при ОУ позволяет получить новую ценную информацию, которая влияет на тактику ведения беременности, способствует принятию решения о радикальном вмешательстве на дородовом этапе и тем самым снижает риск развития в дальнейшем тяжелых осложнений и инвалидизации ребенка.