Гестационный сахарный диабет (ГСД) представляет собой серьезную медико-социальную проблему, так как в значительной степени увеличивает частоту нежелательных исходов беременности для матери и для плода, а именно: хронической фетоплацентарной недостаточности, преэклампсии, преждевременных родов, хронической гипоксии плода, макросомии и как следствие – травм и асфиксии плода в родах. ГСД является фактором риска развития ожирения, сахарного диабета 2-го типа и сердечно-сосудистых заболеваний как у матери, так и у ее ребенка в будущем [1–7]. Распространенность ГСД в мире варьирует от 1 до 25,5% в зависимости от изучаемой популяции и применяемых методов диагностики [8–11]. В настоящее время увеличению числа новых случаев ГСД способствует жизнь в мегаполисе: постоянные стрессы, характер питания, низкая двигательная активность и как следствие – эпидемия ожирения. Заболеваемость ГСД увеличивается при реализации репродуктивной функции в возрасте старше 30 лет и применении вспомогательных репродуктивных технологий [12]. Ранняя диагностика ГСД и своевременное лечение могут сыграть значимую роль в сохранение здоровья матери и ребенка. Но начальные проявления ГСД в основном носят скрытый характер и могут быть выявлены только при проведении целенаправленного скрининга [1–3, 13]. Данных о результатах раннего скрининга ГСД на сегодняшний день недостаточно.
Цель исследования: оценить роль раннего скрининга ГСД для оптимизации перинатальных исходов.
Материал и методы исследования
Проведено проспективное сравнительное исследование двух групп беременных с ГСД.
1-я группа (n=44) – беременные с ГСД, выявленным при сплошном скрининге 646 беременных, вставших на учет в одной женской консультации Екатеринбурга в 2011 г. Всем беременным при постановке на учет, начиная с I триместра, независимо от наличия факторов риска ГСД проводили двухчасовой пероральный глюкозотолерантный тест (ПГТТ) с 75 г безводной глюкозы. При отрицательных результатах теста его повторяли в сроке 24–32 недели. Критерии исключения: наличие у женщины прегестационного сахарного диабета. ПГТТ не назначали при уровне гликемии в венозной плазме натощак ≥7,0 ммоль/л или при случайном определении ≥11,1 ммоль/л. ПГТТ не проводили на фоне приема препаратов, повышающих уровень гликемии, и при наличии острого заболевания [14].
2-я группа (n=97) – группа сравнения: сплошная выборка беременных с ГСД, наблюдавшихся и родоразрешенных в ФГБУ НИИ ОММ в 2009 г. по приказу Свердловского областного министерства здравоохранения о маршрутизации беременных. ГСД у пациенток 2-й группы был диагностирован либо по гипергликемии натощак ≥7,0 ммоль/л, впервые возникшей или выявленной во время беременности, либо при наличии факторов риска ГСД по результатам ПГТТ с 75 г безводной глюкозы в 16–28 недель в соответствии с «Алгоритмами специализированной медицинской помощи больным сахарным диабетом» (2009 г.) [15].
Диагноз ГСД у пациенток обеих групп был верифицирован в соответствии с критериями Всемирной организации здравоохранения (ВОЗ) 1999 года: уровень гликемии натощак ≥7,0 ммоль/л дважды или через 2 часа после ОГТТ с 75 г глюкозы ≥ 7,8 ммоль/л [14, 15].
Клинические методы диагностики включали анкетирование сплошным методом по специально разработанной анкете, оценку степени риска развития ГСД, консультации акушера-гинеколога, эндокринолога, измерение артериального давления, массы тела, вычисление индекса массы тела (ИМТ) до беременности по формуле: ИМТ=(масса тела до беременности, кг)/(рост, м)2, общие клинические анализы крови и мочи.
Концентрацию глюкозы в венозной плазме определяли глюкозооксидазным методом с использованием наборов фирмы «Randox» (Великобритания) на биохимическом анализаторе «Sapphire 400» (Япония).
Между сравниваемыми группами не было статистически значимой разницы по возрасту, ИМТ, уровню гликемии при диагностике ГСД (табл. 1), паритету, социальному положению, характеру и степени тяжести экстрагенитальной патологии.
Все пациентки с момента диагностики ГСД находились под наблюдением эндокринолога и акушера-гинеколога. Лечение ГСД в обеих группах включало диету № 9, самоконтроль гликемии с помощью глюкометра утром натощак, до и через 1 час после основных приемов пищи, перед ночным сном и ночью в 3.00. Инсулинотерапия назначалась при невозможности достижения на диете в течение 1–2 недель целевого уровня гликемии венозной плазмы: натощак, перед едой, перед сном, ночью – 3,3–5,5 ммоль/л, через 1 час после еды – 5,6–7,2 ммоль/л [16].
Статистический анализ фактического материала был выполнен с применением программ Statistica 6.0, Biostat 3.03, с использованием критериев Стьюдента (t), χ2, коэффициентов корреляции Пирсона (r) и Спирмена (rs). Данные в тексте и таблицах представлены в виде M±σ, где М – среднее, σ – стандартное отклонение. Критический уровень значимости (р) при проверке гипотез равен 0,05.
Результаты исследования и обсуждение
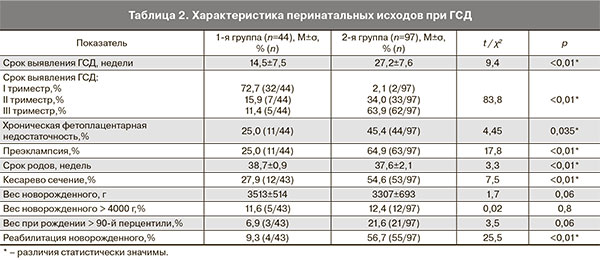
Распространенность ГСД по результатам сплошного скрининга 646 беременных составила 6,8% (44/646). Срок выявления диабета: в первом триместре – 72,7% (32/44), во втором – 15,9% (7/44), в третьем – 11,4% (5/44). Факторы риска ГСД отсутствовали у 18,2% (8/44) пациенток. Следовательно, проведение выборочного скрининга только у женщин с факторами риска привело бы к недооценке истинной распространенности ГСД.
В первой группе беременность у 25% (11/44) женщин осложнилась хронической фетоплацентарной недостаточностью, в том числе в одном случае развился синдром задержки развития плода. Формирование преэклампсии было отмечено у 25% (11/44) беременных (табл. 2). В одном случае была зарегистрирована неразвивающаяся беременность в сроке 12 недель. Родоразрешение всех пациенток первой группы произошло в сроке доношенной беременности. Самостоятельно были родоразрешены 72,1% (31/43) беременных, операцией кесарева сечения – 27,9% (12/43), из них в связи с макросомией плода – 50% (6/12). На второй этап реабилитации были переведены 9,3% (4/43) новорожденных (табл. 2).
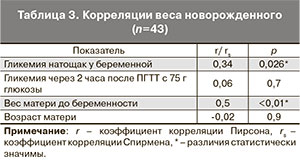
При анализе полученных результатов выявлена положительная корреляция между весом новорожденного и уровнем гликемии натощак у беременной (r=0,34, p=0,026), весом новорожденного и весом женщины до беременности (r=0,5, p<0,01), уровнем гликемии натощак при беременности и весом женщины до беременности (r=0,4, p=0,003). Значимых корреляций между уровнем гликемии через 2 часа после ПГТТ с 75 г глюкозы у беременной и изучаемыми параметрами выявлено не было (табл. 3).
Во 2-й группе ГСД был диагностирован в первом триместре у 2,1% (2/97) беременных, во втором – у 34,0% (33/97), в третьем – у 63,9% (62/97) (см. табл. 2).
Во 2-й группе беременность осложнилась хронической фетоплацентарной недостаточностью у 45,5% (44/97) женщин, в том числе с формированием синдрома задержки развития плода у 31,8% (14/44). Преэклампсия была отмечена у 64,9% (63/97) беременных. Преждевременные роды составили 20,6% (20/97). Родоразрешение путем операции кесарева сечения имело место в 54,6% (53/97) случаев. При родах через естественные родовые пути у 9,1% (4/44) новорожденных был зафиксирован родовой травматизм. Гипогликемия наблюдалась у 11,3% (11/97) детей. Интенсивная терапия проводилась у 16,5% (16/97) новорожденных. На второй этап реабилитации были переведены 56,7% (55/97) детей (табл. 2).
При сравнении течения беременности и перинатальных исходов у беременных с ГСД было отмечено, что поздняя диагностика сахарного диабета чаще сопровождалась осложнениями. Так, в 1,8 раза чаще развивалась хроническая фетоплацентарная недостаточность, в 3,1 раза чаще – макросомия, в 2 раза чаще было выполнено кесарево сечение (табл. 2). В 1-й группе не было случаев преждевременных родов и гипогликемии новорожденных, тогда как в группе сравнения – 20,6% (20/97) и 11,3% (11/97) соответственно.
Таким образом, раннее выявление ГСД и, следовательно, своевременная коррекция углеводного обмена значительно улучшают перинатальные исходы. Однако проведение у беременных ПГТТ, особенно в первом триместре, вызывает сомнение в его безопасности как у акушеров-гинекологов и эндокринологов, так и у самих женщин. По нашим данным, только в 0,9% (6/646) случаев проведения ПГТТ была зарегистрирована побочная реакция в виде однократной рвоты. Все эти пациентки были в первом триместре беременности. Других побочных явлений и осложнений выявлено не было.
В клинической практике встречаются случаи тяжелого течения сахарного диабета, впервые выявленного во время беременности уже при развитии клинической симптоматики, с развитием угрожающих жизни женщины и ребенка состояний, что требует досрочного родоразрешения и соответственно длительной реабилитации. Как правило, у таких пациенток при анализе истории болезни выясняется, что в 8–12 недель уровень гликемии натощак уже был 5,3–5,5 ммоль/л, но эти цифры не вызвали настороженность у врачей, так как считались в пределах нормы по критериям ВОЗ (1999 г.) [17]. Таким образом, не всегда используемые критерии скрининга ГСД позволяют выявить данную патологию своевременно.
Исследование взаимосвязи гипергликемии и неблагоприятных исходов беременности (Hyperglycemia and Adverse Pregnancy Outcomes – HAPO), проведенное в 2000–2006 гг., показало, что критерии диагностики ГСД требуют пересмотра [5]. В 2008 г. Международной ассоциацией групп изучения диабета и беременности (International Association of Diabetes and Pregnancy Study Groups – IADPSG) были предложены для обсуждения новые критерии диагностики ГСД, основанные на результатах исследования HAPO, включавшего более 23 тыс. беременных [18].
 Эксперты Российской ассоциации эндокринологов и эксперты Российской ассоциации акушеров-гинекологов после всестороннего обсуждения одобрили критерии IADPSG и в 2012 г. приняли Российский национальный консенсус о критериях диагностики ГСД и других нарушений углеводного обмена во время беременности [1, 2]. Консенсус исключает понятие «стратификации» беременных по группам риска ГСД и рекомендует двухфазный алгоритм диагностики. Первая фаза включает в себя исследование глюкозы в венозной плазме натощак на первом визите к врачу. При однократном определении уровня глюкозы венозной плазмы натощак ≥5,1 ммоль/л, но <7,0 ммоль/л, устанавливается диагноз ГСД. Вторая фаза исследования предполагает проведение ПГТТ с 75 г глюкозы между 24-й и 28-й неделями (по показаниям до 32-й недели) всем женщинам, у которых не было выявлено нарушения углеводного обмена на ранних сроках беременности. Для диагностики ГСД между 24-й и 32-й неделями достаточно, чтобы хотя бы одно значение из трех было бы равно или выше порогового: натощак ≥5,1 ммоль/л, через 1 час ≥10,0 ммоль/л, через 2 часа ≥8,5 ммоль/л [1, 2]. Рабочая группа экспертов при обсуждении консенсуса пришла к необходимости отказаться от проведения ПГТТ у беременных высокой группы риска до 24 недель беременности. Основанием для этого послужили следующие соображения: 1) принятие критериев, рекомендованных IADPSG, исключает понятие «стратификации» беременных по группам риска; 2) доказательная база для «отрезных» точек ПГТТ с 75 г глюкозы в исследовании HAPO была получена только для сроков беременности 24–32 недели [1, 2].
Эксперты Российской ассоциации эндокринологов и эксперты Российской ассоциации акушеров-гинекологов после всестороннего обсуждения одобрили критерии IADPSG и в 2012 г. приняли Российский национальный консенсус о критериях диагностики ГСД и других нарушений углеводного обмена во время беременности [1, 2]. Консенсус исключает понятие «стратификации» беременных по группам риска ГСД и рекомендует двухфазный алгоритм диагностики. Первая фаза включает в себя исследование глюкозы в венозной плазме натощак на первом визите к врачу. При однократном определении уровня глюкозы венозной плазмы натощак ≥5,1 ммоль/л, но <7,0 ммоль/л, устанавливается диагноз ГСД. Вторая фаза исследования предполагает проведение ПГТТ с 75 г глюкозы между 24-й и 28-й неделями (по показаниям до 32-й недели) всем женщинам, у которых не было выявлено нарушения углеводного обмена на ранних сроках беременности. Для диагностики ГСД между 24-й и 32-й неделями достаточно, чтобы хотя бы одно значение из трех было бы равно или выше порогового: натощак ≥5,1 ммоль/л, через 1 час ≥10,0 ммоль/л, через 2 часа ≥8,5 ммоль/л [1, 2]. Рабочая группа экспертов при обсуждении консенсуса пришла к необходимости отказаться от проведения ПГТТ у беременных высокой группы риска до 24 недель беременности. Основанием для этого послужили следующие соображения: 1) принятие критериев, рекомендованных IADPSG, исключает понятие «стратификации» беременных по группам риска; 2) доказательная база для «отрезных» точек ПГТТ с 75 г глюкозы в исследовании HAPO была получена только для сроков беременности 24–32 недели [1, 2].
При анализе результатов наших исследований по критериям, предложенным консенсусом, гликемия натощак ≥5,1 ммоль/л, но <7,0 ммоль/л была отмечена у 39,0% (252/646) всех беременных, из них в 94,8% (239/252) случаев в I триместре. Необходимо отметить, что 88,6% (39/44) пациенток, у которых ГСД был выявлен по критериям ВОЗ (1999), имели гликемию венозной плазмы натощак ≥5,1ммоль/л. Таким образом, новые критерии диагностики ГСД позволяют выявить эту патологию, начиная с I триместра беременности, у большинства пациенток без проведения ПГТТ и деления на группы риска. Применение рекомендаций консенсуса в клинической практике предупреждает вышеуказанные ошибки при выявлении уровня гликемии натощак 5,3–5,5 ммоль/л. Раннее выявление ГСД будет способствовать своевременному назначению лечебных мероприятий. По нашим данным, только в 1% случаев ГСД, диагностированного по новым критериям, потребуется инсулинотерапия. Остальным 99% беременным с ГСД для нормализации углеводного обмена будет достаточно соблюдения рекомендаций по питанию, самоконтролю и физической активности.
Выводы
Высокая частота выявления ГСД в первом триместре ставит задачу раннего скрининга данной патологии.
Отсутствие факторов риска ГСД не исключает возможности наличия заболевания, поэтому необходим скрининг нарушений углеводного обмена у всех беременных.
Раннее выявление ГСД и, следовательно, своевременная коррекция нарушений углеводного обмена способствуют оптимизации перинатальных исходов.
Критерии диагностики ГСД, рекомендованные Российским национальным консенсусом (2012), позволяют проводить ранний скрининг всех беременных без деления на группы риска и диагностировать заболевание, начиная с I триместра, без ПГТТ у большинства пациенток.