1) Academician V.I. Kulakov National Medical Research Center of Obstetrics, Gynecology, and Perinatology, Ministry of Health of Russia, Moscow, Russia;
2) Peoples’ Friendship University of Russia, Ministry of Science and Higher Education of the Russian Federation (RUDN University), Moscow, Russia;
3) A.P. Avtsyn Research Institute of Human Morphology, Moscow, Russia
Preeclampsia (PE) is a multisystem pregnancy complication that is the leading cause of maternal and perinatal morbidity and mortality. Today, a large body of data has been accumulated, suggesting that an abnormal maternal immune response in PE is manifested, among other things, as a change in the functional activity of the monocyte-macrophage system, the most important unit of innate immunity. The cause of abnormal placentation underlying PE, especially early PE, may be dysfunction of placental immune cells, namely macrophages. The macrophages are one of the main cellular constituents of the decidua, the maternal component of the placenta, and also play an important role in the development of the fetal part of the placenta, per se being one of the first immune cells of a baby. Depending on their functional state, the macrophages can either stimulate or suppress inflammation, angiogenesis, and the proliferation of neighboring cells. According to the concept of binary polarization, there are two states of macrophages: classically activated macrophages (M1) produce proinflammatory cytokines and reactive oxygen/nitrogen species. The other type of macrophages (M2) produces anti-inflammatory cytokines and is involved in the elimination of inflammation.
Conclusion: Turning to the key differential markers of macrophages, this review attempts to summarize the current data on the functioning of the monocyte-macrophage system in physiological pregnancy and PE.
preeclampsia
macrophages
inflammation
phenotype
polarization
Преэклампсия (ПЭ) – это мультисистемное гестационное осложнение, которое является ведущей причиной материнской и перинатальной заболеваемости и смертности [1]. Ежегодно публикуются сотни исследований, посвященных изучению ПЭ в клинике, а также на клеточных и животных моделях [2, 3]. Однако научное сообщество все еще задается вопросом: каковы основные причины ПЭ и можно ли предсказать и предотвратить развитие этого порой жизнеугрожающего расстройства беременности?
Согласно современной концепции, ПЭ – это многофакторный синдром, а не изолированное заболевание. ПЭ возникает во второй половине беременности (после 20-й недели) и характеризуется артериальной гипертензией в сочетании с протеинурией (≥0,3 г/л в суточной моче) и/или проявлениями полиорганной или мультисистемной дисфункции [4]. Частота ПЭ зависит от географического места проживания и среднем составляет 8% [5]. ПЭ ассоциируется с недостаточной плацентацией, что, как считается, связано с нарушением ремоделирования спиральных артерий миометрия. ПЭ характеризуется системной иммунной активацией, связанной с повышенным уровнем воспалительных цитокинов, продуцируемых различными типами клеток крови и тканей [6].
Сегодня накоплено большое количество данных, свидетельствующих о том, что дисфункция иммунного ответа в организме матери при ПЭ выражается, в том числе, в изменении функциональной активности моноцитарно-макрофагальной системы, наиболее важной единицы врожденного иммунитета [7]. Причиной дефектной плацентации, лежащей в основе ПЭ, может быть нарушение функционирования плацентарных иммунных клеток, например, макрофагов. Макрофаги являются одним из основных клеточных компонентов децидуальной оболочки, материнской составляющей плаценты. В зависимости от своего функционального состояния макрофаги могут, как стимулировать, так и подавлять воспаление, ангиогенез, пролиферацию соседних клеток. Согласно концепции бинарной поляризации, существуют два состояния макрофагов: классически активированные макрофаги (М1) продуцируют провоспалительные цитокины и активные формы кислорода/азота. Другой тип макрофагов (М2) продуцируют противовоспалительные цитокины и участвуют в устранении воспаления (таблица) [8]. Показано также, что внутри последней популяции в зависимости от сигналов микроокружения могут формироваться четыре подтипа, различающиеся по выполняемым функциям и фенотипу [9]. Активированные IL-4 и IL-13 М2а – макрофаги, также известные как рано-заживляющие макрофаги, обладают повышенной эндоцитозной активностью и обеспечивают восстановление тканей, секретируют профибротические факторы, такие как TGF-β, инсулиноподобный фактор роста (IGF) и фибронектин [10, 11]. Для фенотипа характерна высокая экспрессия на поверхности клеток маннозного рецептора – CD206 [9]. M2b – макрофаги известные как регуляторные макрофаги – поляризуются в ответ на стимуляцию толл-подобных рецепторов (TLR) и могут секретировать как провоспалительные цитокины (IL-1β, IL-6 и фактор некроза опухоли (TNF)-α), так и противовоспалительный IL-10 [12]. Ведущая роль фагоцитоза апоптотических клеток принадлежит субпопуляции M2с. В ответ на воздействие глюкокортикоидов они начинают секретировать IL-10, TGF-β, хемокины CCL16 и CCL18. Для M2d макрофагов показано участие в прогрессировании опухолей и ангиогенезе, благодаря способности выделять IL-10 и фактор роста эндотелия сосудов (VEGF) [9].

На сегодняшний день накоплен массив данных о выраженном провоспалительном фенотипе макрофагов плодной части плаценты и его вкладе в патогенез заболевания, однако данных о состоянии макрофагов децидуальной оболочки мало. При ПЭ децидуальная мембрана материнская часть плаценты, которая обычно поддерживает иммунологическую толерантность материнского организма к полуаллогенному плоду, становится местом воспаления.
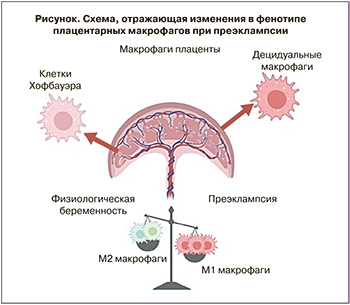
В контексте любого осложнения беременности плацентарные макрофаги следует рассматривать как две популяции: клетки Кащенко–Хофбауэра плодной части плаценты и децидуальные макрофаги материнской плацентарной части [13, 14]. Обратившись к ключевым дифференциальным маркерам макрофагов, в данном обзоре мы попытались суммировать современные данные о функционировании моноцит-макрофагальной системы при физиологической беременности и при ПЭ.
Макрофаги при беременности
Макрофагам принадлежит ключевая роль в поддержании тканевого гомеостаза, в регуляции процессов воспаления и репарации. В соответствии с современными представлениями тканевые макрофаги в онтогенезе млекопитающих развиваются из трех генераций гемопоэтических стволовых клеток [15, 16]. Первая генерация возникает в стенке желточного мешка; предполагают, что из этих первых прогениторных гемопоэтических клеток развивается микроглия центральной нервной системы (ЦНС) [17]. Второй источник гемопоэтических клеток – эритро-миелоидные прогениторные клетки, формируются из гемогенного эндотелия капилляров желточного мешка и заселяют печень зародыша. Из мезенхимальных стволовых клеток желточного мешка могут дифференцироваться резидентные макрофаги плаценты – клетки Кащенко–Хофбауэра [18–21]. Третья генерация развивается из гемогенного эндотелия аорто-гонадо-мезонефральной зоны, и далее мигрируют в печень и красный костный мозг. Макрофаги данной генерации также заселяют практически все органы зародыша, за исключением ЦНС [22] и становятся вторым источником клеток Кащенко–Хофбауэра [18, 19]. По немногочисленным результатам исследования онтогенеза децидуальных макрофагов показано, что они состоят как из эмбриональных макрофагов, так и являются потомками гематопоэтических предшественников из костного мозга [23].
Макрофаги способны очень быстро изменять свой фенотип и функцию под действием микроокружения и сигнальных молекул. Активация макрофагов (поляризация) in situ может быть направлена в сторону провоспалительных М1 макрофагов или противовоспалительных М2 макрофагов [24, 25], которые отличаются не только по экспрессии специфических маркеров, но и по своей роли в системном иммунном ответе и функциональной активности [26].
Макрофаги обнаружены во всех органах женской половой системы; при этом макрофаги способны реагировать на изменяющийся уровень эстрогенов и эстроген-связанных медиаторов и таким образом участвовать в поддержании гомеостаза органов женской половой системы в течение овариально-маточного цикла. Популяция макрофагов органов женской половой системы представлены как резидентными самоподдерживающимися макрофагами, представленными клетками Кащенко–Хофбауэра, заселившими органы в ходе пренатального развития, так и макрофагами, принадлежащими моноцитарному дифферону [27]. Самообновление тканевых резидентных макрофагов – вопрос, активно изучаемый многими группами исследователей. Существующие данные говорят о том, что данный процесс регулируется специфическим для линии фактором роста, макрофагально-колониестимулирующим фактором (CSF1), а также иммунными и эндокринными сигналами, такими как IL-4, IL-33, стероидные гормоны, среди которых важная роль принадлежит эстрогенам [28–32]. Также показано, что макрофаги могут вступать в клеточный цикл при активации MAPK/Akt пути окисленными липопротеинами низкой плотности (Ox-LDL) [33–35].
Эстрогены воздействуют на клетки посредством двух внутриклеточных эстрогеновых рецепторов ESR1 (ERα) и ESR2 (ERβ), а также через связанный с белком G рецептор эстрогена 1 (GPER1). Эстрогены оказывают множество эффектов на макрофаги. Предполагается, что эстрадиол может стимулировать пролиферацию макрофагов как напрямую, так и посредством других клеток, которые под влиянием эстрадиола вырабатывают митогены для макрофагов – эпидермальный фактор роста (EGF) и IGF-1 [27]. Даже в отсутствии медиаторов воспаления эстрогены вызывают экспрессию генов раннего и позднего ответа в макрофагах. В условиях воспаления эстрогены способствуют поляризации макрофагов в направлении М2-фенотипа, вызывают увеличение синтеза молекул, участвующих в ремоделировании межклеточного матрикса (протеазы, их ингибиторы) [36]. Эстрогены также способны регулировать фагоцитарную активность макрофагов в зависимости от преобладающих факторов активации: как усиливать, так и подавлять ее.
Макрофаги в эндометрии распределены неравномерно, их численность и плотность варьирует в зависимости от стадии менструального цикла. Во время стадии пролиферации макрофаги локализуются в строме поверхностного слоя эндометрия, окружая и проникая в просвет маточных желез. В фазе секреции количество макрофагов в эндометрии резко возрастает [37]. Показано, что количество CD14+ макрофагов увеличивается примерно на 45% [38]. В фазе пролиферации и начале секреции число макрофагов увеличивается за счет пролиферации резидентных макрофагов, в конце секреторной фазы отмечается миграция моноцитарных макрофагов в эндометрий. Предполагается, что в фазе десквамации (менструации) часть макрофагов мигрирует из эндометрия в лимфатические узлы или гибнет в результате апоптоза [39]. Несмотря на то, что у макрофагов обнаружены рецепторы к эстрогенам, считается что эстрогены непосредственно не вызывают хемотаксис макрофагов в эндометрий, это опосредовано цитокинами, которые выделяются другими клетками под воздействием меняющегося уровня эстрогенов [27].
Среди макрофагов эндометрия выделяют несколько популяций. Одна из них расположена ближе к поверхности эндометрия и, как предполагается, принимает участие в процессах десквамации и регенерации, другая популяция локализована, в основном, вокруг маточных желез [40]. В фазе пролиферации макрофаги эндометрия экспрессируют поверхностные белки (рецептор трансферрина (TFRC), CD69 и молекула клеточной адгезии 1 (ICAM-1)), факторы ремоделирования матрикса, цитокины и факторы роста, что подготавливает эндометрий к возможной имплантации или индуцирует его десквамацию [40].
Макрофаги и спиральные артерии
На начальных этапах беременности во время инвазии трофобласта и ремоделирования спиральных артерий децидуальные макрофаги локализуются вблизи них. Участие макрофагов в ремоделировании спиральных артерий подтверждается тем, что они выделяют множество факторов, участвующих в ангиогенезе и ремоделировании тканей [41, 42]. Среди факторов ангиогенеза, секретируемыми децидуальными макрофагами, обнаружены ангиогенин, фактор роста кератиноцитов, фактор роста фибробластов B, VEGF-A и ангиопоэтин -1, -2; к факторам ремоделирования, синтезируемыми децидуальными макрофагами, относят матриксные металлопротеиназы (MMP) -1, -2, -7, -9 и -10 [41]. Обнаружено, что децидуальные макрофаги, окружающие спиральные артерии, синтезируют на высоком уровне ММР-9 [43]. При этом у них обнаруживается высокая фагоцитарная активность, что, необходимо для поглощения клеток, гибнущих посредством апоптоза в ходе ремоделирования спиральных артерий и децидуальной оболочки. Считается, что удаление апоптотических клеток децидуальной оболочки предотвращает эндотелий от активации и адгезии к нему моноцитов [44].
Для ПЭ характерно накопление макрофагов вокруг спиральных артерий. Данный феномен связывают с развитием острого атероза, характеризующегося субэндотелиальным накоплением CD68 позитивных пенистых клеток [45, 46].
Эстрогены и преэклампсия
У женщин синтезируется несколько гормонов, относящихся к группе эстрогенов: эстрон, эстрадиол, эстриол и эстрон [47, 48]. Во время нормальной беременности в крови происходит постепенное повышение уровня эстрогенов в основном за счет увеличения концентрации эстрадиола [49]. В самом начале беременности эстрогены синтезируются желтым телом. Примерно с 9 недели гестации главным источником эстрадиола становится плацента, где продуцируется симпластотрофобластом [48], а также по некоторым данным, в меньшей степени клетками Кащенко–Хофбауэра [49, 50]. Синтез эстрогенов в плаценте зависит от функции надпочечников матери и плода, так как в самой плаценте отсутствует часть ключевых ферментов стероидогенеза [49].
Многими авторами предполагается, что эстрогены играют ключевую роль при развитии ПЭ, так как регулируют ангиогенез, вызывают вазодилятацию [47]. В большинстве исследований обнаружено снижение уровня эстрогенов в крови матери при ПЭ, однако таких исследований не так много [51–56]. При ПЭ разной степени тяжести отмечается снижение уровня эстрадиола как в крови беременных [52, 54, 57], так и в самой плаценте [58]. Концентрация эстрона и эстриола в плазме при тяжелой ПЭ по данным некоторых авторов также снижена [54], в других исследованиях такие изменения не были обнаружены [52, 59]. При этом имеются данные о сниженном уровне эстриола в плаценте [53].
Как уже было сказано выше, эстрогены стимулируют поляризацию макрофагов в направлении М2-фенотипа [36, 47, 60]. Поэтому резонно предположить, что наблюдаемое в условиях ПЭ снижение уровня эстрогенов может приводить к увеличению популяции М1-макрофагов, но, безусловно, этот вопрос требует дальнейшего изучения.
Макрофаги плодной части плаценты при преэклампсии
Состав резидентных макрофагов как плодной, так и материнской частей плаценты при ПЭ не был предметом детального изучения. Возможно, это связано со сложностью сбора биоматериала и длительной процедурой выделения и фенотипирования клеток в отличие от легко получаемых образцов крови. Однако этот предмет требует всестороннего изучения.
Показано, что основной популяцией макрофагов, представленной в плодной части плаценты являются клетки Кащенко–Хофбауэра, которые обнаруживаются в строме ворсинок уже через 4 недели после зачатия и остаются на протяжении беременности [61, 62].
Так же, как и обычные макрофаги, клетки Кащенко–Хофбауэра довольно пластичны в зависимости от условий микроокружения [61]. Гетерогенные по антигенному составу и морфологии макрофаги плодной части плаценты при физиологической беременности наиболее близки к альтернативно поляризованным макрофагам – M2 макрофагам [13], что подтверждает анализ метилирования ДНК, проведенный Kim et al. [63]. В данном исследовании было показано, что характерные для М2 профиля гены – CCL2, CCL13, CCL14, CD209 и A2M гипометилированы, тогда как гены, характерные для M1 макрофагов, такие как TLR9, IL1B, IL12RB2, CD48 и FGR, – гиперметилированы.
Yang et al. показали, что уровень CD163+ клеток Кащенко–Хофбауэра (соответствующих М2 макрофагам) значимо снижается при ПЭ по сравнению с неосложненной беременностью [64]. В работе Tang et al. также наблюдалось уменьшение количества CD163+ клеток плодной части плаценты по сравнению с контролем [65]. Ма et al. наблюдали увеличение процента клеток, окрашенных CD11b-iNOS (М1 фенотип), и сопутствующее снижение процента клеток, меченных CD11b-Arg1 (М2 фенотип), в плодной части плаценты при ПЭ по сравнению с контрольными образцами [66].
При этом показано также, что при развитии тяжелой ПЭ начинают включаться компенсаторные механизмы. Было высказано предположение, что снижение экспрессии противовоспалительного белка Gal-1 при ранней ПЭ может быть связано с плацентарной дисфункцией, тогда как его избыточная экспрессия может быть компенсаторным механизмом для снижения воспаления при поздней ПЭ [67, 68]. Известно, что галектин-1 [67] снижает метаболизм NO и экспрессию iNOS (известных М1 маркеров), что приводит к формированию М2 фенотипа.
Przybyl et al. [69] показали, что экспрессия CD74 (HLA-DR антиген-ассоциированная инвариантная цепь), участвующего в презентации антигенов, подавляется на клетках Кащенко–Хофбауэра при развитии ПЭ. Авторы предположили, что это может приводить к изменению поляризации макрофагов от M2 к М1 фенотипу при данном заболевании. Стоит отметить, что при тяжелой ПЭ, осложненной HELLP синдромом, характерно общее повышение количества клеток Кащенко–Хофбауэра [70]. Evsen et al. при сравнении плацент группы с физиологической беременностью и беременности с ПЭ и HELLP синдромом было показано повышение количества клеток, позитивных по пан-макрофагальному маркеру CD68 [70].
Сдвиг баланса M2/M1 среди клеток Кащенко–Хофбауэра в сторону M1 в литературе объясняется высоким уровнем провоспалительных цитокинов и низким уровнем противовоспалительных цитокинов в плодной части плаценты при ПЭ [71].
Макрофаги материнской части при преэклампсии
Нужно отметить, что вопрос М1/М2 фенотипа макрофагов децидуальной оболочки практически не изучен, что указывает на актуальность данной тематики. Встречаются лишь единичные работы, посвященные этому вопросу или исследованию количества макрофагов децидуальной оболочки в целом.
Williams et al., а также Bürk et al. обнаружили снижение общего количества макрофагов в децидуальной оболочке при ПЭ по сравнению с контрольными группами [72, 73]. Такой вывод они сделали в связи со значимым снижением количества CD14+ клеток, соответствующих макрофагам моноцитарного происхождения. Эти данные противоречат результатам Milosevic-Stevanovic et al., которые наблюдали более высокое количество CD68+ децидуальных клеток в группе с ПЭ по сравнению с контролем [74]. СD68 является распространенным пан-макрофагальным маркером. В другом исследовании значительный рост числа CD68+ клеток как в плодной, так и в децидуальной частях плаценты наблюдался также в группе ПЭ по сравнению с контролем [75]. Очевидные несоответствия между исследованиями могут объясняться различиями в пробоподготовке (клеточные маркеры, марки антитела, способы обнаружение сигналов от антител и протоколы выделения клеток и др.) и в формировании исследуемых групп.
Что касается фенотипа макрофагов децидульной оболочки, то в одной из работ Schonkeren et al. обнаружили, что количество децидуальных клеток, дважды-положительных по маркерам СD163 и CD14, снижалось в плацентарных пробах, взятых от женщин с ПЭ [76], что свидетельствует о снижении количества М2 макрофагов. Нашей лабораторией также были получены собственные данные относительно фенотипа макрофагов [77]. Децидуальные клетки окрашивали на общие маркеры макрофагов (CD68, CD11b) и маркеры про- (CD86, CX3CR1) и противовоспалительного (CD206) фенотипа макрофагов. Согласно полученным результатам, содержание CD68+ клеток, а также клеток, положительных по маркерам CD11b и CD206, во всех группах было сходным, в то время как уровень CD86+ клеток был значимо выше в группе ранней ПЭ (p=0,02) по сравнению с контрольной группой. Доля клеток CX3CR1+ также была значимо выше в образцах группы ранней ПЭ по сравнению с контролем, что было подтверждено данными иммуногистохимического анализа. Эти результаты указывают на важную роль адекватного иммунного ответа децидуальной оболочки при ПЭ: мы получили выраженные признаки провоспалительного фенотипа макрофагов в децидуальной оболочке при ПЭ.
Заключение
ПЭ является одним из «больших акушерских синдромов», представляющих угрозу для жизни матери и ребенка. В течение нескольких десятилетий исследователи пытаются понять причины ПЭ, рассматривая патогенез заболевания с разных точек зрения. Важным аспектом развития ПЭ является реакция материнского врожденного иммунитета к различным провоспалительным молекулам, продуцируемым со стороны плаценты. При физиологической беременности материнский организм адаптируется к полуаллогенному плоду, однако при ПЭ наблюдается выраженный воспалительный процесс. Последствия этого процесса проявляются в том числе в измененном составе и поляризации плацентарных макрофагов (рисунок). Примеры, перечисленные в этом обзоре, показывают, что плацентарные макрофаги являются чрезвычайно важным типом клеток, участвующим в патогенезе ПЭ. Большие перспективы имеет возможное применение анализа фенотипа их предшественников – моноцитов крови – в качестве предикторов ПЭ и/или использование макрофагов как терапевтических агентов, на фенотип которых можно повлиять медикаментозно.
- Conde-Agudelo A., Villar J., Lindheimer M. World Health Organization S-systematic review of screening tests for preeclampsia. Obstet. Gynecol. 2004; 104(6): 1367-91. https://dx.doi.org/10.1097/01.AOG.0000147599.47713.5d.
- Вишнякова П.А., Кан. Н.Е., Ходжаева З.С., Высоких М.Ю. Митохондрии плаценты в норме и при преэклампсии. Акушерство и гинекология. 2017; 5: 5-8. [Vishnyakova P.A., Kan N.E., Khodzhaeva Z.S., Vysokikh M.Yu. Mitochondria placenta in the norm and during preeclampsia. Obstetrics and Gynecology. 2017; 5: 5-8. (in Russian)]. https://dx.doi.org/10.18565/aig.2017.5.5-8.
- Зарипова Л.Р., Галина Т.В., Голикова Т.П., Гондаренко А.С. Прогнозирование и ранняя диагностика преэклампсии. Вестник РУДН. 2012; 6: 15-22. [Zaripova L.R., Galina T.V., Golikova T.P., Gondarenko A.S. Prediction and early diagnosis of pre-eclampsia. Bulletin of RUDN University. 2012; 6: 15-22. (in Russian)].
- World Health Organization. WHO recommendations for prevention and treatment of pre-eclampsia and eclampsia. Geneva: World Health Organization; 2011. Available at: http://www.ncbi.nlm.nih.gov/books/NBK140561/ Accessed May 23, 2016.
- Duley L. The global impact of pre-eclampsia and eclampsia. Semin. Perinatol. 2009; 33(3): 130-7. https://dx.doi.org/10.1053/j.semperi.2009.02.010.
- Steegers E.A.P., von Dadelszen P., Duvekot J.J., Pijnenborg R. Pre-eclampsia. Lancet. 2010; 376(9741): 631-44. https://dx.doi.org/10.1016/S0140-6736(10)60279-6.
- Vishnyakova P., Elchaninov A., Fatkhudinov T., Sukhikh G. Role of the monocyte–macrophage system in normal pregnancy and preeclampsia. Int. J. Mol. Sci. 2019; 20(15): 3695. https://dx.doi.org/10.3390/ijms20153695.
- Mills C.D. Anatomy of a discovery: M1 and M2 macrophages. Front. Immunol. 2015; 6: 212. https://dx.doi.org/10.3389/fimmu.2015.00212
- Yao Y., Xu X.H., Jin L. Macrophage polarization in physiological and pathological pregnancy. Front. Immunol. 2019; 10: 792. https://dx.doi.org/10.3389/FIMMU.2019.00792/BIBTEX.
- Novak M.L., Koh T.J. Macrophage phenotypes during tissue repair. J. Leukoc. Biol. 2013; 93(6): 875-81. https://dx.doi.org/10.1189/JLB.1012512.
- White M.J.V., Gomer R.H. Trypsin, tryptase, and thrombin polarize macrophages towards a pro-fibrotic M2a phenotype. PLoS One. 2015; 10(9): e0138748. https://dx.doi.org/10.1371/JOURNAL.PONE.0138/
- Wang L.X., Zhang S.X., Wu H.J., Rong X.L., Guo J. M2b macrophage polarization and its roles in diseases. J. Leukoc. Biol. 2019; 106(2): 345-8. https://dx.doi.org/10.1002/JLB.3RU1018-37
- Zulu M.Z., Martinez F.O., Gordon S., Gray C.M. The elusive role of placental macrophages: the Hofbauer cell. J. Innate Immun. 2019; 11(6): 447-56. https://dx.doi.org/10.1159/000497416.
- Heikkinen J., Möttönen M., Komi J., Alanen A., Lassila O. Phenotypic characterization of human decidual macrophages. Clin. Exp. Immunol. 2003; 131(3): 498-505. https://dx.doi.org/10.1046/J.1365-2249.2003.02092.X.
- Chazaud B. Macrophages: Supportive cells for tissue repair and regeneration. Immunobiology. 2014; 219(3): 172-8. https://dx.doi.org/10.1016/j.imbio.2013.09.001.
- Perdiguero E.G., Geissmann F. The development and maintenance of resident macrophages. Nat. Immunol. 2016; 17(1): 2-8. https://dx.doi.org/10.1038/ni.3341.
- Hoeffel G., Ginhoux F. Fetal monocytes and the origins of tissue-resident macrophages. Cell. Immunol. 2018; 330: 5-15. https://dx.doi.org/10.1016/j.cellimm.2018.01.001.
- Kim J.S., Romero R., Kim M.R., Kim Y.M., Friel L., Espinoza J., Kim C.J. Involvement of hofbauer cells and maternal T cells in villitis of unknown aetiology. Histopathology. 2008; 52(4): 457-64. https://dx.doi.org/10.1111/J.1365-2559.2008.02964.X.
- Kim M.J., Romero R., Kim C.J., Tarca A.L., Chhauy S., LaJeunesse C. et al. Villitis of unknown etiology is associated with a distinct pattern of chemokine up-regulation in the feto-maternal and placental compartments: implications for conjoint maternal allograft rejection and maternal anti-fetal graft-versus-host disease. J. Immunol. 2009; 182(6): 3919-27. https://dx.doi.org/10.4049/jimmunol.0803834.
- Takahashi K., Naito M., Katabuchi H., Higashi K. Development, differentiation, and maturation of macrophages in the chorionic villi of mouse placenta with special reference to the origin of Hofbauer cells. J. Leukoc. Biol. 1991; 50(1): 57-68. https://dx.doi.org/10.1002/JLB.50.1.57.
- Seval Y., Korgun E.T., Demir R. Hofbauer cells in early human placenta: possible implications in vasculogenesis and angiogenesis. Placenta. 2007; 28(8-9): 841-5. https://dx.doi.org/10.1016/J.PLACENTA.2007.01.010.
- Hoeffel G., Chen J., Lavin Y., Low D., Almeida F.F., See P. et al. C-Myb(+) erythro-myeloid progenitor-derived fetal monocytes give rise to adult tissue-resident macrophages. Immunity. 2015; 42(4): 665-78. https://dx.doi.org/10.1016/j.immuni.2015.03.011.
- Sun F., Wang S., Du M. Functional regulation of decidual macrophages during pregnancy. J. Reprod. Immunol. 2021; 143: 103264. https://dx.doi.org/10.1016/J.JRI.2020.103264.
- Murray P.J. Macrophage polarization. Annu. Rev. Physiol. 2017; 79: 541-66. https://dx.doi.org/10.1146/annurev-physiol-022516-034339.
- Murray P.J., Wynn T.A. Obstacles and opportunities for understanding macrophage polarization. J. Leukoc. Biol. 2011; 89(4): 557-63. https://dx.doi.org/10.1189/jlb.0710409.
- Martinez F.O., Gordon S. The M1 and M2 paradigm of macrophage activation: time for reassessment. F1000Prime Reports. 2014; 6: 13. https://dx.doi.org/10.12703/P6-13.
- Pepe G., Locati M., Della Torre S., Mornata F., Cignarella A., Maggi A., Vegeto E. The estrogen–macrophage interplay in the homeostasis of the female reproductive tract. Hum. Reprod. Update. 2018; 24(6): 652-72. https://dx.doi.org/10.1093/humupd/dmy026.
- Tagliani E., Shi C., Nancy P., Tay C.S., Pamer E.G., Erlebacher A. Coordinate regulation of tissue macrophage and dendritic cell population dynamics by CSF-1. J. Exp. Med. 2011; 208(9): 1901-16. https://dx.doi.org/10.1084/JEM.20110866.
- Hashimoto D., Chow A., Noizat C., Teo P., Beasley M.B., Leboeuf M. et al. Tissue-resident macrophages self-maintain locally throughout adult life with minimal contribution from circulating monocytes. Immunity. 2013; 38(4): 792-804. https://dx.doi.org/10.1016/j.immuni.2013.04.004.
- Jenkins S.J., Ruckerl D., Thomas G.D., Hewitson J.P., Duncan S., Brombacher F. et al. IL-4 directly signals tissue-resident macrophages to proliferate beyond homeostatic levels controlled by CSF-1. J. Exp. Med. 2013; 210(11): 2477-91. https://dx.doi.org/10.1084/JEM.20121999.
- Jackson-Jones L.H., Rückerl D., Svedberg F., Duncan S., Maizels R.M., Sutherland T.E. et al. IL-33 delivery induces serous cavity macrophage proliferation independent of interleukin-4 receptor alpha. Eur. J. Immunol. 2016; 46(10): 2311-21. https://dx.doi.org/10.1002/EJI.201646442.
- Pepe G., Braga D., Renzi T.A., Villa A., Bolego C., D'Avila F. et al. Self-renewal and phenotypic conversion are the main physiological responses of macrophages to the endogenous estrogen surge. Sci. Rep. 2017; 7: 44270. https://dx.doi.org/ 10.1038/srep44270.
- Senokuchi T., Matsumura T., Sakai M., Matsuo T., Yano M., Kiritoshi S. et al. Extracellular signal-regulated kinase and p38 mitogen-activated protein kinase mediate macrophage proliferation induced by oxidized low-density lipoprotein. Atherosclerosis. 2004; 176(2): 233-45. https://dx.doi.org/10.1016/j.atherosclerosis.2004.05.019.
- Ishii N., Matsumura T., Kinoshita H., Motoshima H., Kojima K., Tsutsumi A. et al. Activation of AMP-activated protein kinase suppresses oxidized low-density lipoprotein-induced macrophage proliferation. J. Biol. Chem. 2009; 284(50): 34561-9. https://dx.doi.org/10.1074/jbc.M109.028043.
- Biwa T., Hakamata H., Sakai M., Miyazaki A., Suzuki H., Kodama T. et al. Induction of murine macrophage growth by oxidized low density lipoprotein is mediated by granulocyte macrophage colony-stimulating factor. J. Biol. Chem. 1998; 273(43): 28305-13. https://dx.doi.org/10.1074/jbc.273.43.28305.
- Villa A., Rizzi N., Vegeto E., Ciana P., Maggi A. Estrogen accelerates the resolution of inflammation in macrophagic cells. Sci. Rep. 2015; 5(1): 15224. https://dx.doi.org/10.1038/srep15224.
- Cousins F.L., Kirkwood P.M., Saunders P.T.K., Gibson D.A. Evidence for a dynamic role for mononuclear phagocytes during endometrial repair and remodelling. Sci. Rep. 2016; 6(1): 36748. https://dx.doi.org/10.1038/srep36748.
- Hunt J.S., Robertson S.A. Uterine macrophages and environmental programming for pregnancy success. J. Reprod. Immunol. 1996; 32(1): 1-25. https://dx.doi.org/10.1016/s0165-0378(96)88352-5.
- Wira C.R., Fahey J.V., Rodriguez-Garcia M., Shen Z., Patel M.V. Regulation of mucosal immunity in the female reproductive tract: the role of sex hormones in immune protection against sexually transmitted pathogens. Am. J. Reprod. Immunol. 2014; 72(2): 236-58. https://dx.doi.org/10.1111/aji.12252.
- Thiruchelvam U., Dransfield I., Saunders P.T.K., Critchley H.O.D. The importance of the macrophage within the human endometrium. J. Leukoc. Biol. 2013; 93(2): 217-25. https://dx.doi.org/10.1189/jlb.0712327.
- Lash G.E., Pitman H., Morgan H.L., Innes B.A., Agwu C.N., Bulmer J.N. Decidual macrophages: key regulators of vascular remodeling in human pregnancy. J. Leukoc. Biol. 2016; 100(2): 315-25. https://dx.doi.org/10.1189/jlb.1A0815-351R.
- Smith S.D., Dunk C.E., Aplin J.D., Harris L.K., Jones R.L. Evidence for immune cell involvement in decidual spiral arteriole remodeling in early human pregnancy. Am. J. Pathol. 2009; 174(5): 1959-71. https://dx.doi.org/10.2353/ajpath.2009.080995.
- Hazan A.D., Smith S.D., Jones R.L., Whittle W., Lye S.J., Dunk C.E. Vascular-leukocyte interactions. Am. J. Pathol. 2010; 177(2): 1017-30. https://dx.doi.org/10.2353/ajpath.2010.091105.
- Chen Q., Guo F., Jin H.Y., Lau S., Stone P., Chamley L. Phagocytosis of apoptotic trophoblastic debris protects endothelial cells against activation. Placenta. 2012; 33(7): 548-53. https://dx.doi.org/10.1016/j.placenta.2012.03.007.
- Katabuchi H., Yih S., Ohba T., Matsui K., Takahashi K., Takeya M., Okamura H. Characterization of macrophages in the decidual atherotic spiral artery with special reference to the cytology of foam cells. Med. Electron Microsc. 2003; 36(4): 253-62. https://dx.doi.org/10.1007/S00795-003-0223-2.
- Reister F., Frank H.G., Heyl W., Kosanke G., Huppertz B., Schröder W. et al. The distribution of macrophages in spiral arteries of the placental bed in pre-eclampsia differs from that in healthy patients. Placenta. 1999; 20(2-3): 229-33. https://dx.doi.org/10.1053/PLAC.1998.0373.
- Berkane N., Liere P., Oudinet J.P., Hertig A., Lefèvre G., Pluchino N. et al. From pregnancy to preeclampsia: a key role for estrogens. Endocr. Rev. 2017; 38(2): 123-44. https://dx.doi.org/10.1210/er.2016-1065.
- Napso T., Yong H.E.J., Lopez-Tello J., Sferruzzi-Perri A.N. The role of placental hormones in mediating maternal adaptations to support pregnancy and lactation. Front. Physiol. 2018; 9: 1091. https://dx.doi.org/10.3389/fphys.2018.01091.
- Schmidt M., Kreutz M., Löffler G., Schölmerich J., Straub R.H. Conversion of dehydroepiandrosterone to downstream steroid hormones in macrophages. J. Endocrinol. 2000; 164(2): 161-9.
- Tang Z., Tadesse S., Norwitz E., Mor G., Abrahams V.M., Guller S. Isolation of hofbauer cells from human term placentas with high yield and purity. Am. J. Reprod. Immunol. 2011; 66(4): 336-48. https://dx.doi.org/10.1111/j.1600-0897.2011.01006.x.
- Salas S.P., Marshall G., Gutiérrez B.L., Rosso P. Time course of maternal plasma volume and hormonal changes in women with preeclampsia or fetal growth restriction. Hypertension. 2006; 47(2): 203-8. https://dx.doi.org/10.1161/01.HYP.0000200042.64517.19.
- Hertig A., Liere P., Chabbert-Buffet N., Fort J., Pianos A., Eychenne B. et al. Steroid profiling in preeclamptic women: Evidence for aromatase deficiency. Am. J. Obstet. Gynecol. 2010; 203(5): 477.e1-477.e9. https://dx.doi.org/10.1016/j.ajog.2010.06.011.
- Bussen S., Bussen D. Influence of the vascular endothelial growth factor on the development of severe pre-eclampsia or HELLP syndrome. Arch. Gynecol. Obstet. 2011; 284(3): 551-7. https://dx.doi.org/10.1007/s00404-010-1704-x.
- Jobe S.O., Tyler C.T., Magness R.R. Aberrant synthesis, metabolism, and plasma accumulation of circulating estrogens and estrogen metabolites in preeclampsia implications for vascular dysfunction. Hypertension. 2013; 61(2): 480-7. https://dx.doi.org/10.1161/HYPERTENSIONAHA.111.201624.
- Yin G., Zhu X., Guo C., Yang Y., Han T., Chen L. et al. Differential expression of estradiol and estrogen receptor α in severe preeclamptic pregnancies compared with normal pregnancies. Mol. Med. Rep. 2013; 7(3): 981-5. https://dx.doi.org/10.3892/mmr.2013.1262.
- Vishnyakova P., Poltavets A., Nikitina M., Midiber K., Mikhaleva L., Muminova K. et al. Expression of estrogen receptor α by decidual macrophages in preeclampsia. Biomedicines. 2021; 9(2): 1-13. https://dx.doi.org/10.3390/biomedicines9020191.
- Zhang Y., Wang T., Shen Y., Wang X., Baker P.N., Zhao A. 2-Methoxyestradiol deficiency is strongly related to hypertension in early onset severe pre-eclampsia. Pregnancy Hypertens. 2014; 4(3): 215-9. https://dx.doi.org/10.1016/j.preghy.2014.04.004.
- Açıkgöz Ş., Bayar U.O., Can M., Güven B., Mungan G., Doğan S., Sümbüloğlu V. Levels of oxidized LDL, estrogens, and progesterone in placenta tissues and serum paraoxonase activity in preeclampsia. Mediators Inflamm. 2013; 2013: 862982. https://dx.doi.org/10.1155/2013/862982.
- Bussen S., Rieger L., Sütterlin M., Dietl J. Plasma VEGF levels are increased in women with severe preeclampsia or HELLP syndrome. Z. Geburtshilfe Neonatol. 2003; 207(3): 101-6. https://dx.doi.org/10.1055/s-2003-40977.
- Lang T.J. Estrogen as an immunomodulatory. Clin. Immunol. 2004; 113(3): 224-30. https://dx.doi.org/10.1016/J.CLIM.2004.05.011.
- Kloc M., ed. Macrophages origin, functions and biointervention. Cham: Springer Nature; 2017. https://dx.doi.org/10.1007/978-3-319-54090-0_3.
- Thomas J.R., Appios A., Zhao X., Dutkiewicz R., Donde M., Lee C.Y.C. et al. Phenotypic and functional characterization of first-trimester human placental macrophages, Hofbauer cells. J. Exp. Med. 2020; 218(1): e20200891. https://dx.doi.org/10.1084/jem.20200891.
- Kim S.Y., Romero R., Tarca A.L., Bhatti G., Kim C.J., Lee J. et al. Methylome of fetal and maternal monocytes and macrophages at the feto-maternal interface. Am. J. Reprod. Immunol. 2012; 68(1): 8-27. https://dx.doi.org/10.1111/j.1600-0897.2012.01108.x.
- Yang S.W., Cho E.H., Choi S.Y., Lee Y.K., Park J.H., Kim M.K. et al. DC-SIGN expression in Hofbauer cells may play an important role in immune tolerance in fetal chorionic villi during the development of preeclampsia. J. Reprod. Immunol. 2017; 124: 30-7. https://dx.doi.org/10.1016/j.jri.2017.09.012.
- Tang Z., Buhimschi I.A., Buhimschi C.S., Tadesse S., Norwitz E., Niven-Fairchild T. et al. Decreased levels of folate receptor-β and reduced numbers of fetal macrophages (Hofbauer cells) in placentas from pregnancies with severe pre-eclampsia. Am. J. Reprod. Immunol. 2013; 70(2): 104-15. https://dx.doi.org/10.1111/aji.12112.
- Ma Y., Ye Y., Zhang J., Ruan C.C., Gao P.J. Immune imbalance is associated with the development of preeclampsia. Medicine (Baltimore). 2019; 98(14): e15080. https://dx.doi.org/10.1097/MD.0000000000015080.
- Than N.G., Erez O., Wildman D.E., Tarca A.L., Edwin S.S., Abbas A. et al. Severe preeclampsia is characterized by increased placental expression of galectin-1. J. Matern. Fetal Neonatal Med. 2008; 21(7): 429-42. https://dx.doi.org/10.1080/14767050802041961.
- Perucci L.O., Corrêa M.D., Dusse L.M., Gomes K.B., Sousa L.P. Resolution of inflammation pathways in preeclampsia-a narrative review. Immunol. Res. 2017; 65(4): 774-89. https://dx.doi.org/10.1007/S12026-017-8921-3.
- Przybyl L., Haase N., Golic M., Rugor J., Solano M.E., Arck P.C. et al. CD74-downregulation of placental macrophage-trophoblastic interactions in preeclampsia. Circ. Res. 2016; 119(1): 55-68. https://dx.doi.org/10.1161/CIRCRESAHA.116.308304.
- Evsen M.S., Kalkanli S., Deveci E., Sak M.E., Ozler A., Baran O. et al. Human placental macrophages (Hofbauer cells) in severe preeclampsia complicated by HELLP syndrome: immunohistochemistry of chorionic villi. Anal. Quant. Cytopathol. Histopathol. 2013; 35(5): 283-8.
- Aggarwal R., Jain A.K., Mittal P., Kohli M., Jawanjal P., Rath G. Association of pro- and anti-inflammatory cytokines in preeclampsia. J. Clin. Lab. Anal. 2019; 33(4): e22834. https://dx.doi.org/10.1002/jcla.22834.
- Williams P.J., Bulmer J.N., Searle R.F., Innes B.A., Robson S.C. Altered decidual leucocyte populations in the placental bed in pre-eclampsia and foetal growth restriction: a comparison with late normal pregnancy. Reproduction. 2009; 138(1): 177-84. https://dx.doi.org/10.1530/rep-09-0007.
- Bürk M.R., Troeger C., Brinkhaus R., Holzgreve W., Hahn S. Severely reduced presence of tissue macrophages in the basal plate of pre-eclamptic placentae. Placenta. 2001; 22(4): 309-16. https://dx.doi.org/10.1053/plac.2001.0624.
- Milosevic-Stevanovic J., Krstic M., Radovic-Janosevic D., Popovic J., Tasic M., Stojnev S. Number of decidual natural killer cells & macrophages in pre-eclampsia. Indian J. Med. Res. 2016; 144(6): 823-30. https://dx.doi.org/10.4103/ijmr.IJMR_776_15.
- Al-Khafaji L.A., Al-Yawer M.A. Localization and counting of CD68-labelled macrophages in placentas of normal and preeclamptic women. AIP Conference Proceedings. 2017; 1888: 20011. https://dx.doi.org/10.1063/1.5004289.
- Schonkeren D., van der Hoorn M.L., Khedoe P., Swings G., van Beelen E., Claas F. et al. Differential distribution and phenotype of decidual macrophages in preeclamptic versus control pregnancies. Am. J. Pathol. 2011; 178(2): 709-17. https://dx.doi.org/10.1016/j.ajpath.2010.10.011.
- Vishnyakova P., Poltavets A., Nikitina M., Muminova K., Potapova A., Vtorushina V. et al. Preeclampsia: inflammatory signature of decidual cells in early manifestation of disease. Placenta. 2021; 104: 277-83. https://dx.doi.org/10.1016/j.placenta.2021.01.011.
Received 12.01.2022
Accepted 21.02.2022
Polina A. Vishnyakova, PhD, Senior Researcher, Laboratory of Regenerative Medicine, Academician V.I. Kulakov National Medical Research Center for Obstetrics, Gynecology and Perinatology, Ministry of Health of the Russian Federation; Assistant of the Department of Histology, Cytology and Embryology, Medical Institute, RUDN University,
p_vishnyakova@oparina4.ru, https://orcid.org/0000-0001-8650-8240, 117997, Russia, Moscow, Ac. Oparina str., 4.
Andrey V. Elchaninov, Dr. Med. Sci., Head of the Laboratory of Regenerative Medicine, Academician V.I. Kulakov National Medical Research Center for Obstetrics,
Gynecology and Perinatology, Ministry of Health of the Russian Federation,
elchandrey@yandex.ru, https://orcid.org/0000-0002-2392-4439,
117997, Russia, Moscow, Ac. Oparina str., 4.
Viktoria V. Kiseleva, Junior Researcher, Laboratory of Regenerative Medicine, Academician V.I. Kulakov National Medical Research Center for Obstetrics, Gynecology and Perinatology, Ministry of Health of the Russian Federation,
victoria.kurnosova.1991@gmail.com, https://orcid.org/0000-0002-3001-4820,
117997, Russia, Moscow, Ac. Oparina str., 4.
Kamilla T. Muminova, Ph.D., Researcher of 1st Department of Obstetric Pathology of Pregnancy, Academician V.I. Kulakov National Medical Research Center for Obstetrics, Gynecology, Perinatology, Ministry of Health of the Russian Federation,
k_muminova@oparina4.ru, https://orcid.org/0000-0003-2708-4366,
117997, Russia, Moscow, Ac. Oparina str., 4.
Zulfiya S. Khodzhaeva, Dr. Med. Sci., Professor, Deputy Director for Research, Institute of Obstetrics, Academician V.I. Kulakov National Medical Research Center
for Obstetrics, Gynecology, Perinatology, Ministry of Health of the Russian Federation,
zkhodjaeva@mail.ru, https://orcid.org/0000-0001-8159-3714,
117997, Russia, Moscow, Ac. Oparina str., 4.
Irina Z. Eremina, Ph.D., Associate Professor, Head of Educational Part of the Department of Histology, Cytology and Embryology, Medical Institute of the RUDN University,
eremina_iz@rudn.university, 117997, Russia, Moscow, Miklukho-Maklaya str., 8.
Timur Kh. Fatkhudinov, Dr. Med. Sci., Deputy Director, A.P. Avtsyn Research Institute of Human Morphology; Head of the Department of Histology,
Cytology and Embryology, Deputy Director for Research, Medical Institute of the RUDN University,
tfat@yandex.ru, https://orcid.org/0000-0002-6498-5764,
117997, Russia, Moscow, Miklukho-Maklaya str., 8.
Authors’ contributions: Vishnyakova P.A., Elchaninov A.V., Kiseleva V.V., Muminova K.T., Khodzhaeva Z.S., Eremina I.Z., Fatkhudinov T.Kh. – literature analysis; data summation; writing the article.
Conflicts of interest: The authors declare that there are no conflicts of interest.
Funding: The investigation has been conducted within the framework of State Assignment No. 121032500100-3. This has been also supported by the Russian Federation President’s grant MK-1573.2022.3 for young Russian scientists, candidates of sciences.
For citation: Vishnyakova P.A., Elchaninov A.V., Kiseleva V.V.,
Muminova K.T., Khodzhaeva Z.S., Eremina I.Z., Fatkhudinov T.Kh. The role of placental macrophages in physiological pregnancy and preeclampsia.
Akusherstvo i Ginekologiya/Obstetrics and Gynecology. 2022; 4: 5-12 (in Russian)
https://dx.doi.org/10.18565/aig.2022.4.5-12





