Прогнозирование исходов программ вспомогательных репродуктивных технологий (ВРТ) является актуальной проблемой, решение которой позволит оптимизировать лечение бесплодия. Одним из ключевых этапов, определяющих эффективность программ ВРТ и рождение здорового ребенка, является получение качественных гамет, в первую очередь ооцитов [1]. Оценка качества ооцитов весьма затруднительна в клинической практике, поскольку все имеющиеся на сегодняшний день методы молекулярно-генетической диагностики сопряжены с гибелью изучаемых клеток и не подходят для изучения единичных живых клеток. В связи с этим поиск объектов, изучение которых позволит оценить качество ооцитов и, таким образом, прогнозировать исходы программ ВРТ, находится в эпицентре внимания ученых во всем мире.
Фолликулярная жидкость (ФЖ) является биологической окружающей средой ооцита и отражает влияние внешних факторов, в том числе овариальной стимуляции, на качество ооцитов [2]. Известно, что ФЖ секретируется клетками гранулезы и клетками теки, выстилающими стенку фолликула, а состав ФЖ включает различные соединения, включая цитокины, факторы роста и вазорегуляторные молекулы, а также прооксиданты и антиоксиданты [2].
Оксидативный стресс развивается вследствие дисбаланса между прооксидантными и антиоксидантными системами организма. Развитие оксидативного стресса может приводить к повреждению различных клеточных компонентов – липидов, белков, углеводов, молекул ДНК. Роль оксидативного стресса продемонстрирована в патогенезе преэклампсии [3], синдрома поликистозных яичников [4], нарушений рецептивности эндометрия [5] и мужского бесплодия [6]. При этом влияние оксидативного стресса на процессы фолликулогенеза и оогенеза на сегодняшний день изучено недостаточно. Данные о качестве ооцитов, эмбрионов и клинических исходах программ ВРТ при разном уровне маркеров оксидативного стресса отличаются в различных исследованиях [7, 8]. В связи с этим представляется интересным оценить содержание маркеров оксидативного стресса в крови и в ФЖ пациенток с различными исходами лечения в программе ВРТ.
В качестве параметров, характеризующих уровень оксидативного стресса и активность антиоксидантных систем организма, нами были использованы малоновый диальдегид (МДА), cоотношение восстановленного глутатиона к окисленному глутатиону (GSH/GSSG) и ферментативная активность каталазы. МДА является конечным продуктом перекисного окисления липидов. Поскольку МДА является стабильным продуктом, его используют в качестве маркера кумулятивного эффекта перекисного окисления липидов [9]. Каталаза – один из основных ферментов антиоксидантной защиты, который осуществляет разрушение перекиси водорода до воды и молекулярного кислорода [10]. Соотношение восстановленного глутатиона (GSH) к окисленному глутатиону (GSSG) составляет основу клеточного окислительно-восстановительного гомеостаза и отображает уровень оксидативного стресса в целом.
Цель исследования: оценить информативность маркеров оксидативного стресса в крови и ФЖ пациенток в прогнозировании исходов программ ВРТ.
Материал и методы исследования
В проспективное когортное исследование были включены 108 супружеских пар с бесплодием различного генеза, нормальным кариотипом, отсутствием противопоказаний к лечению методами ВРТ и подписанным информированным согласием на участие в исследовании. В зависимости от исхода изученного цикла ВРТ все пациентки были разделены на 2 группы – группу 1 составили 38 пациенток с наступившей клинической беременностью, группу 2 – 70 женщин с отсутствием беременности в результате цикла ВРТ. Критериями включения были возраст пациенток от 18 до 42 лет, наличие регулярного менструального цикла и двух функционирующих яичников. Критерием исключения было наличие тяжелой формы патозооспермии у мужчины (концентрация сперматозоидов менее 100 000/мл, наличие менее 4% морфологически нормальных сперматозоидов по строгим критериям Крюгера, а также наличие азооспермии) и верифицированного синдрома поликистозных яичников. Другими критериями исключения служили развитие синдрома гиперстимуляции яичников средней или тяжелой степени, а также другие причины и осложнения, требующие отмены переноса эмбрионов в изучаемом цикле. Перед включением в протокол ЭКО все женщины были обследованы согласно Приказу Минздрава России от 30.08.12 №107н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и показаниях к их применению».
Стимуляцию функции яичников во всех случаях проводили по протоколу с антагонистами гонадотропин рилизинг-гормона с применением рекомбинантного фолликулостимулирующего гормона (ФСГ) или комбинированного препарата рекомбинантного ФСГ и лютеинизирующего гормона (ЛГ). Триггер овуляции вводили при наличии более двух лидирующих фолликулов в яичниках диаметром 17 мм и более. В качестве триггера овуляции использовали человеческий хорионический гонадотропин (ХГЧ) в дозе 8 000–10 000 МЕ. Поддержку лютеиновой фазы индуцированного цикла у всех пациенток проводили по стандартному протоколу с назначением натурального микронизированного прогестерона интравагинально в дозе 600 мг в сутки после трансвагинальной пункции яичников.
Образцы крови были отобраны в день пункции яичников. Часть крови замораживали немедленно в виде цельной крови для последуещего измерения уровня GSH/GSSG, другую часть центрифугировали при 4000g в течение 10 минут при температуре 4°С, отбирали полученную плазму и замораживали. Образцы ФЖ получали в момент пункции яичников под ультразвуковым контролем из фолликулов диаметром более 15 мм, но менее 24 мм. Исследованию подлежали образцы неконтаминированной кровью ФЖ, полученные только при пункции первого фолликула в каждом яичнике, при условии содержания в данном фолликуле ооцита. Аликвоту ФЖ сразу после забора центрифугировали при 4000g в течение 10 минут при температуре 4°С. Критерием отбора ФЖ служила величина поглощения гемоглобина, отражающая степень контаминации клетками крови и продуктами их лизиса. Образцы ФЖ и сыворотки крови хранили при температуре (-80°С) до начала исследования, которое было проведено одномоментно после окончания сбора образцов. В плазме крови оценивали ферментативную активность каталазы и концентрацию МДА, в цельной крови GSH/GSSG. В ФЖ измеряли ферментативную активность каталазы и концентрацию МДА.
Эмбриологический этап проводили по стандартным методикам, перенос эмбрионов осуществляли на 4–5-е сутки культивирования. При наличии подъема уровня сывороточного ХГЧ через 14 дней после переноса эмбрионов в полость матки регистрировали биохимическую беременность, а при визуализации плодного яйца в полости матки через 21 день после переноса – клиническую беременность.
Для статистического анализа использовался пакет статистических программ Statistica 10 (США). Различия между статистическими величинами считали статистически значимыми при уровне достоверности р<0,05.
Исследование было одобрено этическим комитетом ФГБУ НЦАГиП им. акад. В.И. Кулакова Минздрава России.

Результаты исследования
Пациентки с наступившей клинической беременностью были младше: средний возраст составил 32,3±4,6 года в группе 1 и 35,4±4,9 года в группе 2 (р=0,0019). Антропометрические характеристики и индекс массы тела не различались в двух группах. Социально-экономические характеристики (уровень образования, семейное положение, наличие или отсутствие работы) также не различались в группах сравнения. Женщины обеих групп не отличались по менструальной функции, соматической заболеваемости и наличию вредных привычек. Кроме того, не было выявлено статистически значимых различий при оценке гинекологической заболеваемости, включая наличие эндометриоза, миомы матки, воспалительных заболеваний органов малого таза и заболеваний шейки матки в анамнезе. Анамнез гинекологических операций (тубэктомии, пластика маточных труб), акушерский анамнез, причина и длительность бесплодия, а также наличие и количество проведенных циклов ЭКО в анамнезе не различались между группами.
При оценке лабораторных данных пациенток не было выявлено значимых различий в показателях клинического и биохимического анализа крови, гемостазиограммы и общего анализа мочи в группах сравнения. При этом уровень антимюллерового гормона (АМГ) был значимо выше в группе пациенток с наступившей в результате ЭКО беременностью и составил 3,9±2,8 нг/мл в группе 1 и 2,7±1,8 нг/мл в группе 2 (р<0,0001). Не было выявлено статистически значимых различий между группами по уровню ФСГ, ЛГ, эстрадиола, кортизола, 17-ОН-прогестерона, пролактина, свободного тестостерона, соматотропного гормона, тиреотропного гормона и свободного тироксина. Гормональные параметры оценивали на 2–3-й день менструального цикла в цикле, предшествующем началу овариальной стимуляции.
Длительность стимуляции и суммарная доза экзогенных гонадотропинов, а также частота назначения различных препаратов гонадотропинов (ФСГ или ФСГ/ЛГ) не различались между группами.
При оценке параметров фолликулогенеза и оогенеза отмечено, что среднее число ооцитов и среднее число зрелых ооцитов в расчете на одну пациентку было выше в группе с наступившей беременностью. Среднее число ооцитов составило 8,3±3,9 в группе 1 и 5,4±2,9 в группе 2 (р=0,0001). Среднее число зрелых ооцитов составило 6,8±3,1 в группе 1 и 4,6±2,6 в группе 2 (р=0,0002). Частота оплодотворения, параметры эмбриогенеза, среднее число эмбрионов различного качества на одну пациентку не различались в группах сравнения.
При оценке параметров оксидативного стресса отмечено, что уровень МДА в крови пациенток был значимо выше в группе 2 и составил 4,9±0,7 по сравнению с 4,5±0,7 в группе 1, р=0,0473. При этом ферментативная активность каталазы не различалась в группах сравнения, как и соотношение GSH/GSSG. Также не было выявлено значимых различий между содержанием маркеров оксидативного стресса и параметрами антиоксидантной системы в ФЖ пациенток обеих групп (табл. 1).
Таким образом, в данной категории пациенток на наступление беременности в результате программы ЭКО влияли возраст пациентки, уровень АМГ, уровень МДА в крови и число полученных зрелых ооцитов. Для оценки вероятности наступления беременности в зависимости от данных параметров был использован многофакторный анализ (логистическая регрессия). Ввиду сильной корреляции между возрастом женщины, уровнем АМГ и числом полученных зрелых ооцитов, в модель были включен только один параметр – АМГ. На основании данных многофакторного анализа была построена формула для расчета индивидуального риска наступления беременности в зависимости от базального уровня АМГ и уровня МДА в день трансвагинальной пункции.

Р (Б) – вероятность наступления беременности
МДА – уровень МДА в крови в день трансвагинальной пункции
АМГ – уровень базального АМГ в крови пациентки
Данная модель обладала высокой специфичностью (94,9%) и низкой чувствительностью (35,0%). Точность модели составила 74,6%.
На втором этапе исследования были оценены факторы, имеющие связь с уровнем МДА в крови пациенток в день трансвагинальной пункции отдельно для пациенток группы 1 и группы 2.
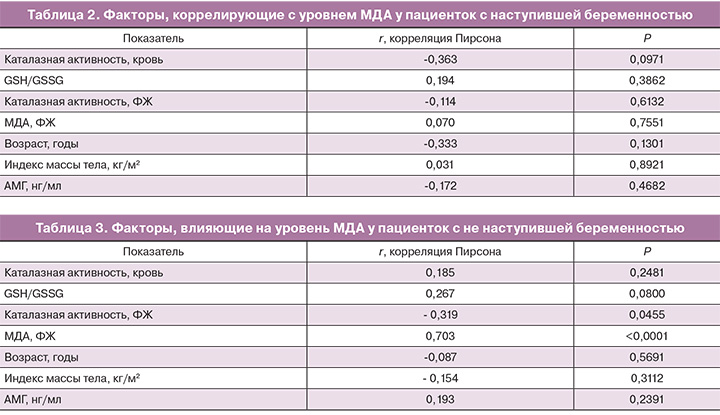
В группе беременных женщин уровень МДА не имел корреляционной связи с другими маркерами оксидативного стресса и с клинико-лабораторными характеристиками пациенток (табл. 2). Ферментативная активность каталазы имела погранично значимую слабую отрицательную корреляционную связь с уровнем МДА в крови (р=0,0971). Интересно отметить, что уровень МДА в крови не коррелировал с уровнем МДА в ФЖ (р=0,7551).
Затем были оценены факторы, коррелирующие с уровнем МДА у пациенток, у которых в результате изученного цикла ВРТ беременность не наступила. Уровень МДА в крови имел статистически значимую сильную положительную корреляцию с уровнем МДА в ФЖ (r=0,703, p<0,0001) и статистически значимую отрицательную корреляцию с ферментативной активностью каталазы в ФЖ (r=-0,319, p=0,0455) (табл. 3).
Обсуждение
В ходе проведенного исследования была определена значимость маркеров оксидативного стресса в прогнозировании исходов программ ВРТ. Создана модель прогноза наступления беременности, основанная на концентрации маркера оксидативного стресса МДА в плазме крови в день трансвагинальной пункции фолликулов и показателя, характеризующего овариальный резерв (АМГ). Данная прогностическая модель может быть использована в клинической практике для прогнозирования исходов ВРТ. ФЖ может быть получена в достаточном количестве в любом из циклов ВРТ, что делает ее удобным материалом для анализа.
Впервые показано влияние уровня МДА в крови пациенток на исходы программ ВРТ. В исследовании Pekel и соавт. (2015) уровень МДА в крови различался у пациенток с разными причинами бесплодия и был статистически значимо выше при ановуляторном бесплодии и бесплодии неясного генеза по сравнению с трубным и мужским факторами бесплодия [11]. Тем не менее, авторы не оценивали взаимосвязь уровня МДА в крови и ФЖ с частотой наступления беременности в результате лечения в программе ВРТ.
Преимуществом нашего исследования является комплексный анализ уровня маркеров оксидативного стресса и активности антиоксидантного фермента каталазы как в крови, так и в ФЖ пациенток, а также оценка как эмбриологических, так и клинических исходов программ ВРТ.
Внимания заслуживают данные, полученные при оценке факторов, коррелирующих с уровнем МДА в крови пациенток, у женщин с различным исходом лечения. У пациенток с наступившей беременностью была отмечена слабая отрицательная корреляция уровня МДА в крови и ферментативной активности каталазы в крови и не было корреляции с уровнем МДА в ФЖ. При этом в группе с ненаступившей беременностью уровень МДА в крови имел сильную положительную связь с уровнем МДА и слабую отрицательную связь с ферментативной активностью каталазы в ФЖ и не коррелировал с активностью каталазы в крови.
Полученные данные свидетельствуют о нарушении адаптивного ответа антиоксидантной системы у женщин с ненаступившей беременностью, что приводит к развитию системного окислительного стресса, затрагивающего в том числе фолликулы, и ухудшению качества гамет.
Заключение
Таким образом, проявления системного оксидативного стресса могут приводить к неудачам ЭКО, что реализуется, вероятнее всего, за счет снижения качества ооцитов и эмбрионов. В пользу данной гипотезы свидетельствует тот факт, что у пациенток с неудачами ЭКО уровень маркеров оксидативного стресса был значимо выше в крови пациенток, что оказывало влияние на уровень прооксидантов в ФЖ.
При этом факторы, влияющие на взаимосвязь между уровнем про- и антиоксидантов в крови и ФЖ пациенток на сегодняшний день не до конца изучены и требуют дальнейшего уточнения. Несмотря на то, что все пациентки находились примерно в равных условиях – во всех случаях стимуляцию суперовуляции проводили по протоколу с антагонистами гонадотропин рилизинг-гормона, длительность стимуляции и суммарная доза гонадотропинов не различались между группами, были выявлены существенные различия в показателях оксидативного стресса в группах женщин с различными исходами ВРТ. Мы предполагаем участие генетических особенностей, в первую очередь полиморфизмов генов, кодирующих синтез ферментов антиоксидантной защиты, в развитии неудач ЭКО у женщин с высоким уровнем прооксидантов в крови. Данная гипотеза является актуальной темой для проведения дальнейших исследований.



