Подавляющее (98%) большинство всех опухолей вульвы являются доброкачественными, на долю злокачественных приходятся лишь 1–2% [1]. Злокачественные новообразования вульвы составляют только 4% всех гинекологических новообразований и занимают 4-е место в структуре онкогинекологической заболеваемости, уступая опухолям шейки матки, тела матки и яичника. Частота встречаемости злокачественных опухолей вульвы составляет от 1 до 3 случаев на 100 000 женского населения и увеличивается с возрастом; смертность оценивается в 0,3 случая на 100 000 женского населения.
Саркомы вульвы
Саркомы вульвы встречаются крайне редко, на их долю приходится <1% всех злокачественных опухолей вульвы. Среди сарком вульвы наиболее часто наблюдаются лейомиосаркомы (ЛМС) [2–4]. ЛМС вульвы чаще встречаются у женщин среднего (40–50 лет) и старшего возраста (60–70 лет), возрастной диапазон составляет 20–68 лет, средний возраст больных соответствует 30–40 годам, в литературе описан случай ЛМС у пациентки в возрасте 14 лет [5, 6].
 Опухоль чаще всего локализуется в области бартолиновой железы, в типичном для кист бартолиновых протоков месте, поэтому ее клинические проявления сходны с проявлениями воспалительных процессов бартолиновой железы, что приводит к трудностям в диагностике [4] (рис. 1). Заболевание характеризуется неспецифическими клиническими проявлениями, часто приводящими к ошибочному диагнозу, нередко первоначальный диагноз указывается как бартолиновая киста или абсцесс [5]. ЛМС вульвы по гистологическим характеристикам схожа с ЛМС других локализаций. Наиболее частой локализацией ЛМС являются большие половые губы (52%), на 2-м месте – малые половые губы (18%), далее клитор (10–15%) и бартолиновы железы (1–3%) [2].
Опухоль чаще всего локализуется в области бартолиновой железы, в типичном для кист бартолиновых протоков месте, поэтому ее клинические проявления сходны с проявлениями воспалительных процессов бартолиновой железы, что приводит к трудностям в диагностике [4] (рис. 1). Заболевание характеризуется неспецифическими клиническими проявлениями, часто приводящими к ошибочному диагнозу, нередко первоначальный диагноз указывается как бартолиновая киста или абсцесс [5]. ЛМС вульвы по гистологическим характеристикам схожа с ЛМС других локализаций. Наиболее частой локализацией ЛМС являются большие половые губы (52%), на 2-м месте – малые половые губы (18%), далее клитор (10–15%) и бартолиновы железы (1–3%) [2].
Опухоль характеризуется быстрым ростом, при этом клинически может протекать бессимптомно, а может проявляться хроническим зудом в области вульвы в течение длительного времени. Специалисты обсуждают роль хронического воспаления как предшественника малигнизации. Действительно, сообщалось о случаях, связанных со склерозирующим лишаем, хотя специфических этиологических и патогенетических факторов в большинстве исследований не выявлено [7].
В литературе описаны казуистические случаи ЛМС, ассоциированной с беременностью [8].
ЛМС, как и доброкачественная лейомиома, проявляет иммунореактивность к мышечным маркерам, а именно к десмину, гладкомышечному актину и мышечноспецифическому актину [5]. На сегодняшний день самым специфичным для гладкомышечной дифференцировки считается h-кальдесмон. Также возможна фокальная экспрессия маркера S-100 и цитокератинов [2, 5]. В отличие от доброкачественных опухолей, ЛМС характеризуется повышенной экспрессией Ki-67 и белка р53 [2, 9].
Ряд авторов предлагают для дифференциальной диагностики лейомиом от ЛМС использовать следующие критерии: диаметр опухоли >5 см, инфильтративный характер роста, митотический индекс >5 в 10 полях зрения, цитологическая атипия от умеренной до тяжелой.
При этом авторы для постановки диагноза ЛМС руководствуются наличием как минимум 3 из вышеупомянутых критериев [9, 10].
В большинстве публикаций демонстрируется крайне неблагоприятное течение заболевания [2–4]. Опухоль характеризуется быстрым ростом, высоким метастатическим потенциалом, частыми рецидивами, агрессивным поведением и высоким уровнем смертности [3]. Прогноз зависит главным образом от размера опухоли и вовлечения соседних тканей [9, 10]. Основную роль в прогнозировании заболевания отводят митотической активности опухоли. Хирургический метод является основным в лечении ЛМС вульвы [7]. Прогноз может быть благоприятным в случае полного хирургического удаления опухоли при отсутствии отдаленных метастазов [11].
В качестве возможного адъювантного лечения ряд авторов рассматривают лучевую терапию [12, 13]. Лучевая терапия оказалась эффективной у большинства пациенток после хирургического лечения [14], адъювантная лучевая терапия снижает риск развития рецидива [9, 10].
Карциносаркома представляет собой редкую смешанную мезодермальную опухоль [15, 16]. Характеризуется содержанием в своей структуре 2 компонентов: как саркомы, так и карциномы, причем элементы карциномы обычно железистые, тогда как саркоматозный компонент может быть любого гистологического типа: остеосаркома, хондросаркома, ЛМС и др. [15]. Клинические проявления заключаются в формировании опухолевого полипа с эндо- или экзофитным ростом, сопровождающимся кровотечением [16]. Метастазирование в лимфатические узлы обычно характерно только для эпителиального (карциноматозного) компонента [17].
Дерматофибросаркома (выбухающая саркома) вульвы (ДФС) – поверхностная фибробластическая неоплазия с характерной гистологической картиной и транслокацией t16,21 (WHO Classification of skin tumors, 2018). Чаще всего ДФС встречаются у пожилых женщин [18]. К настоящему времени в литературе описано не более 50 случаев ДФС. В большинстве случаев опухоль представлена одиночной твердой бляшкой красного или синего цвета, реже множественными мелкими подкожными узлами [18].
Гистологическая картина: опухоль состоит из слабополиморфных веретеновидных клеток, формирующих короткие пересекающиеся пучки и муаровые структуры с характерным сотовым рисунком инфильтрации подкожно-жировой клетчатки [19, 20]. Иммуногистохимически опухоль диффузно окрашивается CD34 [20].
Часто наблюдаются рецидивы, на фоне которых возможна прогрессия в фибросаркому, при этом потенциал метастазирования низкий [18, 19].
В качестве адъювантной терапии ДФС предлагается лучевая терапия [21]. Однако достоверно не доказано, что лучевая терапия обеспечивает снижение риска рецидива для этого подтипа саркомы, особенно в случаях полной резекции.
Рабдомиосаркома вульвы (РМС) чаще бывает представлена эмбриональной РМС и диагностируется в детском возрасте. РМС – наиболее распространенный тип сарком мягких тканей в детском возрасте, преимущественно до 15 лет [22], и может поражать любую часть тела [23]. В детском возрасте локализация этой опухоли на половых органах занимает 2-е место после головы и шеи, опухоль встречается преимущественно во влагалище или на шейке матки, реже на вульве. Гистологически РМС представлена примитивными мезенхимальными клетками на разных стадиях миогенеза, с различным содержанием рабдомиобластов. Опухоль редко встречается у взрослых.
Ботриоидная РМС представляет собой вариант эмбриональной РМС, типичной для возраста младше 8 лет (в среднем 3 года), однако в литературе встречается информация о случаях БРМС и у пожилых женщин [24]. Название происходит от сходства опухоли с виноградными гроздьями – ботриоидом (по-гречески). В случаях локализации опухоли на вульве или влагалище клиническим проявлением является аномальное кровотечение из половых путей, источником которого выступает сама полиповидная опухоль.
Собственные наблюдения
За период с 1968 по 2019 г. в ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова» Минздрава России (НМИЦ онкологии им. Н.Н. Петрова) зарегистрировано 6 случаев сарком вульвы у взрослых пациенток и 3 случая РМС у детей в возрасте 1 мес, 11 мес и 2 лет. Средний возраст взрослых пациенток составил 53,3 года (от 28 до 85 лет). В 2 случаях выявлена I стадия заболевания (морфологически – ЛМС), в остальных 4 – II стадия заболевания, из них в 2 случаях – ЛМС, в 1 – ДФС, еще в 1 – миксоидная веретеноклеточная саркома. Во всех случаях выполняли хирургическое лечение в объеме вульвэктомии. В дальнейшем 1-й пациентке с ЛМС II стадии проведена адъювантная лучевая терапия, 2 пациентки выбыли из наблюдения, 3 пациентки живы без признаков заболевания. Одна пациентка умерла через 5 лет после постановки диагноза в возрасте 90 лет от сопутствующей патологии (острое нарушение мозгового кровообращения). Двум девочкам с РМС в послеоперационном периоде проводили химиотерапию (лечение в 1968 г.). Обе пациентки (11 месяцев и 2 лет) погибли через год от прогрессирования заболевания. Только одна пациентка, которой в возрасте 1 месяца была иссечена опухоль размером до 1,5 см на большой половой губе, жива без рецидива заболевания (период наблюдения >40 лет). Данные представлены в таблице
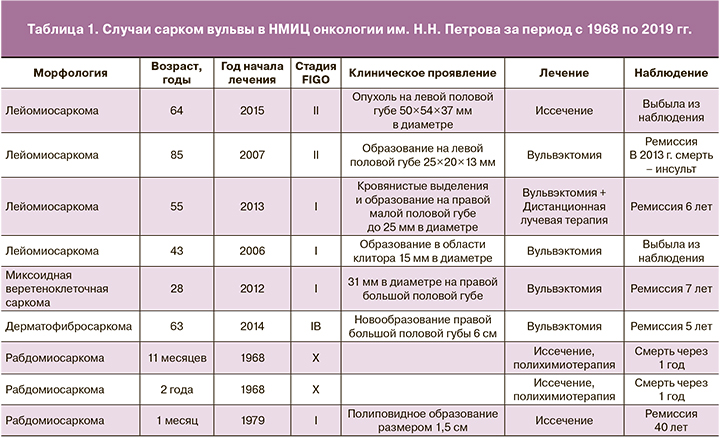
Меланома вульвы
Частота встречаемости меланомы вульвы составляет 0,48–1,40 случая на 1 млн ежегодно [25, 26]. Меланома вульвы обычно диагностируется в 5-м или 6-м десятилетии жизни (диапазон возраста больных 54–76 лет) [26, 27]. В крупном эпидемиологическом шведском исследовании за период с 1960 по 1984 г. из 245 пациенток с меланомой вульвы и влагалища (219 и 26 соответственно) 70% были старше 60 лет [28].
Прогноз пациенток с меланомой нижнего женского полового тракта неблагоприятный. По данным голландского регистра, за период с 1989 по 2012 г. из 6436 случаев злокачественных новообразований вульвы среди выявленных 350 пациенток с меланомой вульвы [29] общая 5-летняя выживаемость составила 35%. Стоит отметить, что 5-летняя общая выживаемость пациенток с меланомой вульвы увеличилась с 37% в 1989–1999 гг. до 45% в 2000–2012 гг.
 Прогностически важными факторами являются глубина инвазии и оценка состояния регионарных лимфатических узлов (ЛУ). В качестве прогностических переменных при меланоме вульвы были исследованы и другие факторы. Пожилой возраст пациенток с меланомой вульвы ухудшает прогноз заболевания. Общая 5-летняя выживаемость составляет 72% для пациенток в возрасте ≤68 лет против 47,7 % для женщин старше 68 лет [26].
Прогностически важными факторами являются глубина инвазии и оценка состояния регионарных лимфатических узлов (ЛУ). В качестве прогностических переменных при меланоме вульвы были исследованы и другие факторы. Пожилой возраст пациенток с меланомой вульвы ухудшает прогноз заболевания. Общая 5-летняя выживаемость составляет 72% для пациенток в возрасте ≤68 лет против 47,7 % для женщин старше 68 лет [26].
Меланома вульвы может быть представлена в виде пятен, папул или узелков неравномерной окраски с асимметричными границами (рис. 2) [30]. Для дифференциальной диагностики злокачественной опухоли от доброкачественных пигментных поражений, таких как невус вульвы и меланоз вульвы, в клинической практике используется дерматоскопия, особенно у молодых женщин. Невусы вульвы имеют тенденцию проявляться в виде равномерно пигментированных папул или макул размером около 1 см с правильными границами, окрашенных от красного до темно-коричнево-черного цвета, в то время как меланоз вульвы характеризуется одиночными или множественными неравномерно пигментированными пятнами от коричневого до черного цвета или пятнами с неровными границами. До 27% случаев меланомы вульвы являются амеланотическими [31].
Наиболее распространенными участками меланомы вульвы являются клиторальная область и большие половые губы, затем малые половые губы и периуретральная область, однако частая многоочаговая природа опухоли осложняет идентификацию одного конкретного участка [29, 31].
Подобно лечению рака вульвы, влагалища и шейки матки, хирургический подход к лечению меланомы данных локализаций изменился от обширных циторедуктивных операций (экзентерация таза) к органосохраняющим. Ранние исследования предлагали первичную радикальную агрессивную операцию для меланом нижнего женского полового тракта. Широкое иссечение в пределах здоровой ткани следует рассматривать как оптимальный объем хирургического лечения [32–35]. При этом необходимо отступать от опухоли на 1 или 2 см здоровой ткани в зависимости от глубины инвазии меланомы по Бреслоу. Для ранних стадий (IA–IIC по FIGO) меланомы вульвы не используется картирование сигнального лимфатического узла, для поздних стадий (III–IV по FIGO) необходимо исследование сигнального ЛУ. Если сигнальный ЛУ положителен с одной стороны, выполняется односторонняя паховая лимфаденэктомия, если сигнальный ЛУ положителен с обеих сторон – двусторонняя паховая лимфаденэктомия .
Таким образом, хирургический объем лечения меланомы вульвы зависит от объема образования, размера опухоли, глубины инвазии. Радикально может быть выполнено широкое иссечение опухоли в пределах здоровой ткани, тотальная вульвэктомия или вагинэктомия, или гистерэктомия с вагинэктомией и вульвэктомией, или экзентерация таза в зависимости от локализации опухоли [33, 35–37]. Пациентки, получившие хирургическое лечение, имели значительно более длительную общую выживаемость, в отличие от тех, кто не получал хирургическое лечение [38, 39]. Gadducci A. и соавт. в 2018 г. разработали алгоритм лечения меланом нижнего женского полового тракта.
Стадия IA–IIC по классификации FIGO (толщина опухоли 1–4 мм, без метастазов в ЛУ): радикальное иссечение первичной опухоли в пределах здоровых тканей (отступ 1 см по окружности) для меланомы толщиной по Бреслоу до 2 мм и 2 см – для более толстых опухолей. Двусторонняя биопсия сигнального ЛУ. Широкого иссечения опухоли достаточно, если сигнальный ЛУ отрицательный. Если сигнальный ЛУ положительный, лечение выполняется как для III стадии. При подозрительных паховых ЛУ (клинически или инструментально – УЗИ, КТ, МРТ, ПЭТ) выполняется биопсия, при гистологическом подтверждении – паховая лимфаденэктомия, как при III стадии.
Стадия III по классификации FIGO (опухоль любой толщины с метастазами в ЛУ, без отдаленных метастазов): радикальное иссечение первичной опухоли в пределах здоровых тканей, как рекомендовано для стадии IA–IIC; возможна радикальная вульвэктомия. Если сигнальный ЛУ положительный с одной стороны, выполняется односторонняя паховая лимфаденэктомия, если сигнальный ЛУ положительный с обеих сторон – двусторонняя паховая лимфаденэктомия.
Стадия IV по классификации FIGO: возможно иссечение первичной опухоли в пределах здоровых тканей, как рекомендовано для стадии IA–IIC; можно выполнить радикальную вульвэктомию. Оценка ЛУ как при III стадии. Иссечение метастатических очагов.
Собственные наблюдения
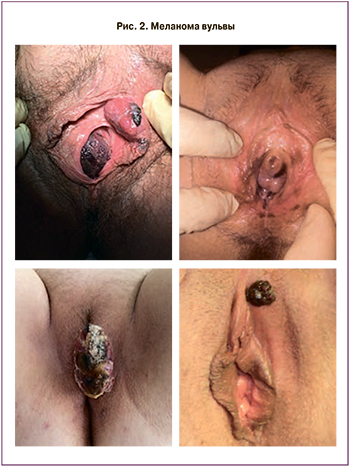
За период с 1978 по 2019 г. в НМИЦ онкологии им. Н.Н. Петрова зарегистрировано 9 случаев меланомы вульвы (табл. 2). Средний возраст пациенток составил 56,7 года (от 36 до 83 лет). По стадиям пациентки распределились следующим образом: стадия IA – 2, IB – 2, IIC – 1, III – 3, IV – 1. Хирургическое лечение выполнено 8 пациенткам, лишь 1 пациентка с IV стадией заболевания в качестве первичного лечения получила монохимиотерапию. Адъювантную терапию не проводили пациенткам с ранними стадиями заболевания (IA–IC), для определения тактики послеоперационного лечения в случае распространенной формы меланомы (III и IV стадий) выполняли молекулярно-генетическое исследование. Из обследованных 4 пациенток только у 1 с III стадией заболевания выявлена мутация V6000E в гене BRAF. Ей была проведена таргетная терапия дабрафенибом и вемурафенибом, достигнут частичный регресс метастатических очагов. Учитывая отсутствие мутаций у 2 других пациенток с III стадией, была проведена комбинированная химиотерапия с иммунотерапией. В 1-м случае терапия представляла комбинацию дакарбазина с альфа-глобулином, диагностировано прогрессирование заболевания, в качестве 2-й линии терапии проведено 2 цикла полихимиотерапии по схеме CDV (дакарбазин + винбластин + цисплатин), отмечено дальнейшее прогрессирование с метастатическим поражением легких, шейки матки и влагалища, пациентка умерла через 24 месяца после начала лечения. Во 2-м случае пациентке в адъювантном режиме проведена вакцинотерапия в комбинации с циклофосфамидом, на фоне лечения отмечено прогрессирование заболевания в легкие, внутригрудные ЛУ и мягкие ткани малого таза, рекомендована смена лекарственной терапии на монохимиотерапию дакарбазином, пациентка умерла от прогрессирования опухолевого процесса через 23 месяца после начала лечения. Из всех 9 случаев меланом вульвы прослежены 8, медиана наблюдения составила 23,75 (12–48) мес. Без признаков рецидива заболевания живы 4 пациентки, умерли (через 12, 23, 24 и 24 месяцев) – 4.
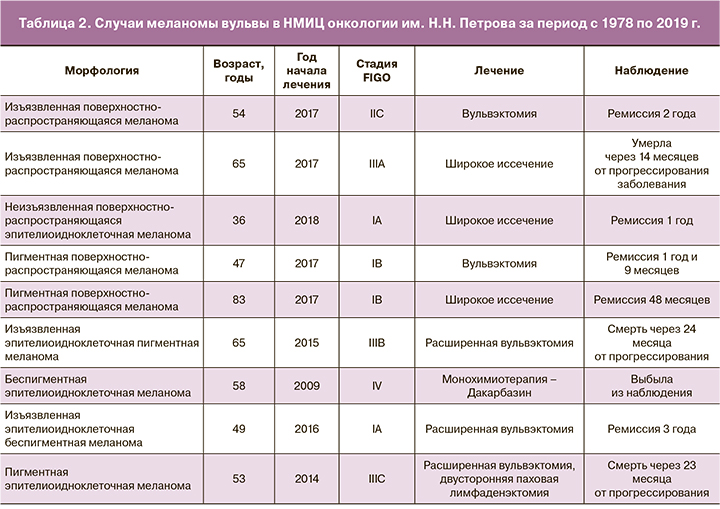
Болезнь Педжета вульвы
Экстрамаммарная болезнь Педжета (ЭМБП) вульвы впервые была описана в 1901 г. [40]. На ее долю приходится от 1 до 2% всех злокачественных опухолей вульвы [41]. ЭМБП вульвы наиболее распространена среди европейских женщин, чаще диагностируется у пациенток в период постменопаузы, с более высоким индексом массы тела, а также среди тех, кто применял заместительную гормональную терапию [42].
Всемирная организация здравоохранения (ВОЗ) определяет болезнь Педжета вульвы как «внутриэпителиальное новообразование эпителиального происхождения, начало которого берется из апокриновых или эккриновых протоков, характеризуются характерными крупными клетками с выраженной цитоплазмой, называемыми клетками Педжета» [43]. В Международном обществе по изучению терминологии и классификации вульвовагинальных заболеваний (ISSVD) дерматологических нарушений вульвы (2011 г.) ЭМБП вульвы относится к морфологической группе 2, описанной как «красные поражения, пятна и бляшки» и к подгруппе B – «красные пятна и бляшки (без разрушения эпителия)» [44].
Диагноз ставится на основании гистологического исследования пункционной биопсии, морфологическая картина демонстрирует клетки Педжета, которые распространены по всему эпидермису [45]. ЭМБП вульвы делится на два типа: интраэпителиальный и инвазивный. Прогноз ЭМБП вульвы является благоприятным, однако частота рецидивов составляет около 40%, а риск развития инвазивной карциномы достигает 8%.
Клиническое проявление заболевания может протекать бессимптомно или проявляться болью, жжением и зудом в области вульвы. При физикальном обследовании опухолевое образование обычно представлено гиперкератозом с белыми чешуйками и эритематозными пятнами (рис. 3) [46, 47].
Морфологическая картина болезни Педжета вульвы характеризуется наличием крупных овальных или полиядерных интраэпителиальных клеток, которые имеют бледную цитоплазму и крупные ядра с выдающимися ядрышками, которые представляют собой так называемые клетки Педжета. Клетки Педжета окрашиваются гематоксилином-эозином (HE). Они располагаются по отдельности или в кластерах по всему эпителию в различной степени и могут образовывать просвет или железоподобные структуры. Иногда реактивные изменения наблюдаются на окружающей эпителиальной поверхности, такие как акантоз, папилломатоз и гиперкератоз; сами по себе эти изменения недостаточны для диагностики. В нижележащей папиллярной дерме можно увидеть лихеноидный воспалительный инфильтрат. Инвазия характеризуется наличием дисгезирующих опухолевых клеток Педжета, проникающих в нижележащую дерму или подслизистую оболочку. В случае инвазии патолог должен сообщать о глубине инвазии, поскольку это имеет прогностическое значение и определяет тип лечения [48, 49].
Оптимальным лечением ЭМБП вульвы является хирургическое удаление, объем оперативного вмешательства главным образом зависит от размера опухоли. Операции на вульве часто сопровождаются осложнениями. Местные осложнения возникают в основном из-за инфекций, гематом и несостоятельности раны, причем показатели осложнений колеблются в пределах 9–45% [50–52]. Согласно оценкам качества жизни, обширные операции, такие как радикальная вульвэктомия, имеют тенденцию вызывать больший дискомфорт, чем при широком местном иссечении [53].
Хирургический метод лечения не всегда возможен или желателен из-за местоположения или обширного поражения тканей промежности. Кроме того, частота рецидивов после хирургического лечения высока [41, 54]. В этих случаях предпочтение отдается не менее эффективному методу лечения – лучевой терапии (дистанционному облучению вульвы). Возможной опцией лечения рассматривается также фотодинамическая терапия [55].
Собственные наблюдения
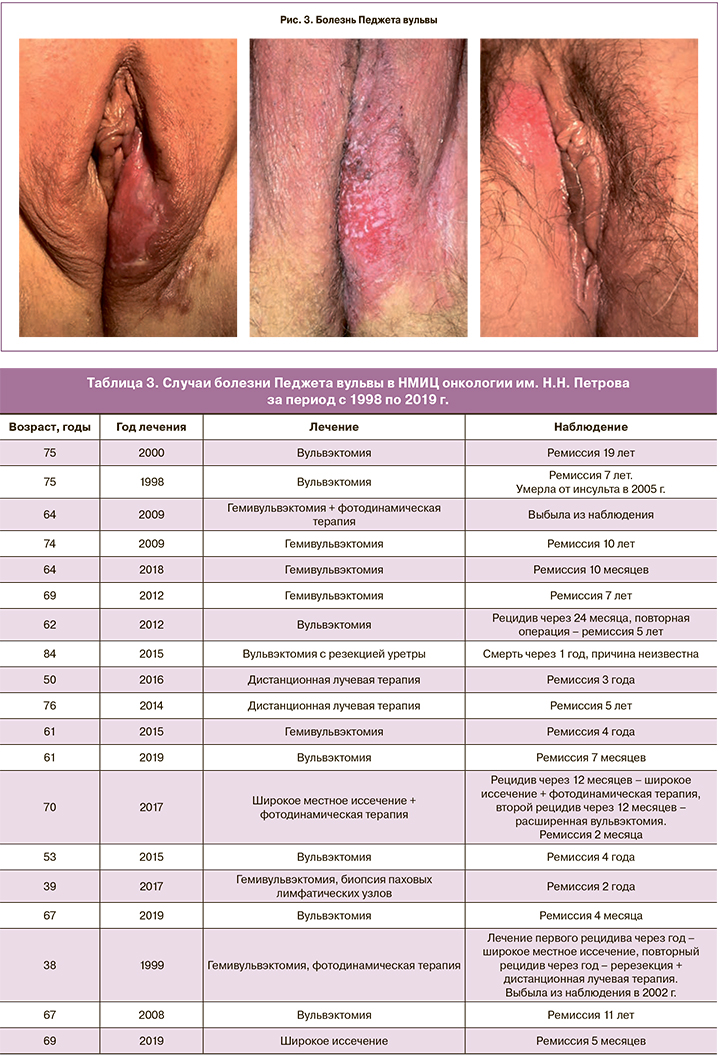
За период с 1998 по 2019 г. в НМИЦ онкологии им. Н.Н. Петрова зарегистрировано 19 случаев ЭМБП вульвы. Средний возраст всех пациенток составил 64,1 года (от 38 до 84 лет). Хирургическое лечение выполнено 17 пациенткам (у 8 выполнена вульвэктомия, у 9 – гемивульвэктомия), лишь 2 пациенткам с обширным распространением заболевания, в качестве первичного лечения, проведена дистанционная лучевая терапия. У 3 пациенток диагностирован рецидив заболевания, у 1 – через 24 месяца, ей проведено повторное хирургическое иссечение, общее время ремиссии составляет 60 месяцев; у 1 пациентки через год диагностирован рецидив заболевания и переход в инвазивную форму карциномы, по поводу которого выполнена вульвэктомия, пациентка выбыла из наблюдения через 2 года, 1 – в настоящее время выполнена вульвэктомия. Медиана наблюдения составила 53 месяца (от 1 месяца до 19 лет). За весь период наблюдения 2 пациентки умерли: одна от острого нарушения мозгового кровообращения, другая – от прогрессирования заболевания. Две пациентки из наблюдения выбыли. Данные представлены в табл. 3.
Заключение
К редким злокачественным опухолям вульвы относят крайне агрессивные заболевания с неблагоприятным прогнозом, такие как саркомы и меланома, а также встречаются заболевания с относительно благоприятным прогнозом, такие как экстрамаммарная болезнь Педжета вульвы.
На прогноз лечения и общей выживаемости влияют различные факторы: размер опухоли, глубина инвазии, раса, сопутствующая патология, стадия заболевания. При диагностировании любой редкой формы злокачественной опухоли вульвы необходимы специализированная помощь и индивидуализированный междисциплинарный подход.



